第一节 免疫学诊断(Immunodiagnosis)
免疫学诊断是通过免疫学的基本原理和技术检测临床标本中的成分、特征和功能,为临床疾病诊断、治疗和预后判断提供试验依据。免疫学检测范围包括两部分:一是利用免疫学原理和技术检测抗原、抗体、补体、细胞因子、细胞黏附分子或具有免疫活性的细胞等免疫相关物质;二是利用免疫学原理和技术检测人体、环境中的微量物质,如激素、酶、血浆中微量蛋白、血液药物浓度及微量元素等。标本中物质具有免疫反应性可以和相应抗体结合或含有抗体可以和相应抗原结合或本身具有免疫学活性。其检测原理主要有两方面:抗原抗体反应的特异性,用已知的抗原(抗体)来检测未知的抗体(抗原);免疫细胞和分子的免疫学功能和生物学活性。
一、抗原抗体检测原理
抗原抗体反应(antigen and antibody reaction)是指抗原与相应抗体之间发生的特异性结合反应。抗原抗体反应在体内表现为中和作用、促进吞噬、溶细胞、杀菌或免疫病理损伤等;在体外根据抗原的物理性状、抗体的类型及参与反应的介质(例如电解质、补体、固相载体)不同,可出现凝集、沉淀和溶血等各种不同的现象。体外抗原抗体反应又称为血清学反应(serological reaction)。抗原与抗体发生结合的物质基础,是抗原分子表位与抗体分子超变区之间空间结构的互补性结合。抗原抗体结合具有以下特点。
1.特异性
特异性指抗原抗体结合反应的专一性,即一种抗原只能与由它刺激所产生的抗体结合。特异性是抗原抗体反应最基本的特点。抗原与抗体的结合力取决于二者空间构型互补的程度,其结合力的大小常用亲和力表示,前者指抗体分子上一个抗原结合部位与相应抗原表位的结合强度,互补程度越高,亲和力越高。后者指一个抗体分子与整个抗原之间的结合强度,其与抗原表位的数目相关。
2.可逆性
抗原与抗体的结合为非共价键的可逆结合,结合虽稳定但可逆。在环境改变时(如低pH值、高浓度盐、冻融等),抗原抗体复合物可被解离。解离后的抗原、抗体仍可保持原有的理化和生物学活性。根据此特点,一方面可借助亲和层析纯化抗原、抗体,另一方面,在抗原、抗体反应检测中,要保持结合环境的稳定。
3.比例性
天然蛋白抗原一般是多价的,拥有多种抗原表位,可以和多个抗体分子结合。单体形式的抗体分子是二价,能结合两个相同的抗原表位。当抗原、抗体的数目比例合适时,抗体分子的两个Fab段分别结合两个抗原分子,相互交叉连接成网格状复合物,反应体系中基本无游离的抗原或抗体,在一定条件下,有明显的反应物(沉淀或凝集)形成,肉眼可见。在抗原和抗体比例不合适时,过剩一方的结合价不能完全占据,多呈游离的小分子复合物形式,或所形成的复合物易解离,不能肉眼观测到,此为带现象(zone phenomenon)。当抗体过量时称为前带,抗原过量称为后带。
抗原、抗体反应可分为两个阶段。第一阶段为特异性结合阶段。抗原与特异性抗体相遇迅速发生结合,仅需要数秒至数分钟,但不出现可见反应。第二阶段为可见反应阶段,这一阶段抗原抗体复合物在环境因素的影响下,进一步交联和聚集,表现凝集、沉淀、细胞溶解等肉眼可见的现象。此阶段反应慢,往往需要数分钟至数小时。抗原抗体反应受多种因素的影响。一方面是抗原、抗体的自身因素。抗体的特异性亲和力和种类;抗原的理化性质、表位数目和种类等。另一方面是环境因素,主要有电解质、酸碱度和温度等。适宜的环境可以增加抗原抗体分子的碰撞机会,加快二者结合的速度;增强分子间引力,促进抗原抗体紧密接触。特别是抗原、抗体应符合一定比例关系,二者比例恰当时,才能形成可见反应。
二、抗原、抗体检测方法
根据抗原的性质、参与反应成分、出现的反应现象不同,可将抗原、抗体反应分为凝集反应、沉淀反应、补体参与反应以及采用标记物的抗原、抗体反应等。
1.凝集反应
颗粒性抗原(如细胞、细菌等)与相应抗体结合后,在一定条件下形成肉眼可见的凝集团块,这类抗原、抗体反应称为凝集反应(agglutination),如图21-1所示。
(1)直接凝集将细菌或红细胞与相应抗体直接反应,出现细菌或红细胞凝集现象。一种方法是玻片凝集试验,用于定性检测抗原,如ABO血型鉴定、细菌鉴定。另一种方法是试管凝集试验,在试管中倍比稀释待检测的血清,加入已知颗粒性抗原,用于半定量检测抗体,如诊断伤寒的肥达凝集试验(Widal agglutination test)。
(2)间接凝集在一定条件下,将可溶性抗原(或抗体)吸附在乳胶或红细胞等颗粒性载体表面,再与相应抗体(或抗原)反应出现颗粒凝集的现象。例如用γ-球蛋白包被的乳胶颗粒检测病人血清中的相应抗原。
(3)间接凝集抑制实验将待检测抗原(或抗体)与特异性抗体(或抗原)先行混合并作用一段时间,再加入用目的抗原(或抗体)致敏的载体颗粒,若待测抗原、抗体是对应的,即发生结合,形成抗原抗体复合物,随后加入的相应致敏颗粒不能被凝集,使本应出现的凝集现象被抑制。如诊断早孕时检测人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG),待检标本与抗HCG混合作用,再加入HCG致敏的乳胶颗粒,不出现凝集为阳性,出现凝集块为阴性。间接凝集抑制实验灵敏度一般高与间接凝集实验。

图21-1 各种凝集反应示意图
2.沉淀反应
可溶性抗原(如血清蛋白质、细胞裂解液或组织浸出液等)与相应抗体结合后,在一定条件下出现肉眼可见的沉淀,这类抗原、抗体反应称为沉淀反应(precipitation reaction)。沉淀反应大多以半固体琼脂凝胶为介质进行琼脂扩散,又称免疫扩散。即可溶性抗原与抗体在凝胶中扩散并相遇,在比例合适处形成可见的白色沉淀。当可溶性抗原与抗体在液相中结合形成免疫复合物时,反应液浊度增加,能通过测定反应体系的浊度反映抗原的含量。
(1)单向免疫扩散(single immunodiffusion)在琼脂胶中加入一定量已知抗体,制备成凝胶板,在适当位置打孔后加入待测抗原,抗原溶液从加样孔向四周自由扩散。在抗原与凝胶中抗体比例适合处形成大分子量的免疫复合物,以肉眼可见的沉淀环显示,沉淀环的直径与抗原含量呈正比关系。单向免疫扩散为定量试验,可用于测定血清IgG、IgM、IgA和补体C3等。如图21-2所示。
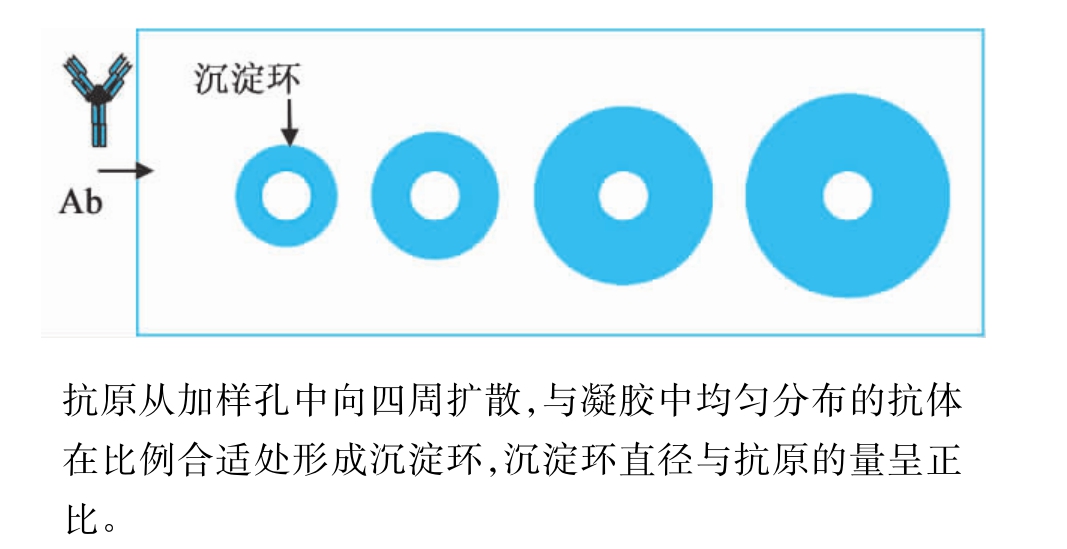
图21-2 单向免疫扩散
(2)双向免疫扩散(double immunodiffusion)将抗原与抗体分别加入琼脂板相对应的小孔中,二者自由向四周扩散,在相遇且比例适当处形成可见的沉淀线。观察沉淀线的位置、数量、形状,可对抗原或抗体进行定性分析,常用于抗原和抗体的纯度鉴定,如图21-3所示。
(3)免疫电泳免疫电泳(immunoelectrophoresis,IEP)是将蛋白电泳与双向免疫扩散相结合的一种免疫化学分析技术。其基本原理是将蛋白质抗原在琼脂糖凝胶上进行电泳,样品中不同的抗原成分因所带电荷、分子量不同,电泳迁移率各异,而被分离成若干区带。停止电泳后,在琼脂糖凝胶上挖一与电泳方向平行的小槽并加入相应抗体。凝胶中分离成区带的各种抗原成分与相应抗体在琼脂中扩散后相遇,在二者比例合适处形成肉眼可见的弧形沉淀线。根据沉淀线的数量、位置和形状,与已知的标准(或正常)抗原形成的沉淀线比较,即可对样品中所含的种类及其性质时行分析、鉴定。免疫电泳可对血清蛋白种类进行分析,观察免疫球蛋白量和质的变化。如图21-4所示。
(4)免疫比浊免疫比浊(immunonephelometry)是将液相内的沉淀试验与现代光学仪器和自动分析技术相结合的一项分析技术。在一定浓度的电解质存在条件下,可溶性抗原与定量抗体特异性结合,形成不溶的免疫复合物,使反应液出现浊度。在一定范围内,免疫浊度与待测抗原含量呈正相关。免疫浊度试验具有简单、快速和自动化等优点,是目前定量测定微量抗原物质并广泛使用的免疫分析技术,已基本取代单向免疫扩散用于测定血清IgG、IgM、IgA和补体C3等物质。
3.补体参与的抗原抗体反应
补体参与的抗原抗体反应包括溶血实验和补体结合实验。红细胞与溶血素在补体存在的情况下,发生溶血反应。当红细胞与溶血素的量一定时,在规定的反应时间内,溶血程度与补体的量及活性正相关,临床以此测定总补体活性。补体结合试验(complement fixation test,CFT)是根据抗原抗体复合物可激活、固定补体的特性,用一定量的补体和致敏红细胞来检查抗原、抗体间有无特异性结合的一类实验。补体结合试验包括检测系统(待检抗原和已知抗体,或待检抗体和已知抗原)、补体、指示系统(绵羊红细胞和溶血素)组成。检测系统发生抗原、抗体反应时,补体被结合,指示系统的绵羊红细胞因补体已被检测系统固定,不发生溶血,为阳性结果。如待检标本中无抗原或抗体存在,检测系统无免疫复合物形成,当加入系统时,绵羊红细胞在溶血素和补体的作用下发生溶血,为阴性结果。

抗原抗体分别从加样孔中向四周扩散,在比例合适处形成沉淀线。A.沉淀线相融,2种抗原相同;B.沉淀线相交,2种抗原完全不相同;C.沉淀线相切,2种抗原部分相同。
图21-3 双向免疫扩散
补体参与的抗原、抗体反应虽有许多优点,但此类反应成分较多、影响因素复杂、操作繁琐,特别是补体活性不稳定,试验重复性差。因此,现已被其他更为简便、敏感的方法所取代。
4.免疫标记技术
免疫标记技术是用荧光素、酶或放射性核素等标记物标记抗体或抗原,进行抗原抗体反应后,通过检测标记物,对抗原或抗体进行定位、定性或定量分析。标记物连接抗体或抗原后,形成标记复合物。标记物偶联抗体或抗原后,不影响抗原或抗体的免疫学活性,也不影响标记物的物理、化学或生物活性。因标记物在微量的情况下即可检测,从而赋予免疫标记技术较高的灵敏度。
(1)荧光免疫技术 荧光免疫(immunofluorescence)是用荧光素作为标记物,标记抗体,再与标本中待检的抗原反应,置荧光显微镜下观察,通过检测特异性荧光,对标本中的抗原作出鉴定和定位。试验中可单独使用一种荧光素,也可同时使用两种荧光素标记的不同抗体,做双色染色,检查不同的抗原。荧光免疫技术既具有高度特异性、敏感性,又能在荧光显微镜下清晰地显示其形态,直观性强。其缺点是荧光容易消退,结果难以永久保存,且非特异荧光的干扰影响结果的判断。

图21-4 免疫电泳
①直接法:用荧光素标记特异性抗体(第一抗体),将特异性荧光抗体直接滴加于待测标本上,荧光素标记抗体与相应抗原反应。此法常用于检测抗原。如图21-5所示。
②间接法:用荧光素标记抗球蛋白(第二抗体),待标本中的抗原与相应抗体(第一抗体)反应后,再用荧光素标记的抗球蛋白(第二抗体)结合第一抗体,通过荧光现象检查抗原或抗体。间接法可用于检测抗原,如病原体的快速检测、细胞表面抗原检测等。同时,此法也可检测抗体,如病原菌抗体、各种自身抗体等。如图21-6所示。
(2)放射免疫技术 放射免疫技术是以放射性核素为示踪物的免疫分析技术。由于此项技术将放射性核素分析的高灵敏度与抗原、抗体反应的高特异性结合在一起,因此常用于定量测定受检样本中的微量物质。常用的标记物为125I。放射免疫技术具有高特异性和灵敏性,但标记物具有放射性,本实验对场所和操作者要求高。放射免疫技术常用于检测微量物质,特别是小分子物质的测定,如胰岛素、生长激素、甲状腺素、孕酮等激素、吗啡、地高辛等药物以及lgE等,在内分泌学、免疫学、药物学、微生物学、生物化学等多个领域得到广泛应用。

图21-5 直接法

图21-6 间接法
(3)酶免疫技术 酶免疫技术(enzyme immunnoassay)是用酶标记抗体或抗原进行的抗原、抗体反应。它将抗原、抗体反应的特异性与酶催化作用的高效性相结合,根据酶作用于底物后的显色反应来判定结果,并且单位时间内酶水解底物显示颜色深浅与抗原或抗体量呈相关性,用酶标测定仪测定光密度(OD)值可以反映抗原或抗体含量。实验方法分酶联免疫吸附试验(enzyme linked im-munosorbent assay,ELISA)和酶免疫组织化学法,前者测定体液中可溶性抗原或抗体,后者测定组织中或细胞表面的抗原。其中酶联免疫吸附试验是酶免疫测定技术中应用最广的技术。
酶联免疫吸附试验是将已知的抗原或抗体吸附在固相载体表面,使抗原、抗体反应在固相表面进行,所形成的免疫复合物被固定于固相载体表面,用洗涤法去除液相中的游离成分(包括过剩的标记抗原或抗体)。免疫复合物的含量通过加底物后的酶促显色反应得以测定。
①夹心法:将已知抗体(抗原)包被于固相材料表面,加入待检标本,标本中若含有相应抗原(抗体)即与固相上的抗体(抗原)结合;去除未结合成分,再加入该抗原(抗体)特异的酶标记抗体(抗原),形成固相抗体-抗原-酶标记抗体复合物(抗原-抗体-酶标记抗原复合物);洗去过剩的酶标记抗体(抗原),加底物后显色可定性或定量检测样品中抗原(抗体)。一般而言,包被抗体和酶标记的抗体是识别同一抗原上的不同抗原表位的两种单克隆抗体。如图21-7所示。

图21-7 双抗体夹心法
②间接法:该方法是测定抗体最常用的方法。将抗原包被于固相载体上,加入待检抗体,样品中待检抗体与抗原结合成固相抗原-抗体复合物;再加酶标第二抗体并与免疫复合物中的第一抗体结合,形成固相酶标记免疫复合物;加底物后显色,通过测定特定波长下的光密度值来计算标本中的抗体含量。图21-8所示。

图21-8 间接法
ABC-ELISA生物素(biotin,B)是一种小分子生长因子,又称维生素H或辅酶R,广泛分布于动、植物体内。亲和素(avidin,A)由4个相同的亚基组成,能结合4个生物素分子。亲和素与生物之间有极强亲和力,且结合具有高度特异性和稳定性。用生物素标记酶蛋白分子并与亲和素结合形成亲和素-生物素化酶复合物(avidin-biotin-complex,ABC)。ABCELISA是生物素-亲和素系统(BAS)与ELISA的组合应用技术。因1个亲和素可结合4个生物素,反应具有放大效应,大大提高了检测的灵敏度,比普通ELISA敏感4~16倍,常用于检测体液中超微量物质(如细胞因子)。以检测IL-4为例,将抗IL-4抗体包被于固相材料表面;加入待检标本,标本中的IL-4与固相上的抗体结合;再加用生物素标记的抗IL-4抗体,形成固相抗体-抗原-生物素标记抗体复合物;再加入亲和素-生物素化酶复合物,ABC中的亲和素与抗原抗体复合物中的生物素结合;最终根据加底物后的显色判定待检IL-4。
(4)酶联免疫斑点试验 酶联免疫斑点试验(enzyme-linked immunospot assay,ELISPOT)主要用于检测单一效应细胞分泌的某类细胞因子。用已知的细胞因子抗体包被细胞培养板;加入待检细胞,培养一段时间后洗去细胞,如待检细胞分泌相应的细胞因子,则与培养板表面的细胞因子抗体结合;再加入酶标记的抗该细胞因子抗体,形成双抗体夹心复合物,最后加底物显色。通常情况下,采用硝酸纤维素膜(NC)作为固相材料,覆盖细胞培养板,测定结束后,在分泌相应细胞因子的细胞所在局部呈现有色斑点。一个斑点表示一个分泌相应细胞因子的细胞,通过计数可推算出分泌某种细胞因子的细胞。
(5)发光免疫技术(luminescence immunoassay,LIA) 是将发光分析和免疫反应相结合而建立的一种新的免疫分析技术,包括发光酶免疫分析、化学发光免疫分析和电化学发光免疫分析。化学发光免疫分析是将发光物质(如丫啶酯、鲁米诺等)作为示踪物质的抗原、抗体反应技术,发光物质在反应剂(如过氧化阴离子)激发下生成激发态中间体,当激发态中间体回到稳定的基态时发射出光子,用自动发光分析仪接收光信号,测定光子的产量,以反映待检样品中抗体或抗原的含量。该法灵敏度高于放射免疫测定法,常用于血清超微量活性物质的测定,如甲状腺素等激素。
(6)免疫印迹技术 免疫印迹(immunoblotting test or Westem blot-ting)又称Western印迹法。它将凝胶电泳与固相免疫标记技术结合。其基本原理是蛋白质样品经SDS-PAGE,其中的抗原按分子量大小不同而被分离,通过转移电泳将凝胶中的抗原原位转印至固相介质(如硝酸纤维素膜)上,并保持生物学活性,然后用酶免疫、放射免疫等技术进行检测。该法能分离分子大小不同的蛋白质并确定其分子量,常用于检测多种病毒的抗体或抗原,例如HIV抗体的检测。实验流程包括:①SDS-PAGE,用十二烷基磺酸钠(SDS)裂解病毒,产生不同分子量的蛋白质抗原。然后经聚丙烯酰胺凝胶电泳(PAGE)将大小不同的蛋白质分开。②蛋白转移,将凝胶中已经分离的蛋白质条带在电场作用下转移至硝酸纤维素(NC)膜上。③免疫学检测。以NC膜上的蛋白区带作为已知的固相抗原,将膜浸入稀释的待测血清标本中,如标本中存在相应抗体,便可与NC膜上的相应抗原结合;加入酶标第二抗体并与特异性待检抗体结合;加入酶反应底物(显色底物或发光底物)即可检测有几种抗体存在。
(7)免疫PCR技术 免疫PCR(immuno-PCR)是将抗原抗体反应的特异性与聚合酶链式反应的敏感性相结合的免疫标记技术。试验原理是用一段已知的DNA分子作为标记物,标记在第一抗体或第二抗体分子上。待检抗原或抗体反应后,加入DNA标记的抗体,充分反应后去除游离的标记抗体;通过PCR反应,扩增免疫复合物中的微量标记物(DNA)。PCR反应产物通过琼脂糖电泳或分子杂交进行检测,根据DNA分子的检测结果确定待检抗原、抗体的存在。
(8)蛋白芯片技术 蛋白芯片技术基于多元分析的理论,是一种抗体微点免疫分析方法。它是在一个固体材料表面,以空间分隔进行众多的免疫分析。在固相基质表面制作抗体微点列阵,每个微点针对一种抗原分析物。反应结束后通过激光扫描共聚焦显微镜进行探测分析,从而可同时检测生物样品中全部蛋白质的含量变化情况。
三、抗原抗体检测的临床应用
检测抗原、抗体的实验很多,主要借助抗原、抗体反应特异性而衍生的技术,如上述凝集反应、沉淀反应、免疫酶技术、免疫荧光和放射免疫技术等。在临床中,要根据对试验特异性、灵敏度的要求及设备条件等选择具体的方法。
1.已知的抗原检测未知的抗体
(1)病原体特异性抗体 经微生物和寄生虫感染后,患者血清中可出现与病原体相应的特异性抗体。用病原体特异性抗原检测患者血清中的相应抗体,可以用于诊断病原体感染,特别是对那些病原学检查还有困难或操作繁琐的病原体,如病毒、立克次体或细菌等。如检测抗HIV抗体、抗支原体抗体(外-斐反应)、抗伤寒杆菌抗体(肥达反应)等。某些情况下,还需要对病原特异性抗体进行定量检测(抗体滴度)或确定免疫球蛋白类别,对明确疾病诊断和提供流行病学资料有很大帮助。例如:正常人因接种疫苗或隐形感染,血清中也存在针对伤寒杆菌的抗体,故需要动态观察抗体滴度变化,若逐渐升高并超过正常水平4倍方可确定诊断;IgM抗体出现在急性期;IgG随后出现,但可持续很长时间。针对乙肝病毒核心抗原的IgG类抗体在血清中持续时间较长,而检出IgM类抗体则提示近期又有乙肝病毒在体内复制。
(2)自身抗体 将患者血清与组织切片反应,借助免疫荧光或免疫组化技术检测患者血清中相应抗体及其滴度。一般情况下,正常人或老年人体内可检出低水平生理性自身抗体,若检出高滴度,且与病情相关的病理性自身抗体(或自身应答性淋巴细胞),有助于自身免疫疾病的诊断。如检测抗核抗体对诊断类风湿性关节炎、检测抗甲状腺抗体对诊断Graves病有很大帮助。
(3)变应原抗体 通过体外或体内试验检测抗变应原抗体(主要为IgE),可用于确定引起变态反应的变应原。体内试验就是皮试试验,皮内注射变应原,观察是否出现皮试阳性反应,确定引起超敏反应的抗原体;体外试验中应用不同变应原与患者血清反应,以检出针对特定变应原的抗体并确定变应原。
(4)细胞毒性抗体 多应用于临床移植器官前组织配型中交叉组织配型,将移植术受者血清与供者淋巴细胞共同作用并加入补体(补体依赖的细胞毒性试验),若死亡细胞超过一定比例,提示患者体内有预存的、针对移植供体细胞的细胞毒抗体。该抗体可以引起器官移植受者发生超急性排斥反应,故受者不宜接受该供者的移植物。
2.已知的抗体检测未知的抗原
(1)检测病原体及其抗原组分 在体外,应用已知抗体可检测病原体抗原及相关抗原,对感染性疾病进行诊断。并且根据检测抗原的不同,可以对微生物进行属、型及血清型的分类。例如借助相应抗体检测乙肝病毒表面抗原和e抗原及痢疾杆菌、脑膜炎双球菌和肺炎球菌的抗原组分等。
(2)红细胞血型抗原 根据红细胞表面抗原的不同,将血型分为不同类型,如ABO和Rh血型分类是根据红细胞表面A、B和O抗原而分型的。应用针对不同红细胞血型及亚类的单克隆抗体,可准确进行血型鉴定,确保临床输血的安全。
(3)肿瘤抗原 肿瘤细胞或组织表达或分泌一些肿瘤特异性抗原或相关抗原,这些抗原只在肿瘤发生时表达或高表达。目前发现的人类肿瘤抗原多为肿瘤相关抗原,也称为肿瘤标志物(tumor marker)。检测这些肿瘤抗原可以为诊断肿瘤性疾病提供帮助,并且对肿瘤抗原进行进一步的检测,如定位、定型和定量检测等,可以为肿瘤分型、疗效判断和预后提供辅助诊断。目前已在临床得到应用的方法包括:检测甲胎蛋白用于原发性肝癌的辅助诊断、疗效和预后判断;借助细胞流式术检测白细胞表面的分化抗原,用于白血病及淋巴瘤的分型和分期;应用放射性核素标记抗体进行体内示踪及肿瘤组织定位等。
(4)药物测定 临床治疗中很多药物,由于副作用较大,使用时极为谨慎,需要及时监测体内药物含量。由于药物的血浓度甚微而且难以找到特殊的化学反应,所以不能用化学分析进行检测,但它们是抗原(或半抗原),可以用对应的抗体来检测。一般是采用灵敏度高的免疫荧光和放射性核素标记技术等。现临床检测抗心律不齐药物,如利多卡因、强心作用的毛地黄、抗痉挛的氨茶碱以及一些抗菌素等,这些药物的测定已成为治疗性药物监控的基础。另外,还用于检测是否服用毒品。
(5)HLA分型 用针对不同型别HLA抗原的抗体进行微量细胞毒试验,对HLA-Ⅰ类分子和HLA-DR、HLA-DR进行分型。
(6)内分泌学的检测各种激素具有免疫原性,能与对应的抗体结合。用标记的免疫学技术可以测定各种类型的激素,例如HCG、LH、FSH、T3、T4和各种甾体激素等。在体液中含量甚微的蛋白质如铁蛋白、载脂蛋白以及各种酶类,特别是同工酶如肌酸肌酶、碱性磷酸酶等,也可以用抗原、抗体反应技术检测。
四、特异性免疫功能检测
特异性免疫应答是免疫系统的重要功能,T、B淋巴细胞介导特异性免疫应答的发生,执行特异性免疫的功能。检测T、B淋巴细胞的数量、功能是观察机体特异性免疫状态的重要手段,对免疫缺陷病、自身免疫性疾病、肿瘤等临床疾病的诊断、疗效的评价有重要的价值。
1.免疫细胞的分离技术
从外周血分离淋巴细胞是对其数量和功能测定的前提。由于检测的目的和方法不同,对细胞数量、活性及纯度的要求不同,选用的细胞分离方法各异。在选择免疫细胞分离方法时,应力求简便、快速及有较高的收获率,并确保后续实验对细胞纯度、数量及细胞活力的要求。
(1)外周血单个核细胞的分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC)指淋巴细胞和单核细胞,它是免疫学实验中最常用的细胞群。同时,分离外周血单个核细胞是进行细胞分离的首要环节。常用的分离方法是密度梯度离心法,此法是根据外周血中各种细胞密度不同而设计的。常用的分离液为聚蔗糖-泛影葡胺(ficll-hypaque)分层液,简称Ficoll分离液。取适量分离液于离心管内,用Hanks缓冲液将肝素抗凝血等倍稀释,再缓慢叠加在分层液上,使两者形成一个清晰的界面。水平离心后,可形成不同层次的区带(图21-9)。红细胞和粒细胞密度大于分层液,沉积于分层液底部;血小板因密度小而悬浮于血浆中;PBMC位于血浆层和分层液的界面之间,呈灰白色。用尖吸管吸出单个核细胞层,用Hanks液洗涤1~2次,取少量计数并用台盼蓝染色检查细胞活力。
(2)淋巴细胞与单核细胞的分离单核细胞具有很强黏附玻璃和塑料的能力,利用这一特性,可以将单核细胞与淋巴细胞分开,从而获得纯淋巴细胞悬液。通常情况下,将分离获得的单核细胞用细胞培养液配制成一定浓度,并将此细胞悬液置入细胞培养瓶或细胞培养皿中,于细胞培养箱培养45~60分钟。取出培养瓶,轻轻晃动,收集悬浮细胞即为淋巴细胞,贴壁细胞为单核细胞。

图21-9 淋巴细胞分离液分离细胞悬液
(3)淋巴细胞及亚群的分离T淋巴细胞和B淋巴细胞的分离可根据它们的生物特性差别,如E花环分离法(T细胞表面CD3分子与绵羊红细胞表面受体结合形成E花环)和尼龙棉吸附分离法(B细胞经过尼龙棉时可以吸附,而T细胞不能吸附)等。T、B淋巴细胞亚群的分离主要根据细胞表面分化不同,根据相应的特异性抗体进行鉴别,然后再采用特定手段获得单一细胞亚群。当然,这些方法同样适用于分离T、B淋巴细胞。这里主要介绍常用的方法。
①免疫磁珠分离法:此法是将特异性抗体交联于磁性颗粒(磁珠)表面,与细胞悬液反应后,磁珠借抗体结合于相应细胞群或亚群表面。再将细胞悬液置磁场中,因磁珠被磁场吸引,而将磁珠结合的细胞与未结合的细胞分开。该方法的优点是可同时进行细胞的阳性分选和阴性分选,收获率高,并且细胞活性高。
②流式细胞仪分离法:流式细胞仪(flowcyto-meter)集光学、流体力学、电子学、计算机技术和免疫学于一体,可对细胞进行多参数测定和综合分析,这些参数包括细胞大小、核型、表面分子的种类等。首先将样本制备成单细胞悬液,经一种或多种荧光标记的特异性抗体染色。细胞悬液经样品孔加入,并在高压鞘液的作用下促使细胞排成单列经喷嘴喷出,形成细胞液。液柱与高速聚焦的激光束相交,相交点称为检测区。经过此区的细胞受激光照射后产生散射光信号和不同的荧光信号,这些信号被相应的检测器接收并转变成电信号。散射光和荧光信号经计算机收集、处理,进而对细胞特征进行统计和分析。不仅如此,具有细胞分选功能的流式细胞仪,可根据细胞检测结果,对瞬间离开喷嘴的细胞液滴充电,使之带有特定电荷。当此液滴通过分选电场时,微液滴出现不同偏转,通过细胞收集器收集特定细胞群或亚群(图21-10)。
流式细胞仪具有高灵敏度、高精密度、多参数分析、高纯度分选细胞和高速度分析等众多优点。FCM的细胞免疫表型分析广泛应用于外周血淋巴细胞亚群分析、白血病细胞免疫表型分析以及各类细胞的膜抗原、黏附分子和受体等的检测。

图21-10 流式细胞仪的组成
2.淋巴细胞数量测定
不同的淋巴细胞表面具有特定的表面标志,借此可以对不同的淋巴细胞及其亚群进行鉴定和计数。随着流式细胞仪的普及,使之成为淋巴细胞分类、计数的常用方法。
(1)T淋巴细胞计数 外周血成熟T细胞表达CD3分子,因此,可通过检测CD3抗原对外周血T淋巴细胞总数进行测定(即用CD3+细胞代表成熟T淋巴细胞)。外周血T淋巴细胞可分为CD4+T细胞和CD8+T细胞,二者通过特异性抗CD4抗体和抗CD8抗体鉴别。荧光免疫技术、酶免疫组化技术和流式细胞术等均可对上述指标进行测定。外周血T细胞及其亚群的平均正常值:CD3+T细胞为54.5%~74.5%,CD4+T细胞为25.5%~51.5%,CD8+T细胞为10.0%~24.4%,CD4+T细胞与CD8+T细胞的比值约为1.8~2.2。
(2)B淋巴细胞计数 ①膜表面免疫球蛋白检测。膜表面免疫球蛋白(mIg)为B细胞所特有,是鉴定B细胞的可靠指标。采用荧光素或酶标记的抗人Ig抗体通过直接荧光免疫法或酶免疫组织化学法检测mIg,正常人外周血中mIg+细胞一般为8%~12%。②CD抗原检测。B细胞表面抗原有CD19、CD20、CD21、CD22和CD29等分化抗原,其中有些是全部B细胞所共有,而有些仅为活化B细胞所特有。据此可用相应的系列单克隆抗体,通过间接荧光免疫法、酶免疫组织化学法和流式细胞术等加以检测。
3.淋巴细胞功能测定
(1)T细胞功能测定 T细胞增殖试验①非特异性增殖试验:T淋巴细胞具有丝裂原受体,在体外受丝裂原(PHA、Con-A)刺激时,细胞被激活并转化为淋巴母细胞。在细胞转换过程中细胞DNA合成增加,细胞形态改变,最终细胞分裂增殖。②特异性增殖试验:已被抗原致敏的T淋巴细胞,在体外受特异性抗原刺激,致敏T淋巴细胞同样表现为增殖反应,从而反映机体对特定抗原的细胞免疫功能。
测定细胞增殖程度主要有两种方法:①3H-TdR掺入法:此法在终止细胞培养前的4~6小时,加入氚标记的胸腺嘧啶核苷(3H-TdR),增殖的细胞需进行DNA合成,3H掺入新增殖的细胞。培养结束后收集细胞,通过检测放射活性(CPM)判断细胞的增殖程度。②MTT比色法:MTT为四甲基偶氮唑盐,为琥珀酸脱氢酶的代谢底物。活细胞含有高活性琥珀酸脱氢酶,MTT被细胞吸收后经此酶代谢形成紫色结晶产物,经二甲基亚砜彻底溶解后在570nm有最高吸收峰。因此,通过测定溶液的OD值,可间接测定细胞增殖程度。
1)Tc细胞介导的细胞毒试验:Tc细胞(CTL)具有细胞毒活性,能特异性杀伤靶细胞(肿瘤细胞、病毒感染的宿主细胞)。检测细胞毒效应常用51Cr释放法。用Na512CrO4标记靶细胞,若待检效应细胞能杀伤靶细胞,则51Cr从靶细胞内释出。以γ计数仪测定释出的51Cr放射活性,靶细胞溶解破坏越多,51Cr释放越多,上清液的放射活性越高。应用公式可计算出待检效应细胞的杀伤活性。细胞毒试验常用于肿瘤免疫、移植排斥反应、病毒感染等方面的研究。
2)皮肤试验:正常机体建立了对某种抗原的细胞免疫后,用相同抗原做皮肤试验时即出现以局部红肿为特征的迟发型超敏反应。细胞免疫正常者出现阳性反应,而细胞免疫功能低下者则呈阴性反应。皮肤试验方法简便,可帮助诊断某些病原微生物感染(结核杆菌、麻风杆菌)、免疫缺陷病等。例如旧结核菌素(old tuberculin,OT)试验,将定量旧结核菌素注射到受试者前臂皮内,24~48小时局部出现红肿硬结,以硬结直径大于0.5cm者为阳性反应。阳性说明细胞免疫功能正常。皮肤试验结果受试者致敏状况的影响。若受试者从未接触过该抗原,则不会出现阳性反应。因此阴性者也不一定表明细胞免疫功能低下。为避免判断错误,往往需用两种以上抗原进行皮试,综合判断结果。
(2)B细胞功能测定
1)血清免疫球蛋白含量测定:免疫球蛋白为B细胞接受抗原刺激后转化为浆细胞分泌的球蛋白,检测血清免疫球蛋白水平可判断B淋巴细胞功能。常用指标有血型抗体、IgG、IgM、IgA等。
2)B细胞增殖试验:同T细胞增殖试验相似,B细胞受丝裂原刺激后,被激活发生分裂、增殖反应,能过检查细胞增殖程度,可反映B淋巴细胞的功能。小鼠B细胞可用细菌脂多糖(LPS)作为刺激物,人则用含SPA的金黄色葡萄球菌菌体及抗IgM抗体作为刺激物。
3)抗体形成细胞测定:常采用溶血空斑试验,即测定对绵羊红细胞(SRBC)产生抗体的B淋巴细胞数目。基本过程是:首先用SRBC免疫小鼠,无菌取脾制备成脾细胞(含致敏B细胞)悬液;将脾细胞悬液与单层贴壁的SRBC混合,如被SRBC致敏的B细胞在体外培养的过程中,合成并分泌溶血素,溶血素则与周围的SRBC结合,在补体参与下,出现溶血反应,形成空斑(图21-11)。每一个空斑中央含一个抗体形成细胞,空斑数目即为抗体形成细胞数。
以T、B淋巴细胞数目和活性检测来评价免疫功能,一般不作为特定疾病的确诊指标,但可用于辅助诊断、病程监测及预后判断。例如,免疫球蛋白水平升高用于多发性骨髓瘤的辅助诊断;CD4+T细胞数目减少用于艾滋病的辅助诊断等。另外,监测机体免疫功能的改变,有助于判断某些疾病的病程变化、疗效和预后,并可能为探索某些疑难病症的机制和制定治疗方案提供依据。

图21-11 溶血空斑实验
五、细胞因子检测
细胞因子(及其受体)水平变化可影响机体免疫功能,细胞因子受体(尤指可溶性细胞因子受体)水平可作为判断某些疾病进程的指标。在临床医学的研究中,当发生某些疾病时,体内细胞因子含量及受体表达可发生异常,这些异常与机体免疫功能异常或发生病理损伤有关。因此,检测患者细胞因子表达水平有助于对临床某些疾病的诊断、治疗和预后的判断。
从检测的水平来说,细胞因子的检测可分为基因水平检测和蛋白水平检测。基因水平检测包括基因DNA的测定和mRNA表达水平的测定。蛋白水平测定可分为生物活性测定和蛋白含量的测定。具体的细胞因子测定法有生物学测定法、免疫学测定法和分子生物学测定法。
1.免疫学测定法
免疫学检测法是建立在抗原、抗体反应基础上的免疫化学分析技术。细胞因子的化学本质是蛋白质或多肽,因此很容易制备相应的细胞因子抗体(多克隆抗体和单克隆抗体),用已知的抗体便可以检测未知的细胞因子(抗原)含量。常见的方法有酶联免疫吸附实验(ELISA)和放射免疫测定(RIA)。免疫学检测法不仅可用于检测体液标本中的细胞因子,也可以检测细胞内的细胞因子。
2.分子生物学检测法
分子生物学检测法是从基因水平上对细胞因子进行测定。一种细胞因子的表达、分泌,主要决定于相应基因的激活和mRNA的表达。当细胞因子的基因因某种原因发生缺失或突变时,可能会导致其表达减少或缺失,进而引起疾病。因此,细胞因子基因水平的测定具有特殊应用价值。细胞因子基因水平测定包括DNA和mRNA测定。前者的检测方法有Southern印迹杂交、原位杂交、PCR和原位PCR。后者检测方法有Northern印迹杂交、原位杂交、RT-PCR等。
3.生物学测定法
细胞因子生物学检测法是根据某些细胞因子特定的生物学功能设计的,因此该方法是测定细胞因子生物活性水平的方法。其原理是应用一定的指示系统(如细胞)与已知活性的细胞因子标准品或未知活性的待测标本相互作用,最终以指示系统的变化(如细胞增殖、死亡或分泌蛋白等)来显示细胞因子的功能,将待检标本与标准品进行比较,最终得知待检标本的细胞因子水平。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














