第十七章 波林、加州理工学院和α-螺旋
我已度假回来了。这是个短暂的假期,为此我只带了六本侦探小说和你写的《化学键》一书。我觉得,在这几本书中,你这本最有味儿。感谢你给了我这样一本重要的著作。我认为,你的见解比我所知道的其他作者的看法更接近于我的观点……
(路易斯致波林的信,1938)
在布拉格父子的指导下,结构X线晶体学在英国比在世界上其他地区更为流行。据劳伦斯爵士的看法,其主要原因之一是他父亲“已发展出测量电离的几种十分精确的方法……正是他制造了著名的X线分光光度计,才对X线衍射作了精确的定量测定”(布拉格,RS)。在伦敦的威廉爵士和曼彻斯特的劳伦斯爵士的领导下,英国科学家们由于有了这种装备在晶体分析方面稳步地向前发展。“我们有很多机敏的小伙子,因此,我们建立了一支世界上力量最强的X线晶体学家组成的研究大军。关于这一点是毋庸置疑的。”(同上)尽管如此,英国这些学派的研究工作,有好几次落后于加利福尼亚的一个名叫莱纳斯·波林的科学家。波林生于波兰,从四岁起到青年时代,一直是在乡下度过的。他的父亲过早地于1910年去世,在此之前一直在康登镇上经营一家药房。为了找到一种职业能赡养其母亲和有机会在化学方面发展自己的爱好,因此,他到俄勒冈州立学院攻读化学工程。靠着帮佣和担任一段时间的教学工作,他支撑住这个家和继续他的学业。到1922年已表明他是大有希望的人才得以继续做研究生的工作;但他的母亲多少感到失望,因为他作为道路检查员表现得极有才能,可以得到月薪为1000美金的永久职业,他的母亲曾为此感到自豪和高兴。幸好波林去了加州理工学院,并在以后的三十年里,建立起一个可与英国的领导地位相抗衡的结构晶体学派。这是一个特殊的学派。我们回顾一下英国学派的情况并看一看这些学派所缺少的东西,我们就能很好地理解为什么波林的学派会取得如此巨大的成功。
我们已知道,在伦敦蓬勃开展了对有机化合物的研究,并从这个研究中心扩展到利兹和剑桥(威廉1908—1915年间曾在利兹,但以后在利兹没有结构晶体学派),主要是研究纤维蛋白,阿斯特伯里虽然没有排除研究球状蛋白质,而贝尔纳的研究重点则是晶体蛋白质和病毒。
在威廉爵士的影响下,阿斯特伯里和贝尔纳从事结构晶体学的研究,而且像威廉一样,他俩也很想把结构晶体学应用在实际工作中。的确,阿斯特伯里处在很大的压力下,他要证明结构晶体学对纺织业有很大的应用价值。另一方面,贝尔纳实际上已被强烈的愿望所驱使,要使科学为整个社会服务。但在这两个人中间,还是贝尔纳更接近于波林研究蛋白质结构的方法。贝尔纳在与福勒研究水的过程中,清楚地认识到氢键的重要性,并知道质子的位置并不是正好位于相邻氧原子的正中。福勒和贝尔纳用量子力学理论来解释他们的结构;但不像波林和哈金斯,他们对水的研究并没有使他们得出结论:就两个相邻的氧原子来说,质子位置必须位于非对称的位置上。也是贝尔纳确定了要解释蛋白质结构,必须先了解氨基酸和肽的晶胞大小和空间基团。尽管如此,这些英国学派看来缺少他们美国同行所具有的一种品质。
人们怀疑,这一品质就是在选择可能的分子结构中,特别是在接受或拒绝来自从X光衍射照片上的键距和键角中,对量子力学可用作检验和指导手段所抱有的信心。这并不是说,英国的物理学家在量子革命中没有起作用,如有这种想法那是荒唐的。也不是说,像贝尔纳那些英国科学家对物理学上的进展一无所知,以及在英国没有主要研究当代物理学问题的X线晶体学家。但是,在英国有许多积极从事蛋白质结晶学研究的学派。这些学派没有受到新兴的物理化学环境的熏陶。贝尔纳相信有直接研究晶体蛋白质的可能性。他主张把一个重原子引入蛋白质分子,或研究脱水作用以解决相位决定问题。他对英国科学普及会的听众们说,“蛋白质结构问题现在是一个明确目标,不是不能达到的……”(贝尔纳,1939a,536)。同贝尔纳相反,波林更多强调的是存在的困难而不是解决问题的可能性。他说:“由于蛋白质极其复杂,因此单凭X射线方法不大可能完全确定蛋白质的结构。”(波林和尼曼,1939,1860)
在美国,情况大不相同。除了拉尔夫·威科夫在三十年代拍过几张蛋白质的X光照片外,再没有别人拍过类似的照片。从二十年代起,记录在案的只有过一次尝试。当迈克尔·海德尔伯格知道在斯克内克塔迪有X光设备时,他带着最好的血红蛋白晶体去了,但“那里的技术还不够格,因此他失望而归了”(黑斯廷斯,1970,94)。在美国,即使是结构晶体学技术也传播得很慢。第一次世界大战期间,在斯克内克塔迪的通用电气公司实验室、麻省理工学院和康奈尔大学是仅有的几个研究中心,但正如前面已指出的,其中只有麻省理工学院的实验室在大学里继续存在下去(威科夫,1962,432)。这只是因为当阿瑟·诺伊斯离开麻省理工学院到帕萨迪纳的思鲁普学院时,带走了伯迪克、詹姆斯·埃利斯和迪金森,并让詹姆斯·埃利斯、罗斯科·迪金森和莱纳斯·波林研究结构晶体学。这样,诺伊斯建立了一个学派,其主题不同于英国学派,因为这个学派是有意识地在更广泛的现代物理化学基础上发展起来的。
思鲁普学院变成加州理工学院
在第十六章,我们看到了所有表面上是民主管理的、实际上却是由一个有势力的小集团操纵的老大学,如何设法规避设立一个新的物化形态学研究所或一个独立的晶体学系。在科学中,起主要作用的是基本粒子物理学、新动物学和新地质学。思鲁普学院同剑桥大学在各个方面都不相同。思鲁普学院的管理中心是五人组成的行政会议:米利肯(主席)、A.A.诺伊斯、黑尔和当地的两位实业家。到三十年代后期,诺伊斯不再是行政会议的成员,但该会议的成员中又增加了T.H.摩尔根、理查德·托尔曼、马克斯·梅森、威廉·芒罗和另一位实业家,这样行政会议就由九人组成。波林认为,“正是这种管理形式为黑尔、诺伊斯和米利肯实施他们的教育思想和研究计划提供了更多的自由”(1965,1)。1920年以后的二十五年中,它使该学院取得了很大的成功。直到1946年才由校长代替了行政会议。加州理工学院成立于1891年,是当地的一所艺术学校,取名为思鲁普工艺学院。1908年,该校理事会的乔奇·埃勒里·黑尔预见到在帕萨迪纳从事工程和科学研究的学院将得到发展,因此到1910年,理事会就把基础部、师范学校和专科学校从学院中分出去,集中力量办好已迁往东南郊新址的理工学院。
该校在1911—1921年间得到发展,1919年,A.A.诺伊斯也被这所学校所吸引,他在1916年已是思鲁普的研究员,他放弃了麻省理工学院的教授职位,担任了加州理工学院专职的化学研究主任。1921年,米利肯也被说服从兼职转成专职。与此同时,学院也改名为加州理工学院。
先把杰出的科学家作为兼职吸引到学校里来,谋取捐款为他建造研究实验室,然后再说服他接受专职的任命,这是极妙的主意。对加州理工学院来说,这种做法看来已取得很好的效果。在思鲁普的日子里,预算总是有赤字,该校财政入不敷出,依靠朋友们对思鲁普赤字基金的捐款才得以解救。1920年初,捐款已达500万美元,而在1920年2月的一个月中,又得到20万美元。帕萨迪纳的盖茨家族在1917年和1927年首先为建造两个化学实验室慷慨解囊,也是帕萨迪纳的克兰林家族在1937年出资建造了第三幢实验室大楼。在这里,我们得感谢这些来到加州的富翁们,他们为本地的这所学院感到自豪,并要在美国西部建立教学和研究基地。
波林已在俄勒冈农学院获得化学工程学位,因为他没有认识到人们可以取得化学学位并由此找到工作。波林认为,他在1922年来到帕萨迪纳是最大的幸运。在他申请去当研究生的学院中有帕萨迪纳的伯克利学院和加州理工学院。“我认为,这里是世界上物理化学研究工作条件最好的地方。在伯克利我也许也能很好工作,所以我不必在帕萨迪纳和伯克利之间作出抉择——哪个学校先接纳我,我就到哪个学校去。”(波林,1965,2)当然,在其他许多大学里也可学习物理化学,其中包括剑桥大学。但是,加州理工学院在物理化学方面有一个特点,即精通量子力学的最新发展,而像R.C.托尔曼那些科学家认为,量子力学可用来解决化学问题。
波林在该校的最初几年里,经历了物理学上一段最令人振奋的时期。原来的量子学说陷入困境,新的量子学说即将破土而出。
两种量子学说
主要同玻尔和萨默菲尔德有关的“旧的”量子学说必须加以“修补”,特别是必须作某些改变,这样,才能用来解释需要作出解释的问题。但是,还有玻尔只能用已抛弃的经典力学的原子模型来解释的“禁滴”(forbidden drops),要用所谓的“半量子数”来解释的非整数作用量子,以及萨默菲尔德只能用同一电子的“内”量子数和“外”量子数来解释的不对称电子轨道。
正是上述一些难题导致了新的量子学说的产生。以1925年布罗格利提出“导频波”概念作为开端,在以后五年时间里形成了杰出的新量子学说。海森伯格用后来公认为矩阵力学的形式发展了这一理论,薛定谔用波函数Ψ介绍了他的论点。波林感受到了这些量子力学最新进展所激起的“振奋之情”。许多费解的难题得到了解决,但一些问题依然存在(波林,1965,9)。早在1925年,波林已知道海森伯格的研究工作,也知道“在帕萨迪纳……原子光谱的精细结构等问题”(波林,1973b)。他参加了R.C.托尔曼组织的在加州理工学院举行的物理化学学术讨论会,他从中学到了现代物理学与化学有关的问题。此外,萨默菲尔德在二十年代初期就在帕萨迪纳讲过课。
1926年,当波林作为一名约翰·西蒙·古根海姆研究员来到欧洲时,他发觉自己正处在量子革命的中心。他参加萨默菲尔德在慕尼黑和德拜在苏黎世举行的精彩的报告会。波林到欧洲的目的是要用最近发现的新量子学说来阐明分子结构和化学键的性质(波林,1970,993)。波林在慕尼黑时,为皇家学会会刊写了一篇论文,在这篇论文的基础上又为美国化学学会写了一篇论文。第二篇论文的开头,他阐明了海森伯格的研究工作,但他的理论很深奥。他写道:“它不能很容易地用于解决相对复杂的结构问题,以及多电子原子和分子性质的问题。”(1927,765)因此,波林发现更令人高兴的是“薛定谔对波动力学的解释提出了一个简单而令人满意的原子模型,这一模型同化学家的原子的关系比同原来的量子学说的关系更密切”(同上)。用这种波动力学处理,人们可以取分子的路易斯电子构型,构成与之相应的分子波函数,计算出分子的某些性质,当然包括其稳定性。这导致在理论和观察之间的一种富有成效的相互作用,分子的量子力学图像发展成半经验形式。
共振学说
海森伯格在1926年论述氦原子时,首次引进了共振概念。一年之后,海特勒和伦敦用量子力学解释水分子中氢氧原子间的共价键。为此,他们把水分子看作是在两种结构之间共振,这样,薛定谔的波函数Ψ代表“两个电子先后围绕两个核作反向旋转”(波林,1970,994)。
过后不久,波林表明碳原子的2S和2P轨道之间有一种相似的共振组合(或杂交),可满意地解释碳四面体中四个共价键的等价性和取向(波林,1928)。
在三十年代,许多研究人员积极从事于制定测量原子间距离的可靠方法。现已清楚,不同化合物中间同一元素的原子间距不是常数。把元素的原子直径简单地累加起来,不能得到这些元素的化合物的相应值。把单键、双键、离子键和共价键看成性质不同的实体,也不再是完全令人满意的了。量子力学为这些键的存在提供了物理学的论据,同时,利用混合波函数为在纯离子键和共价键之间、单键和双键之间存在连续键谱提供了论据。
有机化学过去已提供一些化合物的例子,证明它们的键不可能是很简单的连接。当X射线晶体学表明这些化合物的原子间距介于单键和双键距离之间时,就可用量子力学来说明这一现象。因此,在理论与观察之间出现很有好处的相互作用。如果我们对这些化学键用的是几种可能的分子结构(典型的形式)的波函数的线性组合,那么,就可满意地说明这些键的性质。更重要的是,我们可根据已知的分子间距来预测分子的结构。这种方法的意义还不止于此,依照热力学第二定律,我们可认为分子的稳定构型代表了最小自由能的构型。如果在几种形式之间有共振,后者的自由能一定得大于混合能,两者的差就是共振混合体的稳定能。波林充分利用这一概念作为决定分子结构的标准。他写道:“共振稳定的概念极为重要。这一理论可追溯到海森伯格写的关于氦原子的那篇论文。1928年我写的关于化学键的论文提到了某些共振现象。但大约三年之后,这个问题才搞清楚了。”(波林,1973b)原子间距提供了测定单/双键组成百分比的一种方法,也提示了相当的电子结构。根据已知的键能,可算出这些结构的总能量并同观察到的这种化合物形成的能量进行比较。它们之间的差可“解释为这些电子结构中的分子的共振”(波林和舍曼,1933,606)。这种方法的作用在于能测定共振稳定性。早在三十年代初,它就使波林确信氨键一定在单键和双键形式间共振,然后稳定在同一平面上。
波林认识到原子间距的重要性,因此他对于用X线衍射法测定这些距离的繁琐程序感到很不耐烦。采用这种办法,首先要找出分子在晶胞中的排列,然后求出所需的分子内的距离。有没有更直接的方法呢?1930年他访问了德国,在路德维希港的马克实验室看到了一台电子衍射设备。马克不打算再用这台设备,并因波林将在帕萨迪纳进一步使用这台设备而感到高兴。波林一回来,就要劳伦斯·布罗克韦安装好这台设备。
由于布罗克韦的工作,从1933年起发表了有机化合物的原子间距。1935年,引进了他们的径向分布法,加快了工作进度并有可能研究碳化合物中的局部双键连接。根据最相近的原子数和原子价,可以断言,苯中的碳-碳键应用50%的双键特征,而石墨中则为33%。当用这些物质以及纯单键和纯双键化合物碳-碳间距,对上面所说的单/双键百分比作图得到的一条曲线,在双键成分低于50%时才出现斜率(见图17.1)。因此看来,双键特征所占百分比少,对结构就有很大影响。由于对纯C—C键的值错误地用3.36Å而不是3.33Å,因而这种影响的确被夸大了。但是很明显,纯双键所加的限制大部分也适用于部分双键。因此,共平面排列和约为120°的角度是“杂环和烃环系统共振所需条件”(波林和舍曼,1933,617)。
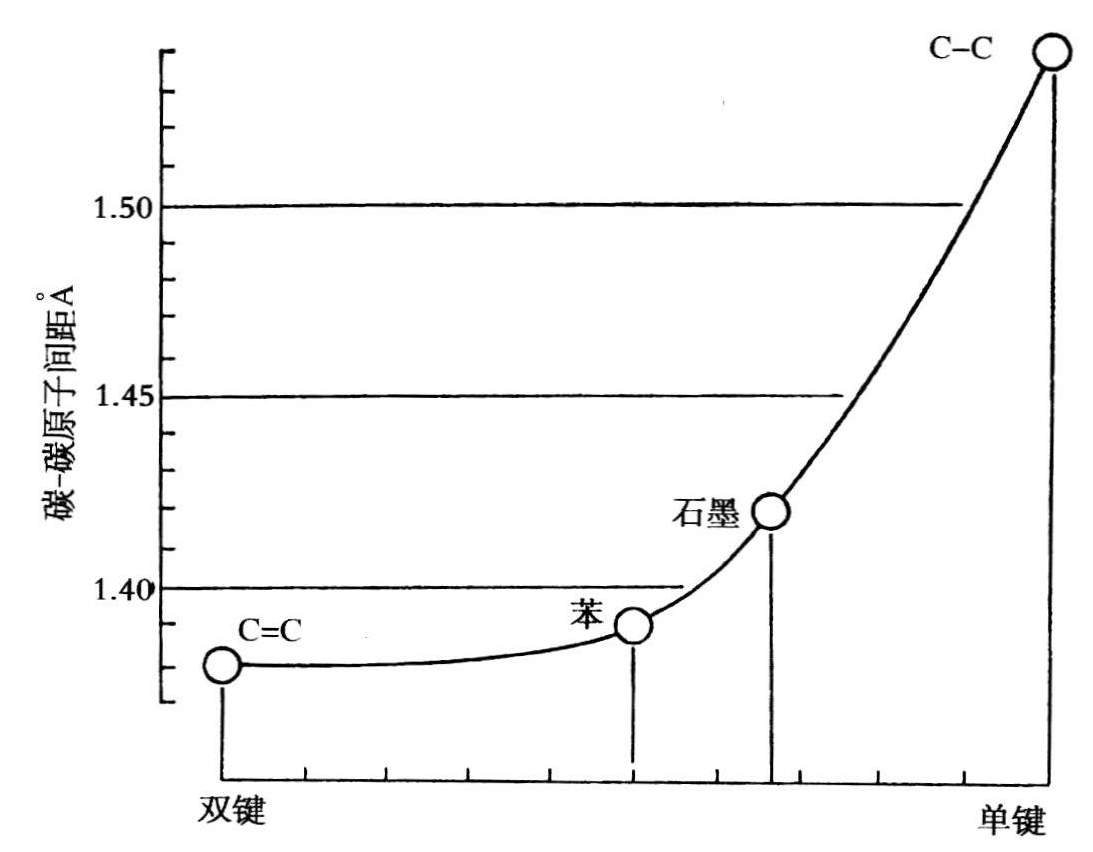
图17.1 表示碳-碳原子间距依赖于单键-双键共振的键特征的经验函数(录自波林、布罗克韦和比奇,1935,2706)。
氨键共振
为了解释有机化合物中各种原子间距,波林在发展共振概念的过程中研究了尿素、草酰胺和草氨酸中的C—N距离及它们的组成能。波林对一些羧酸所作的类似研究,使他得出在羧酸中存在共振的两方面证据:

(波林和舍曼,1933;波林和哈金斯,1934)。
尿素中,C—N距离为1.33Å,共振能量为1.59电子伏特。这些数据用以表明几乎完全的简并,即在下述三种形式中,由于共振作用,两种C—N距离的双键特性都是30%。

在三十年代,像其他许多化学家一样,波林的兴趣被吸引到蛋白质方面。1934年,他开始研究血红蛋白。1937年夏天,他转而研究在α-角蛋白中多肽链是如何折叠的。同阿斯特伯里一样,他使多肽链的折叠保持在同一平面上,因此他无法构成一个令人信服的模型。当他在许多年后回顾这一早期的尝试时,他确信在1937年时他已假设了平面的氨基。“我可肯定,我测得的键长和键角的精度分别为0.02Å和2°,而且,所用的只是平面氨基。但是,我没有想到螺旋的重复,即旋转平移的重复。”(波林,1968)
氢键
众所周知,在1920年拉蒂默和罗德布什引进了在水中一个氢原子被两个氧原子共有的概念,这样在相邻分子之间就形成了一个弱键。一年前,莫里斯·哈金斯在伯克利的一篇未发表的论文中,显然已得出了基本上相同的想法(G.N.路易斯,1923,109)。波林和哈金斯都认识到,在共振结构中,氢键的形成会产生额外的稳定作用。1937年,他俩都构思了相邻链之间有两侧氢键的多肽链。实际上,在波林提出他的模型前,哈金斯已讲了:“我认为,在蛋白质中连接一级链的主要力(不是胱氨酸中的力和类似的交联力)是由于氢键的存在……我坚信NHO桥对连接一级链最为重要。”(哈金斯,1937,550)当然,他提出的五价碳的结构(见图17.2)是独具创见的。

图17.2 (a)β角蛋白的结构;(b)α角蛋白的结构。虚线表示氢键(录自哈金斯,1937,449)。
1936年米尔斯基和波林发表有关蛋白质变性的著名论文时,波林已明显地把氢键看作是蛋白质的一个结构特点了。他们把蛋白质的变性归因于氢键的破坏,使一条正常折叠的多肤链发生断裂。
与科里合作
罗伯特·科里是洛克菲勒研究所的研究员,在拉尔夫·威科夫领导下工作。他们拍摄了豪猪刺和其他纤维蛋白的 X光照片,但在1937年威科夫离开研究所,留下科里独自一个人以及一年的薪金。研究所允许科里带某些设备到他愿意去的地方工作一年,他选择了加州理工学院。
1937年秋,波林遇见了科里。波林当时刚完成了折叠的多肽链模型。当然,他们谈论了蛋白质并决定要研究氨基酸和肽。
波林查阅文献时发现,自从1931年贝尔纳开始研究以来,只发表了两篇论文,而且论文中讲到的结构都是错的。这不足为奇,因为即使是最简单的氨基酸——甘氨酸——的结构,除了氢之外,还有五个原子,因此涉及15个参数。这可不是一件轻而易举的事。当然,由于帕特森分析法已使傅里叶分析法不那么困难重重了。尽管他的学生戴维·哈克提出了帕特森-哈克剖面从而简化了帕特森分析法,但在波林看来,“帕特森分析法在过去和现在都不是很有价值的”(波林,1968)。
贝尔纳研究过的晶体中,有长针形的环状二肽单斜晶体,即二酮哌嗪。由于这些晶体的负双折射性,因此贝尔纳断定它们一定是“由中心对称的、几乎是平的六角形分子构成,并由它们的残余电力连成带状”(1931,369)。科里认为,贝尔纳的这些话是正确的。至于分子的整个结构,没有多大的怀疑余地。同时,由于存在双折射性,因此这些分子一定得与101面平行。由于贝尔纳等人已取得上述研究成果,使科里能标出结构因子并对投影在101面上的晶胞散射能的分布作二维的傅里叶分析。这位先驱者的研究工作所确立的论点中,有键角为120°的分子共平面排列及C—N的距离为1.33Å,这同尿素的共振氨键是一样的。科里还指出,如果这些C—N键真是纯粹的单键,那么就像其他有六原子组成的单键环一样,它们的环也应是折叠的。“因此,观察到的共平面现象为共振提供了有力的证据。”(科里,1938,1603)二酮哌嗪的键距见图17.3所示。图17.4是几种路易斯电子构型(典型形式)。它们之间的共振解释了短的C—N距离。如果我们接受二酮哌嗪相当于一个开链的二肽,这就意味着肽C—N键是在同一平面上。

图17.3 二酮哌嗪分子结构图。原子间距的单位为Å,所有键角都接近120°(引自科里,1948,389)。

图17.4 二酮哌嗪的四种路易斯电子构型。
1939年,阿尔布雷克特和科里发表了甘氨酸的结构,其中有表示共振的一个短氢键。1941年战争中止这项研究时,科里提出了DL-丙氨酸的结构(利维、科里,1941),埃德曼·休斯和沃尔特·穆尔开始研究二肽即甘氨酰羟苯基甘氨酸(休斯、穆尔,1942)。休斯和穆尔作出了帕特森投影,并成功地作出了解释。与此同时,科里给出了完全展开的多肽链的结构图,该链的尺寸和角度是以1939年以前的各种数据为基础凑出来的(科里,1939)。十年之后,发表类似的结构图时(见图17.5),只有一个主要的修改,即把异常的αC—N短键从1.40Å改为1.47Å。两种构型都表明肽C—N键和图17.6中的所有原子都在同一平面上。波林对于这些观察结果同他的估计相当一致,感到非常高兴。

图17.5 多肽链的构型(a录自科里,1948,400;b录自科里、多诺霍,1950,2900)。

同一平面上的多肽链中的键(引自波林、科里和布兰森,1951,206)。
α-螺旋
波林为解决多肽结构的问题,采用了间接的策略。他没有像阿斯特伯里那样去研究丝和角蛋白的伸展链及试图从它们的衍射图中获得多肽链结构,而是从研究氨键着手。从某种意义上来说,这不是故意要这样做——他研究氨化物共振现象在对多肽结构发生兴趣之前。1932年时他指出,氨化物中的共振现象与某种电子构型有关,在这种构型中氮原子没有未共享的电子对。这可说明,氨化物没有显示基本特性的观察结果(波林,1932,296)。接着,他研究了氨基酸和肽。下一阶段的工作是要得出多肽链结构,并应同纤维蛋白质的数据相符合。根据1938年到1950年间加州理工学院发表的论文,可明显地看出,这些研究的长远目标是解决蛋白质结构问题。正是基于这个原因,波林在1937年向洛克菲勒基金会和1946年向国立小儿麻痹症基金会申请研究资金。
随着美国的参战,这项研究计划的期限延长了。当波林作为乔奇·伊斯的访问教授在1948年来到剑桥大学重新研究角蛋白结构时,已是他第一次试图解决这个问题以后的十一年了。他在剑桥讲课的一部分内容是生物学的专一性,其中包括抗体和蛋白质结构,但没有讲到螺旋多肽。不久,他病倒了,病中以看侦探小说消磨时间。后来他决定用纸、铅笔和尺子来设法解决α角蛋白的结构,以调剂生活。他的工作步骤可归纳如下:(1)对称原则要求多肽链在折叠时一定取螺旋构象。(2)肽的所有残基假定都是等同的。(3)肽的C—N键在同一平面上,因此在该键的两端都不可能有旋转。(4)在αC原子处的NαCC两面角形成了旋转。(5)最稳定的、因而也是最可能的构型是沿多肽链残基之间有氢键连接的那种构型。(6)调节螺纹的间距可得到令人满意的氢键连接。
这样做的结果得到了α螺旋和γ螺旋。用这样简单的工具就取得这一成果,这表明了如果接受肽的C—N键在同一平面上,那么可能的构型是很有限的。如果多肽链的N—C一αC部分没有旋转的话,那么可能的构型数就更少了。
波林只是在纸上画了一条多肽链,肽键位于纸平面上,αC原子发生旋转,这样使所有的羰基都在多肽链的同一侧面(见图17.7)。然后,他通过αC原子画两条平行线与该链成任意角度,并沿这两条线把纸折起来通过(109°)两面角。这样就把多肽链折成一条螺旋。接下来的工作就是反复试验找到折叠的取向使羰基和氨基排列成行成为可接受的氢键连接。事实上,在纸平面内改变这种折叠的方向等于改变螺纹间隔。早在1948年,波林就已基本上获得3.7残基螺旋,即现在所说的α螺旋。每个氨基酸的残基都通过氢键同这一或另一方向上的三个氨基酸残基相连接。因为所有的氨基和羰基是相互重叠的,因此所有的氢键连接都同螺旋轴相平行。

图17.7 波林用纸折成的螺旋形多肽链模型(没有按比例绘制)。
大约六个星期后,波林应邀到剑桥大学作几次报告。在剑桥,他同佩鲁茨作了讨论,佩鲁茨给他看了从血红蛋白的帕特森合成得到的轮廓图,离原点10~11Å处有明显的峰。这些峰使波林感到激动,因为这正好符合他的α螺旋的尺寸,但他想到α螺旋不像阿斯特伯里关于α-角蛋白的数据所要求的在5.1Å处重复,而是在5.4Å处重复,此时他的心情又平静下来了。波林回忆了他在剑桥访问阿斯特伯里的情况和看到的那些轮廓图。“我对自己说,这(10~11Å)正是α螺旋的直径,但是我一点也没有向他提及此事,因为5.4Å的间距使我迷惑不解,同时我认为这可能是还有某些我还没搞清的错误。”(波林,1968)
翌年春,吉恩·卡彭特和杰里·多诺霍在旧金山的美国化学学会会议上宣读乙酰甘氨酸结构的优秀论文时,波林回到了帕萨迪纳。他们计算的肽键长1.323Å,偏差不超过0.030Å。这一数值和碳基间距1.243Å,同根据60%是典型的Ⅰ型和40%是Ⅱ型这种假设计算出来的理论值1.33Å和1.25Å是非常接近的。

休斯和穆尔也同时发表了他们研究β-羟苯基甘氨酸的详细情况,但我们应记住,他们的1.29Å的C—N距离在当时被认为是不可靠的。因此,能直接证明肽键的部分双键特性的证据只是二酮哌嗪和乙酰甘氨酸。乙酰甘氨酸也首次提供了可靠的证据,表明早些时候提供的存在异常短的αC—N距离的数据是错误的。该键的长度为1.45Å。
在1949年期间,波林研究小组的信心日益增强。这是有理由的。因为他们应用了所有的强度数据,完成了三维傅里叶分析中最困难的工作,从而精细地确定了帕特森分析提供的苏氨酸和乙酰甘氨酸的原子位置,其可靠程度是前所未有的。多诺霍回去了,并整理了DL-丙氨酸的数据。1949年9月在大西洋城召开了美国化学学会会议,科里和多诺霍就多肽链的大小作了报告(见图17.5b)。波林提出的螺旋同这些尺寸相符,但波林依然保持缄默。因为5.1Å重复一事仍使他迷惑不解。冬天过去了,迎来了1950年,科里和多诺霍在大西洋城发表的讲话发表了。他们恰如其分地提出了谨慎的结论:
虽然蛋白质多肽链的尺寸,可能同这里提供的数字相差无几,但仍须精确测定高度线性的肽晶体的原子位置以获得更直接的证据。
(科里、多诺霍,1950,2900)
科里来到帕萨迪纳和开始研究二酮哌嗪和甘氨酸已有十二年了。波林提出α螺旋的想法也有两年了。然后出现了对镰形细胞贫血症的极妙研究,1949年4月在华盛顿特区和底特律公布于众(波林、伊塔努、辛格和韦尔斯,1949)。这件事使波林对螺旋问题的研究至少停止了几个月。到了冬天,H.R.布兰森和S.韦鲍姆又被要求去研究具有同平面肽键的多肽链的各种可能的螺旋构象。
布兰森没有打算提出一个能给出α-角蛋白5.1Å重复的模型,而只是应用波林于1948年在剑桥时所用的标准及利用精确的造型设备,力求找到与纤维轴平行的所有氢键的取向。尽管研究结果既不是一条完整的螺旋,也不是5.1Å重复的螺旋,然而,在1950年10月,波林和科里在写给美国化学学会的一篇短文中仍报告了他们已找到3.7和5.1残基螺旋。过去那样谨慎为什么现在如此有信心呢?这是因为布兰森和韦鲍姆已系统地研究了同平面的肽螺旋;1949年3月,取得了N-乙酰甘氨酸的数据;在《自然》杂志上发表了一系列论文,论述了E.T.安布罗斯和W.E.汉比在伯克郡梅登黑德的考陶尔德实验室合成的多肽。首先得到的是红外二色性的数据,表明氢键与纤维层状轴相平行以及这些氢键的分子内的性质(安布鲁斯和汉比,1949;班福德、汉比和哈皮,1949a;1949b)。在7月,报道了F.哈皮从X光照片得到的数据。苯丙氨酸和甲基谷氨酯的共多聚体在5.26Å处有一极弧,苯丙氨酸多聚体在5.26Å处有一类似的极弧(班福德、汉比和哈皮,1949a),但没有阿斯特伯里的5.1Å重复的任何迹象!然而,考陶尔德的科学家们没有理睬在5.26Å,5.28Å和5.1Å之间的差别,这种态度使阿斯特伯里大为恼火。他否认这些照片是从像α角蛋白那样的折叠中拍摄的(阿斯特伯里,1949)。哈皮仍热忱地研究这种相似性。当他们成功地实现α-β转化时,用哈皮的话来说,他们被合成多肽的角蛋白模型的正确性所“陶醉”。他们为多聚-γ-苄基-L-谷氨酸盐假设了一条带状链。
班福德、汉比和哈皮想找到接近5.1Å的重复,波林和科里却不想这么做。到1950年7月,哈皮与梅登黑德的研究小组讨论了他最近拍摄的很好的X光照片。其中有一张照片——α形的多聚-γ-苄基-L-谷氨酸盐,十分清晰地表明在5.26Å处所谓的子午线弧,实际上是偏离子午线的双线,而且他们正确地确定重复距离约为5.5Å(见插图13)。哈皮也注意到另一个重要特征——赤道反射可根据螺旋链具有的三重或六重螺旋对称来标定,但他未采纳这一建议。相反,他遵循了在1930—1932年期间从阿斯特伯里那里学来的常规做法,即试图标定该图以便推论出单位晶胞,从而决定链分子的类型。结果是得到了如图17.8所示的双折叠带状链。1950年11月,他向皇家学会作了报告(1951年3月发表)。
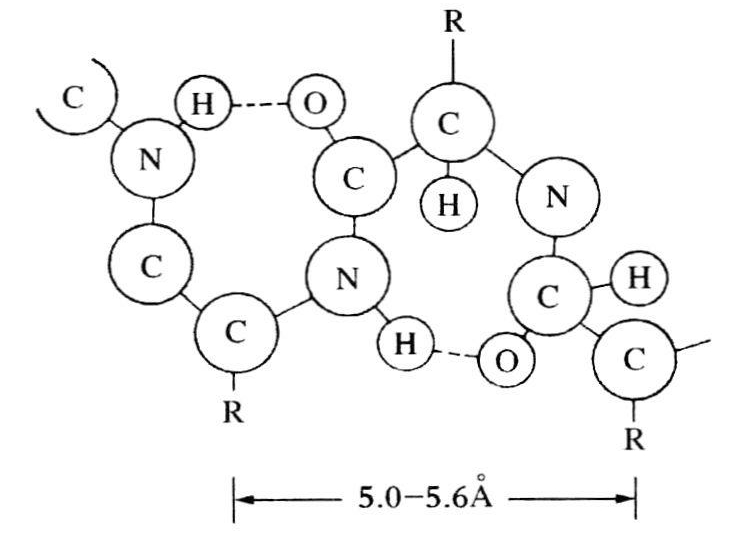
图17.8 多肽链的αⅡ结构(录自班福德、汉比和哈皮,1951,30)。
在这篇给皇家学会的论文的图上有一个令人注目的重要特点——围绕图的中心有六个对称排列的弧(见插图13)。1951年3月,波林看到哈皮的图时立刻看出了这一特点。他正确地称这个特点为“六边形或接近准六边形”(波林和科里,1951b,243)。这是当螺旋棒状体同纤维平行——或像在这种情况与切刀平行时典型的包装形式。佩鲁茨收到这篇关于合成多肽论文的预印本,并在1950年就读过这篇论文。但他认为,哈皮的数据使人迷惑不解。他没有发现假六角形的包装,他没有想到去检查赤道强度。由于没有5.1Å的极弧,因此,佩鲁茨对这些图感到不快。他回想说,他“被盲目相信α-角蛋白5.1Å的照片搞糊涂了”(私人通信)。
α-螺旋和γ-螺旋的发表
1950年波林和科里发表的摘要极其简短,看来并未引起人们注意,但剑桥大学的所有结晶学家都看了,尽管这意味着要到卡文迪什外面的图书馆去。克里克回忆说,这份摘要“写得相当含糊,因此我们认为要等待更详细的论文”。“波林的研究工作”毕竟“不是一贯正确的”(沃森当时看来是这样认为的)。“他常常是正确的,但也常常是错误的。因此,他宣布发现了一种结构并不意味着这就是正确的结构。”(克里克,1968/1972)但是,在1951年4月份那期《美国国家科学院院报》上发表的一篇论文(波林、科里和布兰森,1951)和在5月号上发表的七篇论文(波林和科里,1951a—g)引起了轰动,并在蛋白质结晶学的基地——剑桥大学内引起一阵惊恐。
四月号上的那篇论文宣布了折叠多肽链的立体化学的要求:
氨基酸的残基(不是甘氨酸)没有对称的成分。因此,单链残基转化为等效的另一种残基就是绕着轴线旋转并伴同沿轴线的平移。所以,螺旋构型是符合我们假定的残基等效性的链构型。
(波林、科里和布兰森,1951,206)
由于坚持认为肽键在同一平面上,他们发现了每一残基只有五种旋转角度所构成的模型,能符合立体化学的要求,即160°,120°,108°,97.2°和70.1°,而且只有后两种角度把C—O和NH基团排齐形成与螺旋轴平行的氢键。这些就是3.7残基螺旋(见图17.9)和5.1残基螺旋,即后来所说的α螺旋和γ螺旋,说得更确切些:3.713和5.113。他们认为,可在α-角蛋白、收缩的肌球蛋白和其他纤维蛋白质中发现3.713。我们发现,这种螺旋“在血红蛋白、肌红蛋白和其他球蛋白以及合成多肽中构成一种重要的结构特征”(波林、科里和布兰森,1951,210)。他们指望在超收缩型的角蛋白和肌球蛋白中会发现5.1残基螺旋。
波林过去的学生和合作者杰里·多诺霍后来表明,α螺旋和γ螺旋不是多肽链唯一可能的稳定构型。从理论上来说,2.27,3.010和4.416螺旋确有可能存在,但α-螺旋仍是唯一没有应变的螺旋(多诺霍,1953)。在自然界,从未发现γ-螺旋,合成的多肽中也未产生过,但在1951年,波林完全有理由感到欢欣鼓舞。毫无疑问,卡文迪什的研究小组在工作中出了差错,而且1950年他们那篇有关多肽链构型的论文也是个大杂烩。后来,布拉格把这篇论文描绘成“是同我有关的论文中最糟糕的一篇”(布拉格,1965,6)。令人惊叹的是,波林预测在5.4Å处有一轴向重复,而且考陶尔德实验室的科学家们推论出多聚-γ-苄基-L-谷氨酸盐的晶胞在链方向上长度为5.5Å以及密度符合重复中的3.7残基(班福德、汉比和哈皮,1951,33)。波林的信心和工作热情显得越发精神百倍。这位讲话慢条斯理、带着悦耳的俄勒冈乡下口音的波林知道什么时候要保守秘密,什么时候该宣布这些秘密。他也知道如何来控制科学界的注意力,这样,科学家们就会倾听他要说的话,懂行的人就能理解他的话。

图上只画出骨架原子。双圈表示α碳原子,这些原子都同侧链相连。
图17.9 α螺旋的部分投影(录自克里克,1954,209)。
波林先在加州理工学院、接着在纽约,就α-螺旋和γ-螺旋作了讲演。在纽约的讲演结束时,坐在后排的一位听众问道,3.7残基螺旋是否就是他在1943年所描述的螺旋中的一种。提问的就是在1934年与波林共事过的莫里斯·哈金斯。波林回答说这是不同的。哈金斯推敲了某些细节接着再次问道:“这不是相似的吗?”波林开始时有点躲躲闪闪,但最后还是断言:“在许多重要方面是不同的。”(哈金斯,1969a;哈金斯,1969b)波林的说法是正确的,他的两个模型不同于哈金斯在1943年提出的310螺旋(见图17.10)。在310螺旋中,每个残基由氢键同它左边或右边相隔两个而不是三个的残基相连。它们的拓扑结构(即氢键的连接)完全不同。波林没有作详细说明,这表明他还不能完全肯定哈金斯在1943年描述的像α螺旋的那种螺旋应属于哪一种。他也许信赖布拉格、肯德鲁和佩鲁茨对哈金斯模型所作的描述。这些作者认为哈金斯的模型是完整的。这就可解释波林、科里和布兰森为什么会写:“布拉格及其合作者同哈金斯详细讨论的只是每一圈有整数残基的螺旋结构……”(1951,210)事实上,哈金斯曾就图17.10所示的模型说过:“每一圈螺旋大约有三个残基”,而且,
要指出的是,它并没有谈到这种每一圈螺旋要求正好有三个残基的结构。实际上,从给出的模型来看,似乎每圈的残基数目再少些更能满足键距和键角的要求。
(哈金斯,1943,211)

图17.10 1943年哈金斯描绘的310螺旋(录自哈金斯,1943)。
可惜,上述模型画得好像是一条整数螺旋。这就回到了上面所说的正好有三个残基。而且,哈金斯没有采用在同一平面上的肽链。不用说,他知道氨键共振,因为多年以前他同波林合写的论文已讨论过这个问题(波林和哈金斯,1943,225)。但在1943年,他不能肯定肽链是否有足够的双键特性以防止离开同一平面(哈金斯,1969b)。在他提出的310螺旋中,看来大约有40%不在同一平面上。哈金斯是否真的采用了与波林相同的研究方法和应用了相同的原理呢?仔细检查他的论文就会发现,情况并非如此。在讨论氨键共振能量时,他从不与肽链联系起来,而且他在绘制这种共振结构时(哈金斯,1943,196),他把氢原子画在不同的位置上。但是,共振不涉及原子核的位移,因此他混淆了共振与互变异构现象。
模型制作
尽管哈金斯在1943年写的论文存在上述缺点,但这篇论文对卡文迪什的研究小组仍有很大影响。克里克回忆说,这是一篇有“创见”的论文。因为在制作长链分子模型所依据的立体化学论据之前,这篇论文阐明得最为清楚明了。波林在一篇关于离子晶体的论文中,第一次提出了“节俭法则”(波林,1926,16)。哈金斯以更简洁的语言表达了这种论点。他说:“同种原子在同样环境下结晶,会受到相似的包围。因此,所有类同的原子或离子,在特定的晶体中总是以类似的方式被包围着……”(哈金斯,1931,1270)接着,他提到了密堆积原理。在1943年,他又对这个原理作了进一步的论述:
……对分子聚合体来说,最稳定的排列是组分原子和组分基因聚合在一起,这样,(a)相邻原子或基团之间的距离接近平衡距离;(b)每个原子或基团有尽可能多的近邻;(c)不存在大的空域。换言之,每个结构往往按照它组分原子或组分基团的“大小”,尽可能紧密地“密集堆积”。
(1943,198)
在同一论文中,他强调了在纤维蛋白的模型中需要有一个对称的螺旋轴(沿纤维轴并围绕该轴平移)。
没有螺旋轴的链——例如,阿斯特伯里早期提出的α-角蛋白的结构和他刚提出的胶原蛋白的结构——在该链相对两侧的不平衡的力会在同一方向连续不断弯曲……
一条符合逻辑的、并对大量物质作结构分析后得到充分证实的原理是:相同的原子或原子基团往往以相同的方式受到包围。由于在任何给定的蛋白质中有各种各样的R基团,因此可以预料在相应R基团的周围环境中存在某些差异,但这应是很小的差异。一般来说,在蛋白质的结构图中,除了在R基团之间存在差异外,相同的基团往往以相同的方式受到包围。
(哈金斯,1943,197)
没有人能够说出导致螺旋构象的原理,哈金斯没有解释清楚。也不能说他在1937年和1943年没有强调过氢键的重要性。要是他当初接受了肽C—N键在同一平面上的观点,他无疑能发现这种螺旋结构,因为正如后来布拉格所说的:“在这种条件下,紧接着出现的就是螺旋”,因为对链来说,只有在αC原子处才能转弯(布拉格,1965,6)。
波林的研究方法不同于哈金斯。这不仅是波林对共振学说得出的结论的正确性深信不疑,而且他本人同加州理工学院的氨基酸和肽结构的研究计划直接有关。在加州理工学院,他们应用了严密的研究方法。帕特森分析法仍被正确地用作最能接受的结构的初步指证,然后用精密的设备制作该结构的模型,再用傅里叶综合法计算这种模型的衍射图。接着,把这种理论上的衍射图同实际观察到的进行比较。如有必要再对模型作进一步的修正并重复上述步骤。由于阿斯特伯里从未打算完成这样精确的测定工作,因此他的研究工作大大落后了;哈金斯则由于没有参与这类工作,因此他对研究结果就没有像波林那样有信心。
哈金斯和波林在制作模型时都认识到,螺旋可能是非整数的,但毫无疑问,在结晶学界流行的看法还是老一套的,因此单凭哈金斯的一句话不可能改变他们的传统看法。对许多研究人员来说,这不是在考虑非整数螺旋后摒弃的问题,而是根本不考虑非整数螺旋。在人们想到重复一种图型从而形成对称的链时,显然认为是整数重复。不是只有都呈整数的五种对称形式——1,2,3,4和6次折叠——吗?五十年代初,托尔·诺思求学时,老师就叫他这样思考的(私人通信)当听到波林宣布在晶胞的纤维方向存在3.7和5.1残基时,许多研究人员的惊奇程度从贝尔纳的话中可见一斑。他说,生物分子的研究彻底打破和粉碎了“规范晶体学”。
我们墨守着结晶学法则,角度恒定性等等,对称旋转局限于2-、3-、4-和6次折叠,这样我们可以得到多达230个空间群。布拉格坚信这些法则,但我不能确定佩鲁茨在每个方面都坚信这些法则。要打破这些法则,就需要波林的不寻常的螺旋了。
(贝尔纳,1966,3)
这是贝尔纳的印象。但是,他关于布拉格的说法是不确切的。那么,为什么卡文迪什的研究小组没有发现α-螺旋呢?说来也怪,他们却制作了一个同平面肽链的螺旋模型,即413模型,并在1950年公布了这个模型(见图17.11)。这个模型几乎同波林和科里提出的α-螺旋是一模一样的。但它不是3.7个而是4个残基重复,因此,它具有四折对称。虽然他们几乎已发现了α-螺旋,但继而又抛弃了这个模型,他们的理由是α-角蛋白所要求的重复距离,以及佩鲁茨和肯德鲁分别从帕特森投影图上获得的血红蛋白和肌红蛋白的重复距离都是5.1Å而不是他们这条链的 。从这些投影图上,他们根据晶体密度也推论出多肽棒在重复中有三个而不是四个残基。在无可奈何的情况下,在皇家学会的那篇论文的结论中竟支持了由阿斯特伯里和贝尔在1941年提出的带状二折叠链!
。从这些投影图上,他们根据晶体密度也推论出多肽棒在重复中有三个而不是四个残基。在无可奈何的情况下,在皇家学会的那篇论文的结论中竟支持了由阿斯特伯里和贝尔在1941年提出的带状二折叠链!
剑桥大学内的惊谔
佩鲁茨血红蛋白的帕特森图上表明有折叠构象的平行多肽链时(1949年),劳伦斯爵士感到“极大的兴趣”,并“对折叠的……链的形式作了推测”(布拉格,1965,5)。他赞同哈金斯型的螺旋,“因为,在这种链上每个氨基酸残基都处在同样位置上”(同上)。布拉格及同事们认识到:“这些链也许具有2次、3次、4次或更多次折叠的对称螺旋轴。”(布拉格、肯德鲁和佩鲁茨,1950,330)对称法则可以放宽,但放到多宽?是否包括非整数螺旋?对,只要衍射数据允许,但衍射数据不允许!阿斯特伯里的α-角蛋白照片上5.1Å重复处在一条层线上,他的这幅照片影响了卡文迪什研究小组的工作,因此,他们抛弃了非整数螺旋。另一方面,他们在考虑由同平面和锥形肽C—N键的模型。

图17.11 卡文迪什研究小组在1949年制成的413螺旋模型。请注意在同一平面上的肽键。(a)侧视图;(b)螺旋轴的俯视投影图(录自布拉格、肯德鲁和佩鲁茨,1950,336)。
布拉格回忆了他们如何邀请“化学界的同仁来观看他们认为最有希望的结构,并请他们向我们提供某些标准以便决定哪一种结构更有可能,但我们没有得到任何线索”(布拉格,1965,6)。佩鲁茨证实托德勋爵曾得到邀请,“但我们没有向他询问有关肽键的事,而且他显然也没有注意到,放在他面前的模型中,肽键不在同一平面上。当然,他知道这些肽键必须在同一平面上”(私人通信)。托德勋爵也认为,只要他们问话,他肯定会告诉他们关于肽键的情况。我们怎么来解释上述情况呢?他们是否向托德显示了他们的同平面肽C—N键的413螺旋呢?对此我持怀疑态度。托德是否像佩鲁茨所认为的那样,非常熟悉这些键的同平面性?这也是令人怀疑的。给他看了他们的模型吗?托德说他“从未被邀请”去看这些模型。
克里克亲自参加了肽链同平面性或锥形特征的讨论,并坚信赞同锥形模型的与会者是当时伦敦皇家学院的理论化学教授查尔斯·库尔森。库尔森以氨作为例证,论述了氨的第三个氢原子能转向。当时克里克还不很了解结构化学,因而没有参加这次讨论,剑桥大学的教授、肽键同平面性的物理化学家曼利·普赖斯没有被邀请参加讨论。库恩和埃兹尔在他们的巨著《蛋白质、氨基酸和肽》(1943)一书中给出了同平面构型,但这只是重复了科里根据二酮哌嗪提出的意见,但二酮哌嗪不是肽(库恩和埃兹尔,1943,322)。
佩鲁茨相信,医学研究委员会秘书爱德华·梅兰比爵士当初如果同意资助他出访美国的一些研究中心,情况可能会大不相同。1948年,佩鲁茨书面要求在1949年上半年请假半年,以响应韦弗和波米拉的建议申请洛克菲勒旅行研究经费。他收到如下答复:
我认为本委员会不会同意您用洛克菲勒旅行研究经费前往美国半年的建议。委员会认为,既然已建立了研究机构,作为该机构的主任不但应坚守岗位,而且要有相当的声望以吸引美国人到我们的实验室而不是前往美国去寻求他们的帮助。委员们欢迎在下一阶段,由于高水平的研究得到承认而被邀请到美国去作有名的讲座。
我认为,您应以这两个阶段的工作作为目标,而不要去申请洛克菲勒旅行研究经费。因此,我不打算转交您的申请书……随信退回……
(梅兰比,1948)
因此,直到1950年3月,当佩鲁茨访问宾夕法尼亚州立学院等地时,他才从E.W.休斯那里听说最近在加州理工学院对乙酰甘氨酸所作的研究以及氨基酸的更正确的数据。直到1953年,佩鲁茨才亲自访问了该学院。与此同时,剑桥大学已完成了模型制作。因此,佩鲁茨1949年从美国返回时,他关心的不再是多肽的链折叠问题,而是他在美国期间已听说的镰形细胞贫血症。他立刻动手进行试验,以证明正常血红蛋白晶体与镰形细胞血红蛋白晶体的结晶学差异。在这方面佩鲁茨只取得了部分成功,接着研究了同晶置换。
显然,当时在研究许多问题,而且只是在事后我们才会感到奇怪,那些现在看来如此重要的问题,当时竟未受到重视。当然,布拉格认真研究了肽键问题,而且大约在1947年或1948年,他开始研究二肽;威廉·科克伦的学生H.B.戴尔则研究了半胱氨酰-甘氨酸-钠碘化物。戴尔是享受克罗尔奖学金从南非到剑桥的。劳伦斯爵士对这项工作发生浓厚的兴趣,这可以从他1949年的通信中看出。1949年1月他告诉H.S.利普森,科克伦发表了一个很好的结构。这是与碘化钠结合在一起的甘氨酸和半胱氨酸的二肽结构。正好交上好运,这些碘位于二次折叠轴上,因此沿该轴的帕特森投影立刻显示出分子的整个结构(布拉格,1949a)。1949年2月,布拉格写信给向戴尔的研究工作提供晶体的查理斯·哈林顿爵士:
我们正根据佩鲁茨研究血红蛋白的最新成果深入探讨蛋白质链。如果我们相信他们提供的信息,即最基本的是蛋白质链每隔5Å三个氨基酸重复一次,那么可能的结构将很少,大约只有两三种。制作蛋白质链模型的基本信息是要了解在氮原子周围的三个键是同平面的还是在四面角上相交。我们希望从二肽研究中获得这方面的信息,二肽是目前唯一已作过分析的链。但得到的信息还应在其他化合物上作验证。
(布拉格,1949b)
1949年5月,劳伦斯爵士写信给哈林顿再次索要更多的肽:
戴尔现已完成了半胱氨酰-甘氨酸的分析,正想开拓新的研究领域。我们想研究较简单的肽以便进一步搞清肽链的方向及长度,因为在我们的多肽模型中,必须体现出肽链的方向及其长度。例如,目前还不清楚肽链上氮原子的三个键是相互成120°交角在同一平面上,还是朝向一个四面体的三个角。搞清了几种肽,也许就解决了这个问题。可惜,在极重要的投影图上,半胱氨酰-甘氨酸的碘以一种相当难对付的方式掩蔽了N原子。
(布拉格,1949c)
劳伦斯还告诉海尔布伦,他如何渴望“再得到一些能作快速分析的二肽、三肽、四肽和五肽结晶。我们当然希望在得到长肽链样本时,也许能提供线索以说明在蛋白质中这些链是如何折叠的”(布拉格,1949d)。
戴尔用的是有限形式的三维帕特森综合法而不是完全的三维傅里叶综合法。他证实在他的结构图中,肽的短C—N距离为1.32Å,αCNC角为139°——比加州理工学院研究小组提出的120°增加16%。戴尔写道:“这不能全归因于实验误差。”(1951,46)布拉格、肯德鲁和佩鲁茨提交皇家学会的那篇论文(1950,328)中,提到了这个异常大的αCNC角。他们在这篇论文中假定,在多肽模型中肽的N角为109°28′(四面体)或120°(同平面)。为了证明他们在结论是正确的,他们在脚注中写道:
目前,尚未对α-角蛋白型的蛋白质中任何含氮化合物作过全面的结构分析。因此,我们认为最好把这个问题暂时搁置起来,而去研究这两种构型对每种结构类型的影响。
(布拉格等,1950,329)
1950年2月,肯德鲁在非正式的“哈迪俱乐部”(这是1949年由R.D.凯恩斯、迈克尔·斯旺的J.M.米奇森建立的)发表关于多肽链的谈话时,对他的结论可能未提出异议。听肯德鲁讲话的除了俱乐部的三位组织者外,还有K.贝利、H.巴洛、F.H.C.克里克、A.L.哈奇金、A.F.赫克斯利、P.R.路易斯、M.F.佩鲁茨、L.皮肯、J.W.S.普林格尔、M.G.M.普赖尔、J.R.鲁滨逊和罗思柴尔德勋爵。人们注意到,在场的没有一个是有机化学家或物理化学家,这些生物学家对肯德鲁的结论的确还提不出问题。人们认为克里克和其他在场的晶体学家接受了佩鲁茨的看法(私人通信),即戴尔的数据使人感到加州理工学院研究小组提出的肽键同平面的证据还不足信。其实,克里克看过戴尔的论文,但并未怀疑他的结论(克里克,1968/1972)。
佩鲁茨观察到残基重复
大约在1951年年底,佩鲁茨收到八篇关于α-和γ-螺旋的论文。那天是星期六,在午餐时他读完了这些论文,他认识到如果α螺旋是纤维蛋白和血红蛋白的多肽的结构,那么在子午线上应有广角反射,对应于1.49Å螺旋中相邻氨基酸之间极小的轴距。那天下午,他去实验室找了马毛和猪毛,用直径为三厘米的圆筒形胶片,“而不是通常用的平板”胶片拍摄了它们的振荡照片。他感到高兴的是,当天下午冲印出来的照片上出现预示的反射。那个星期六的劳动是很值得的。下个星期他在伦敦会见了A.埃利奥特,并告诉了他的这个发现。埃利奥特送给他合成多肽的样品,即多聚-γ-苄基-L-谷氨酸盐。佩鲁茨从这份样品中,又发现这种反射现象。由于他的血红蛋白数据的分辨力只有2Å,因而显示不出1.5Å的反射,但沿x轴作进一步研究后,他发现一个隐约可见的突点,“在1.5Å处强度最大”。佩鲁茨断定,虽然这一发现连同波林、科里和布兰森所陈述的其他证据还不能证明这种结构,但“关于他们结构的正确性已没有什么疑问了”。佩鲁茨又说,这个发现表明了:
即使像毛发那种相对来说是无序的物质,也可能含有这种内部极有规律的原子结构。因此,在过去从未想到过的地方也产生了衍射效应。
(佩鲁茨,1951,1054)
这位镇定自若的佩鲁茨不失时机地进行了研究。他没有因在α-螺旋上坐失良机而在周末懊恼不已,而是立刻检验这种结构的预测能力。他验证了血红蛋白中从而也在功能蛋白质中有α-螺旋片段。对多萝西·霍基金来说,这意味着比波林的验证即人们可以制作出螺旋多肽的可能模型的论证更有意义,这种模型是α-螺旋或γ-螺旋,其中之一证明是正确的,另一则是错误的。这种看法反映了她本人早期的认识,即蛋白质中的链的构型一定呈螺旋状。在四十年代,在胰岛素晶体的三角对称的启发下,他们已建成了三重螺旋轴对称的螺旋链模型,他们很快发现哈金斯和H.S.泰勒已在1943年和1941年提出了这种模型。接着,他们根据贝尔纳对胰岛素投影的观察,把这个模型的短长度“置于同三重轴平行的位置上……”(霍奇金和帕克,1968,26)。但是,实验室的一位来访者立刻“把这个模型扼杀在襁褓之中”。最后在1951年,这些蛋白质链的位置和性质看来正在搞清楚。
α-链的冲击
我们已引用了贝尔纳一次演说中的一段话,他非常确切地论述了波林的非整数螺旋对结构晶体学的冲击。从1951年起,结构晶体学家们的思路变得开阔了。
波林虽使螺旋模型成了时髦的东西,但不能说是他首先提出这种模型,他本人确实也不会这样说。对于硒、碲和许多别的有机聚合物,人们早就主张用螺旋模型来解释(见第五章)。波林是在1949年为纤维硫提出螺旋模型,哈金斯则在1943年就提出了纤维蛋白质的螺旋结构,并对剑桥大学的研究小组有很大影响。正如克里克所回忆的,哈金斯提出的螺旋结构,
在提出α-螺旋前曾广泛流传……波林显然也是这样想的,布拉格也相信事物是呈螺旋状的。他们都在制作螺旋模型。因此,回顾过去,我可以这样说,当时你如果认为DNA不是螺旋形,那就是个怪人了。
(克里克,1968/1972)
但是,正是波林和科里的研究工作无疑使螺旋结构成了时髦。螺旋结构不再是化学中许多构象中的一种,而成了生物学上重要分子中最普通的结构。现在这种长链分子构型已被认为是天然纤维和合成纤维的结构,但既然我们在这些纤维中难以取得单晶定向,因此越来越有必要为螺旋衍射发展一种预测理论。结果在1951年底,研究出了螺旋的傅里叶变换。这样,对纤维图的解释进入一个新的水平,也是在这种情况下,才确定了DNA的结构。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















