人基因定位有着重大的生物学意义和医学意义。自从1911年威尔逊(E.B.Wilson)把色盲基因定位于X染色体以来,一直沿用家系分析法来定位基因。到1967年虽已定位了100个基因,但绝大多数是伴性基因,能用家系法定位于常染色体上的基因是屈指可数的。然而,哺乳动物体细胞突变研究和细胞融合技术的发展给基因定位工作带来了革命性的突破。
蓬泰科尔沃在1959年曾设想过用细胞的“无性”融合和分离来进行人基因定位研究。20世纪60年代兴起的体细胞融合技术使蓬泰科尔沃的设想变成了现实,尤其是人-鼠体细胞杂交分析法,已经成为连锁分析的主要材料。
利用人-鼠体细胞杂交做人基因的连锁分析有三个有利条件。
(1)人和鼠的染色体形态各异,易于区分。
(2)种间同类蛋白(如同工酶)的结构歧异是可以在生物化学水平检测分析的,便于用作杂交和分离实验的遗传标记。
(3)杂种子裔细胞优先丢失人源染色体,有可能获得只携有少数几条人源染色体的杂种细胞克隆,甚至有可能获得只携有一条人源染色体的杂种细胞克隆,使基因定位的效率明显提高。
常用的体细胞杂交定位方法有以下几种。
(1)利用人源染色体和标志基因的蛋白产物在杂种细胞中是否同时存在,即是否有平行关系来定位基因。当两种基因产物和同一条染色体有平行关系,这两种基因就有所谓的同线性(synteny),同线性分析是最常用的定位技术。例如,在表6-3中,在杂种细胞株中,异柠檬酸脱氢酶和苹果酸氧化还原酶总是和2号人类染色体平行出现,所以它们之间存在同线性,并可将编码这两种酶的基因定位于2号染色体。同样的,磷酸葡糖变位酶-1、肽酶C和磷酸葡糖酸脱氢酶也存在着同线性,并可同时定位于1号染色体。而核苷磷酸化酶则不在1—5号染色体上。
表6-3利用杂种细胞作同线性定位基因

(2)利用药物抗性或营养缺陷型标志基因,选择性地在杂种细胞株中保留携有相应的野生型标志基因的染色体,达到基因定位的目的。表6-4列举了四个用这种方法定位的人基因。
表6-4 利用药物抗性和营养缺陷型突变定位的基因

注:HPRT,次黄嘌呤鸟嘌呤磷酸核糖转移酶;TK,胸苷激酶;APRT,腺嘌呤核苷酸核糖转移酶;SHM,丝氨酸羟甲基化酶;glyA,甘氨酸缺陷突变型A。
(3)涉及相关染色体的区域定位的多种方法。例如,图6-7所示的方法就是先利用大段易位把G6PD、PGK(磷酸甘油酸激酶)和HPRT三个基因定位于x染色体的长臂,再利用小段易位把这三个基因更精确地定位于范围极窄的区段。又如,利用腺病毒-12能在人的17号染色体上造成断裂的特性,可以获得一系列含有不同缺失段的融合细胞,通过分析基因产物和缺失的染色体片段间的平行关系,即可把基因定位于某一小段。胸苷激酶(TK)基因就是利用这个方法定位于17号染色体长臂2区的。
美国耶鲁大学的拉德尔(F.H.Ruddle)等设计的克隆嵌板(clone panel)是利用细胞融合定位基因的重大技术发明。所谓克隆嵌板就是一组精心选择的杂交细胞克隆,选择的条件是使每一个特定的染色体在这组杂种细胞克隆中具有特定的分布型。例如,假定有一种哺乳动物有8对染色体,利用融合细胞随机丢失染色体的性质,可选择出三个克隆,使8种染色体在这三个克隆中各有特殊的分布型,如:
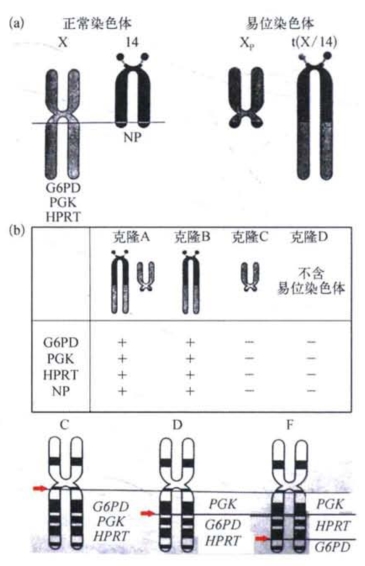
图6-7 利用携带易位染色体的杂种细胞进行基因的区域定位(改自F.H.Ruddle和R.S.Kucherlapati)
红色箭头显示不同细胞系中染色体发生断裂和易位的位点。

有了杂种细胞克隆A、B、C组成的克隆嵌板,只要测出某个基因产物在三个克隆中的分布,马上就能把相应的基因定位于特定的染色体上。例如,某一种酶出现于克隆A和C,而不出现于B,则可编码这个酶的基因定位于3号染色体。又如另一种酶出现于克隆C,而不出现于A和B,则可把编码这个酶的基因定位于7号染色体。
克隆嵌板技术还可以衍生出某一染色体的不同片段亚克隆嵌板技术,即构建一个同一染色体的每一个小片段都有特定分布型的次级嵌板,专门进行该染色体不同区域的基因定位。如,高法恬等用染色体断裂剂处理携有人11号染色体的杂种细胞AL-J 1,分离到了带有11号染色体不同片段杂种细胞克隆,建立了由5个细胞克隆组成的嵌板。从理论上讲,这个亚克隆嵌板可把已定位于11号染色体上的基因精确地定位于32个小区段。
融合细胞基因定位技术大大推动了人基因,特别是常染色体基因的定位研究。到1981年9月,已定位的人常染色体基因有345个,其中通过体细胞杂交定位的是202个,占58%以上。
根据基因编码的蛋白质和染色体或染色体片段之间的平行关系来定位基因是体细胞遗传学的重大发展,特别是染色体分带技术和克隆嵌板技术的联合运用,以及某些免疫标记技术的应用,使基因定位工作更臻完善。但是,技术的改进并没有克服这种方法在理论上的局限性。对于绝大多数在培养细胞中不转录和翻译的基因,是不可能追溯性状和染色体的平行关系的。自从重组DNA探针(probe)引入基因定位工作后,情况才起了根本性的变化。从理论上讲,任何基因和DNA片段都可以组入特定的分子载体,形成基因克隆,甚至特定的DNA片段分子克隆,制备相应的探针。那么配合限制性酶谱分析和DNA分子杂交印迹技术(Southern blot),就都可能定位到特定染色体的特定位置上去。图6-8显示了综合运用DNA探针的分子杂交与杂种细胞组合嵌板技术定位人基因的基本程序。
拉德尔等最先利用人α珠蛋白和β珠蛋白的cDNA探针和克隆嵌板技术,成功地把这两个基因分别定位于16号染色体和11号染色体上,当时DNA分子杂交是在液相中进行的,以后又改为在硝酸纤维滤纸上进行,提高了分子杂交的灵敏度和精确性。到1984年底,就已经用这种方法定位了人的珠蛋白基因2个、免疫球蛋白基因3个、干扰素基因复合体2个、激素基因6个、结构蛋白基因3个、酶基因2个、癌基因10个。其中有些基因已定位于非常狭小的染色体区段,如α珠蛋白基因定位于16pter-p11段,β珠蛋白基因定位于l1p1208-p1205。

图6-8 利用DNA探针与杂种细胞嵌板作分子杂交技术定位人基因示意
此外,利用注入了噬菌体基因组的人基因文库,可以分离出种属特异性的DNA重复序列。这些重复序列可作为标记来定位基因,特别是作为人类群体中DNA结构多态性的检测标记。20世纪80年代起种属特异性DNA重复序列标记已经被广泛用于致病基因的定位和分子诊断的研究。
利用DNA探针做基因定位研究的另一种有希望的途径是分子原位杂交(in situ hybridization)。即利用高放射活性标记的分子探针直接把基因定位于染色体的特定部位。应用分子原位杂交技术已把人的胰岛素基因和β珠蛋白基因分别定位于11号染色体非常接近端粒的11pl5.5和llp15.4区域,把免疫球蛋白基因的恒定区CH段定位于14q32.3。这种方法可以把体细胞遗传学分析和家谱分析结合起来,应用于遗传病的临床研究和流行病学研究,也为基因的进一步精确定位创造了条件。
1981年在挪威奥斯陆召开的第六届人基因定位国际会议上确定已定位和克隆的基因为319个,1983年在美国洛杉矶举行的第七届会议上这个数目为620个,1985年在芬兰赫尔辛基举行的第八届会议上这个数目为831个,1987年在法国巴黎举行的第九届会议上定位和克隆的基因数目已达到1 208个。1989年在美国纽黑文举行的第十届会议和1991年在伦敦举行的第十一届会议不仅通过对囊性纤维症(CF)、神经纤维症(NE1)、马方综合征、家族性结肠息肉等遗传病基因的定位、克隆与突变机制的研究,以及性别决定基因(SRY)的克隆与性别决定机制等一系列最新成就的确认进一步推动了人基因定位工作,还在人体细胞分子遗传学的理论和技术基础上为实施人类基因组计划(Humangenome Project, HGP)创造了充分和必要的前提条件。
在这里我们要专门介绍一下由徐立之领衔的研究小组有关囊性纤维症(cystic fibrosis,CF)基因的定位和克隆工作。这项工作告诉我们,从分离基因到识别它所编码的蛋白质,以及它在细胞中的功能,是一个漫长的探索过程。即使基因产物的结构和功能都搞清楚了,要找到有效的治疗方法也还有很长的路。
囊性纤维症是高加索人群中最常见的常染色体隐性遗传病,大约每2 000个新生儿中有一个患儿,群体中携带致病基因的杂合子频率约为1/25。早在1938年,美国医生D.安德森(D.H.Anderson)就报道了这种疾病。囊性纤维症患者汗液中盐分极高,消化道和呼吸道多积液,后期会出现多器官功能衰竭。最致命的症状是肺部积聚大量黏液,常常因呼吸道感染而死亡。在20世纪40年代患者的平均寿命不到2岁。从临床角度讲,胸腔的机械性拍击有助于黏液排出,呼吸道感染则可用抗生素来预防和控制,现在患者的生命可以维持到30岁左右,但是生活质量不高。然而,取自患者细胞的生化分析并没有查出任何特定的代谢缺陷或酶的缺失,也查不到突变基因的蛋白产物。直到1989年,徐立之和科林斯(F.Collins)等才成功地分离和克隆了CF的致病基因。一系列的研究最终揭示疾病的起因是一种氯离子跨细胞质膜转运调节蛋白的缺陷,导致盐平衡失调而造成肺部积液。这项研究的重要科学意义在于,这是在生物信息学尚未兴起的前基因组时代,针对一个既不知道疾病相关蛋白结构,也没有关于这个蛋白发挥功能的器官或组织的任何线索的条件下,凭借染色体步查(chromosome walking)和染色体跳查(chromosome jumping)等定位克隆(positional cloning)技术成功克隆,进而搞清楚其蛋白产物结构和功能的第一个人类疾病相关基因。

图6-9 CF基因步查和跳查实验示意(引自D.P.Sunstad等)
(a)建立特定限制性内切酶的基因组DNA文库示意;(b)、(c)染色体步查过程示意
所谓定位克隆就是根据基因或DNA片段在基因组图谱中的位置来分离和克隆基因。一般可以用某种内切酶直接处理基因组DNA来制备类似的文库,也可以将来自特定组织或细胞的mRNA通过逆转录获得该组织或细胞的cDNA文库,再经过某一种内切酶处理即可建成由这种内切酶切割片段集合组成的基因组文库,如图6-9a显示的Sal Ⅰ和Eco R Ⅰ基因组DNA文库。染色体步查就是利用分子探针将相互重叠的DNA分子克隆一步一步从染色体的一个位置逐步延伸到更接近目标基因的另一个位置。染色体跳查使用的DNA片段比较大,所以每次延伸的跨度也比染色体步查延伸的范围要长得多(图6-9b、c)。
1982年,徐立之等发现了CF疾病的发生常常与7号染色体上的一个遗传学分子标记之间存在统计学相关。1985年,徐立之等又利用限制性片段长度多态性(RFLP)技术分析了39个CF患者家系,确认7号染色体上一个与对氧磷酶(paraoxonase)基因连锁的DNA多态性片段DOCRI-917与CF突变基因紧密连锁。这个发现将搜寻CF基因的范围缩小到基因组的1%,这是克隆CF基因的第一步(图6-10)。
接着徐立之和柯林斯等利用两个最靠近CF基因的RFLP片段将CF基因锁定在一个500 kb的区间,并以这两个RFLP片段作为基因定位克隆起点,这也是该区段物理学作图的起点。在缩小搜索距离的过程中,他们非常重视遗传学和临床医学提供的学术信息,特别是来自三个方面的重要信息:①人类功能基因的上游往往有一个或多个CpG岛,在CF基因的上游发现了三个连续的CpG岛;②功能重要的基因编码区DNA序列,在生物演化过程相近的物种之间往往是保守的。DNA分子杂交印迹表明,用人类CF基因的外显子序列为探针可以找到小鼠、仓鼠和牛的相应的外显子;③已知CF与患者肺、胰腺和汗腺的异常黏液有关,因此利用从汗腺细胞培养物分离到的mRNA制备的cDNA文库比较适合用来作为以CF基因外显子为探针的染色体步查。这是实验成果的关键一步,因为RNA印迹显示CF基因只在汗腺、肺、胰腺、唾液腺、小肠和生殖腺上皮细胞中表达,如果采用其他组织和器官来源的cDNA文库,就难以鉴定和识别CF基因。蛋白质印迹实验也提示CF基因的蛋白产物只在相应的组织中表达。

图6-10 CF基因的克隆、CFTR蛋白的主要结构域及其跨细胞质膜模型示意
将候选基因确认为疾病相关基因的决定性步骤,是比较分析正常等位基因与来自不同患者家系的突变等位基因。CF的特别之处是70%的患者突变基因含有相同的三核苷酸缺失,即突变型CF基因编码的蛋白产物缺失了第508位的苯丙氨酸,这种缺失突变被命名为ΔF508。CF相关基因跨度长达250 kb,含24个外显子,CF的mRNA长约6 500个核苷酸,编码一个含1 480个氨基酸的蛋白质。蛋白质资料库的查询提示CF基因的蛋白产物与多种离子通道蛋白类似,这些离子通道蛋白在细胞之间形成供离子通过的小孔。CF基因编码的蛋白质也因此被称为囊性纤维跨膜传导调节蛋白(cysticfibrosis transmembrane regulator,CFTR),它在汗腺、呼吸道、胰腺和小肠等器官的细胞之间形成跨膜离子通道,调节细胞内外盐的平衡。CFTR蛋白有两个跨膜结构域(transmembrane domain 1/2,TMD1和TMD2),两个核苷酸结合结构域(nucleotide-binding domain 1/2,NBD 1和NBD2),一个能与腺苷三磷酸(ATP)结合的调节结构域(regulatory domain,R)。虽然确切的调控机制尚不清楚,但实验证据表明,CFTR离子通道是通过一个环磷腺苷依赖的蛋白激酶来活化的。由于CF患者的突变型CFTR的功能丧失,导致相关器官上皮细胞中盐的异常积累,使细胞表面充斥着黏液。
虽然70%的CF患者的突变基因属于ΔF508型,但迄今鉴定确认的CF基因突变已有1 500多种,突变的类型和分布如图6-11。其中比较常见的只有20种,有些突变型非常罕见,甚至只发现过一个病例。
根据患病的严重程度,一般将CF基因突变分为5种类型(图6-12)。Ⅰ型突变因蛋白合成提前终止,导致CFTR蛋白几乎完全没有氯离子通道功能。Ⅱ型突变涉及转录后的加工过程中断,使该蛋白不能到达其发挥功能的细胞表面。Ⅲ型突变会造成CFTR作为氯离子进出细胞的调控功能丧失,虽然CFTR蛋白能到达细胞表面的适当位置,却仍然没有调节功能。Ⅳ型突变的CFTR蛋白虽然能到达适当的细胞表面,但氯离子通过还是会受阻,离子传导功能仍存在缺陷。V型突变会使功能完整的CFTR蛋白合成下降。多数突变基因都能用DNA印迹做出基因诊断(图6-13)。目前的技术和设备已经把进行基因诊断的最早时间大大提前,甚至在体外培养的受精卵植入前的8细胞期即可精确诊断。

图6-11 已发现的1 500多种CFTR基因突变的种类及其在基因内的分布(引自L.C.Tsui等)

图6-12 CFTR基因的突变类型及其代表性突变(引自L.C.Tsui等)

图6-13 利用限制性片段长度多态性诊断遗传病的原理
红色箭头显示核酸内切酶识别和切割位点,紫色星号为突变位点。
这里我们想讲一讲基因诊断相关的伦理问题。譬如有一对年轻夫妇有一个患囊性纤维症的女儿,她必定获得了分别来自双亲的两个突变基因拷贝,所以她的双亲都是携带了一个突变基因的杂合子。如母亲再次怀孕,女孩的父母知道新生儿患同样疾病的概率是25%。保险公司要求对胎儿做基因诊断,诊断结果表明胎儿确实是患囊性纤维症患者。保险公司要求打胎,否则不予保险。因为囊性纤维症患者的治疗费用动辄上百万,而保险公司只想保个低水平。孩子的双亲因此状告保险公司,法院判决保险公司败诉。这里涉及的伦理问题是,保险公司有权中止保险或坚持终止妊娠吗?保险公司有权拒绝对遗传病患者的健康保险吗?孩子的父母又有什么权利?他们有权放弃患儿吗?一旦孩子的父母同意保险公司要求决定放弃患病胎儿,医院有权进行流产手术吗?如果真的这样做,对病孩公平吗?所有这些问题都值得我们好好思考。
自从CF基因成功克隆和CFTR蛋白结构与功能得以阐明以后,人们非常渴望能通过基因治疗来彻底治愈囊性纤维症。1992年,凯勒(B.H.Keller)等成功构建突变型CF的转基因小鼠;同年罗森菲尔德(Mellissa A.Rosenfeld)等将CFTR野生型基因装入腺病毒载体,滴入大鼠呼吸道,1~2星期后即可获得CFTR蛋白的表达;1993年,斯蒂芬(C.H.Stephen)等用脂质体包裹的CFTR基因治疗突变型CF小鼠获得成功。这一系列工作都是遗传病的规范化基因治疗的起点,为CF基因治疗技术路线的形成奠定了基础。最近有报道称,有实验室以插入了野生型CFTR基因的感冒病毒为载体,经鼻腔转染鼻上皮细胞,以期通过鼻上皮细胞表达CF基因的正常蛋白产物来改善CF缺陷细胞的功能。然而,这样的基因治疗一般都没有获得成功。当然它还是为改善患者的肺部症状看到了一线希望。囊性纤维症在学术刊物上正式报道已有60多年,完成疾病相关基因及其蛋白产物的解析也已经有25年了。然而这种危害了那么多患者,并且还在继续危害更多患者的遗传病的防治现状竟然还处在这样令人无奈的状况。有一位长期从事囊性纤维症研究的科学家不无感慨地说:“这种疾病对科学的贡献远远大于科学对这种疾病(防治)的贡献。”
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















