一、血清氯化物测定
氯化物是细胞外液中主要阴离子,测定方法有,汞滴定法、分光光度法、库伦-安培计滴定法和现今使用最广的ISE方法。
1.分光光度法 硫氰酸汞比色法,与样品中氯离子反应生成的橙红色反应生成的化合物(硫氰酸铁,460nm)和高氯酸铁比色法,与样品中氯离子反应生成的红色化合物(氯化高铁,562nm)。比色法的最大缺点是线性范围窄(80~125mmol/L)。
2.库伦-安培计滴定法 测定氯离子的基本原理是,在稳定的电流下,银离子从银电极释放出,与样品中的氯离子结合生成的氯化银沉淀。当反应达到化学计量等当点时,反应液中一旦出现过剩的银离子,立即引发银离子发生系统的关闭。记录器自动记录银离子从发生到停止发生之间所消耗的时间。因为这个时间段的长短与样品中氯离子浓度呈正比,可以计算出氯离子的浓度。令人遗憾的是,这个方法受到其他卤素离子如CN-,SCN-和巯基等的干扰。又因分析前需要稀释样品,本法亦受到电解质排除作用的影响。1996年,美国CAP的质控调查中,发现只有1%的实验室在使用库伦-安培计滴定法。
3.离子选择电极法(ISE) 离子选择电极方法广泛应用于全自动生化分析仪。离子选择电极的敏感元件是典型的银/氯化银或硫化银;临床分析仪中电极膜多为溶剂多聚膜掺合季铵盐阴离子的交换剂(如3-n-辛基丙基氨氯化葵醇)组成的活性材料,制成特殊的PVC管状电极,电极膜的一侧与样品溶液相接触,另一侧与内参比溶液相接触,膜电位直接与样品中氯离子的活度成正比。氯离子选择电极自1985年应用以来,虽然显示出较宽的线性相应范围,但仍受到一些干扰因素的困扰,例如电极膜的不稳定性和电极对其他阴离子选择性方面缺乏批与批之间的一致性等。能产生干扰的阴离子有:其他卤素离子和一些有机阴离子(SCNˉ)。1996年的CAP能力比对实验调查的6017家医院中,47%医院使用间接ISE方法学,而48%医院使用直接ISE方法学。2001年CAP能力比对实验调查中99%医院使用ISE方法。
(一)离子选择电极法
1.原理 氯电极是由电极的基部和头部组成。当溶液中的氯离子与电极头部表面接触时,会产生电动势,与参比电极相连,能测出样品中氯化物的浓度,以“mmol/L”表示。
2.仪器 一般都是由K+,Na+,Cl-三种电极组合的电解质分析仪。
3.试剂 氯测定所需的试剂和定标液是与钾,钠电极应用的缓冲液和校准液组合在一起,不单独配制。
4.操作 操作方法和步骤与用钾,钠电极测定K+,Na+相似。
5.附注
(1)按照仪器说明书进行操作和维护保养。
(2)每批测定都应同时插入质控血清,以保证本批的检验质量。
6.参考值 见硝酸汞滴定法。
7.临床意义 见硝酸汞滴定法。
(二)电量分析法
临床化学常用的氯化物测定仪是一种用电量滴定法测定氯化物的专用仪器,国内已有数家仪器厂生产。此法操作简便,也适合于常规检验用。
1.原理 体液中氯化物的电量滴定法是仪器在恒定的电流和在不断搅拌的条件下,以银丝为阳极,在不断生成的银离子和氯离子结合,生成不溶性的氯化物沉淀。当标本中银离子与氯离子作用完全时,溶液中出现游离的银离子,此时溶液电导明显增加,使仪器的传感装置和计时器立即切断电流并自动记录滴定所需的时间。溶液中氯化物浓度用法拉第常数进行计算(96 487库仑/摩尔氯化物)。库仑与滴定时间和电流的乘积成正比。但在实际应用时不测电流,只需准确测定滴定标本所需的时间与滴定标准液所需时间进行比较,最后用微处理器自动换算成浓度,数字显示测定结果,以“mmol/L”报告。
2.试剂
(1)酸性稀释液:取冰醋酸100ml,浓硝酸6.4ml加于盛有约800ml蒸馏水的1L容量瓶中,用蒸馏水稀释至刻度,此溶液较稳定。
(2)明胶溶液:将明胶6g,水溶性麝香草酚蓝0.1g及麝香草粉0.1g溶解于1 000ml热蒸馏水中,冷却,并分装于试管中,每管约10ml,塞紧并置冰箱保存,明胶溶液在室温中不稳定,室温过夜后即不能使用。
(3)氯化物标准液(100mmol/L)配制方法与上法相同。
3.操作
(1)血清(浆)与脑脊液标本
①与滴定杯内加入去离子水0.1ml,酸性稀释液4ml,明胶溶液4滴,调节仪器使读数为零。
②每天测定前应先用氯化钠标准液校准仪器。校准时,加氯化钠标准液0.1ml,酸性稀释液4ml,明胶液4滴,调节标准读数,使显示值为100mmol/L。
③同法滴定血清标本,0.1ml血清代替标准液,读出测定结果,此为血清氯化物的浓度。
(2)尿液:尿液中氯化物浓度的波动范围比血液大,为使所取的标本量适应仪器的测定范围,需要取不同量的标本进行测定。标本用量不得少于血清的1/3,亦不能超过血清量的1倍,即0.03~0.2ml。尿液测定方法同血清的测定方法。
4.附注
(1)每次滴定后,银电极用蒸馏水冲洗数次后擦干。
(2)本法线性范围可达150mmol/L。
(3)不同厂家仪器的操作方法和维护保养略有差别,请严格按照说明书进行。
5.参考值 见硝酸汞滴定法。
6.临床意义 见硝酸汞滴定法。
(三)硫氰酸汞比色法
1.原理 标本中的氯离子与硫氰酸汞反应,生成极难解离的氯化汞,并释放出相应当量的硫氰酸离子。后者与试剂中铁离子结合生成色泽很深的橙红色硫氰酸铁,吸收峰在460nm,色泽强度与氯化物的含量成正比。
2.试剂
(1)饱和硫氰酸汞溶液:称取硫氰酸汞2.0g,溶于1L蒸馏水中,放室温48h,并经常摇动,取上清液应用。
(2)硝酸汞溶液:称取硝酸汞6.0g,用50ml蒸馏水溶解,加入1ml浓硝酸并稀释至100ml。
(3)显色应用液:称取硝酸铁13g,加水约400ml溶解,再加入1.5ml浓硝酸,500ml饱和硫氰酸汞溶液和5ml硝酸汞溶液,最后用水稀释至100ml,用塑料瓶存放,置室温保存。
(4)氯化物标准液(100mmol/L):配制方法同硝酸汞滴定法。
(5)空白试剂:称取硝酸铁13g,溶于400ml蒸馏水中,加浓硝酸1.5ml,在稀释至1 000ml。
3.操作 取试管4支表明测定管,测定空白管,标准管和试剂空白管。然后按表3-22操作。
表3-22 氯化物比色测定操作步骤

表中各管混匀,置室温10min,分光光度计波长460nm,比色杯光径10mm,以试剂空白管调零,读取各管吸光度。
4.计算

5.附注
(1)本法对氯离子并非绝对特异,其他一些卤族元素如F-,Br-,I-亦能取代硫氰酸离子,与汞离子结合生成卤素汞,同时游离出硫氰酸离子,产生同样的呈色反应。但在正常人血液中,上述元素含量很低,这种干扰可以忽略不计。若接受大量含上述卤素离子的药物治疗时,可使血清中氯测定结果偏高。
(2)本法线性范围较窄(80~125mmol/L)。若标本中氯化物含量125mmol/L或低于80mmol/L时,应将标本用蒸馏稀释水进行1∶1稀释或将标本用量加大0.5倍后再进行检测,其结果乘以稀释倍数或除以标本加大的倍数。
(3)显色应用液的呈色强度与硫氰酸汞和硝酸汞的含量有关。如呈色过强,线性范围在125mmol/L以下,要增加硝酸汞的用量。呈色太弱,要增加硫氰酸汞的用量。因此在测定前要调整好显色应用液的灵敏度,在波长460nm,比色杯光径10mm,标准管吸光度值应在0.4左右为宜。
(4)本法呈色温度应不低于20℃,室温过低。易产生浑浊,影响比色。
(5)本法适用于自动生化分析仪,反应条件易控制,所测结果比较理想。若用手工法测定,每批应采用3点标准(70mmol/L,100mmol/L,120mmol/L),可克服标准曲线不通过零点及不同温度呈色不一致而带来测定结果的误差。
(6)每批标本测定,应同时测定正常和异常值的质控血清,所得值应该在允许误差范围内,否则应寻找误差原因。
6.参考值 见硝酸汞滴定法。
7.临床意义 见硝酸汞滴定法。
(四)硝酸汞滴定法
1.原理 汞滴定法是最早用于生物体液中氯化物测定的一种方法。
氯化汞是可溶性难解离化合物,电离度远远低于指示剂二苯胺脲汞。当用硝酸汞溶液滴定时,汞离子首先与血清(或血浆或脑脊液)样品中的氯离子结合,生成可溶性难解离的氯化汞,此时不与二苯胺脲结合。当滴定到达终点时,过量一滴硝酸汞,即与二苯胺脲络合,生成淡蓝紫色的二苯胺脲汞。根据硝酸汞消耗量,可计算出氯化物浓度。
2.试剂
(1)硝酸汞溶液(2.5mmol/L):称取硝酸汞0.875g溶于1L去离子水(含有浓硝酸3ml)中,此溶液配制后放置2d,经滴定标化后使用。
(2)指示剂:称取二苯胺脲(二苯偶氮碳酰肼或称苯基卡巴腙)0.1g,溶于100ml 95%乙醇中,置棕色瓶内,放冰箱保存,可使用1个月。
(3)氯化物标准液(100mmol/L):将氯化钠(AR)置110~120℃烘箱中干燥4h,取出置干燥器中至恒重,准确称取5.845g,用去离子水溶解后移至1L容量瓶中,并稀释至刻度。
3.操作 在测定管中加入血清(脑脊液或尿液)0.1ml,加去离子水1ml,指示剂2滴,混合,此时溶液为淡红色。用微量滴定管将硝酸汞溶液慢慢地加入,边滴边混匀,直至出现不消退的淡紫色为终点,记录硝酸汞溶液的滴定用量(ml)。在标准管中加入氯化物标准液0.1ml,和测定管同样操作,记录硝酸汞溶液的滴定用量(ml)。
如果标本溶血、黄疸、重度浑浊,用血清直接测定时终点难以判断。可取血清0.2ml于小试管中,加入钨酸蛋白沉淀剂1.8ml,边加边摇,放置数分钟后离心。取血滤液1ml于试管中,加入指示剂2滴如上法一样滴定至出现不消退的淡紫色,记录硝酸汞溶液的滴定用量(ml)。
4.计算
血清(血浆/脑脊液)氯化物浓度(mmol/L)=测定管硝酸汞溶液的滴定用量(ml)/标准管硝酸汞溶液的滴定用量(ml)×100 (式3-26)
5.附注
(1)实验所用器皿必须干净,滴定管固定专用,以保证结果准确一致。
(2)取血后应迅速将血浆或血清分离,以免因血浆中的HCO-与红细胞内氯离子发生转移而使血浆氯化物测定结果偏高。
(3)指示剂的选择:二苯胺脲指示剂有2种,一种为二苯卡巴腙(diphenyl carbazone),化学名称为苯基碳偶氮苯或二苯偶氮碳酰肼,这种指示剂终点明显,稳定。另一种为二苯卡巴肼(diphenyl carbazide),化学名称为二苯基碳酰二肼。这种指示剂终点不太明显,变色迟缓。就灵敏度而言,前者比后者高约3倍,购买时应选择前者。配好的指示剂不太稳定,曝光后更易变质,必须置棕色瓶中,避光保存。
(4)pH对显色的影响:本法确定的样品液应为弱酸性(pH 6.0左右),滴定终点明显。若标本偏碱(如碱性尿),加指示剂后出现红色,应加入数滴0.1mol/L的硝酸,使红色消失,再行滴定,但过酸(pH 4.0以下)时终点也不明显。
(5)每天在滴定标本的同时应与定值质控血清一起运行,便于保证质量。
(6)不去除蛋白标本的滴定结果要比去除蛋白者高1~2mmol/L,这可能是部分汞离子与蛋白质相结合的缘故。
6.参考值
(1)血清(血浆)氯化物为96~108mmol/L。
(2)脑脊液氯化物120~132mmol/L。
(3)尿液氯化物为170~250mmol/L。
7.临床意义
(1)血清(浆)氯化物增高:临床上高氯血症常见于高钠血症、失水大于失盐、氯化物相对浓度增高,高氯血症代谢酸中毒,过量注射生理盐水等。
(2)血清(浆)氯化物减低:临床上低氯血症较为多见。常见原因有氯化钠的异常丢失或摄入减少。如严重呕吐、腹泻,胃液、胰液或胆汁大量丢失,长期限制氯化钠的摄入,艾迪生病,抗利尿素分泌增多的稀释性低钠低氯血症。
(3)脑脊液低氯血症:正常CSF中氯离子比血清中高,其机制与Donnan平衡有关,以维持CSF和血浆渗透压平衡。各种细菌性脑膜炎,尤其以结核性脑膜炎患者CSF中氯离子含量降低,常低于106 mmol/L。脑脊液为细胞外液中的一部分,低钠血症均伴有脑脊液低氯症。重症结核性脑膜炎时,氯化物含量显著降低;化脓性脑膜炎时偶见减少;普通型脊髓灰质炎与病毒性脑炎时基本正常。重型中枢神经系统感染时,抗利尿素增多,因水潴留而发生稀释性低钠、低氯血症,脑脊液氯化物相应减低。
二、乳酸的测定
血液乳酸测定有化学氧化法、酶催化法、电化学法和酶电极感应器法。化学氧化方法使用高锰酸盐或二氧化锰将乳酸氧化成乙醛和CO2或CO,然后分别测定乙醛和CO2或CO的生成量,计算乳酸的含量。酶催化法使用乳酸脱氢酶催化乳酸氧化,生成丙酮酸和NADH,然后用分光光度法或荧光光度法测定NADH的生成量,计算乳酸的含量。电化学法的原理,是在乳酸脱氢酶的催化下铁氰基团[Fe(CN)3-6]氧化乳酸,同时本身还原成亚铁氰基团[Fe(CN)4-6]。反应过程中所生成的亚铁氰基团,在铂电极(参比电极为银/氯化银)表面被氧化,所产生的电流与亚铁氰基团生成量呈正比,可计算乳酸浓度。酶电极感应器法的原理,是在乳酸氧化酶催化下氧化乳酸,生成丙酮酸和过氧化氢;过氧化氢在铂电极表面发生氧化还原反应,释放出电子,产生电流,用安培计测定过氧化氢生成量,计算乳酸浓度。
(一)血浆乳酸测定
1.原理 在NAD存在下乳酸脱氢酶催化乳酸氧化成丙酮酸,同时生成NADH。
![]()
在pH 9.8时,平衡偏向乳酸氧化成丙酮酸。加入肼或氨基脲与丙酮酸生成复合物,使丙酮酸不断地从反应体系中移出,进一步促进反应向右移动,从而驱动反应的完成。分光光度计波长340nm监测吸光度的升高速率,计算乳酸含量。
2.试剂
(1)Tris-EDTA-肼缓冲液(浓度分别为499mmol/L,11.9mmol/L和226mmol/L)溶解Tris 60.5g和EDTA·2Na 4g于约800ml蒸馏水中加水合肼11ml,用盐酸或氢氧化钠溶液调节pH至9.8,再用蒸馏水稀释至1L,放冰箱波保存,可稳定6个月。
(2)NAD溶液:预先称取数份β-NAD(sigma#7004,MW 663.4)66.3g置于干试管中紧塞,放冰格中保存,至少稳定1个月。临用前,取出1管加入蒸馏水3ml溶解NAD。
(3)乳酸脱氢酶溶液:纯化的兔肌LDH硫酸铵悬液(BM 127230),比活性约550U/mg。
(4)底物应用液:取Tris-EDTA-肼缓冲液27ml,NAD溶液3ml,乳酸脱氢酶溶液40μl。混匀。置4℃可稳定24h。
(5)20mmol/L乳酸标准液:称取192mg L(+)-乳酸锂标准品溶于蒸馏水中。置于4℃可稳定6个月。
(6)乳酸标准应用液(2mol/L和5mmol/L):20mmol/L乳酸标准液用蒸馏水分别稀释成2mmol/L和5mmol/L乳酸标准应用液。置4℃保存可稳定2个月。
3.操作 取15mm×100mm试管3支,分别编号为“测定管”“标准管”及“空白管”、然后,按表3-23进行操作。
表3-23 酶法血浆乳酸测定操作步骤

表中各管立即混匀后,置37℃水浴准确保温5min,各管立即加入0.1mmol/L盐酸3ml终止反应。分光光度计波长340nm,比色杯光径1.0cm,用蒸馏水调零,读取测定管,对照管,标准管和空白管的吸光度。
4.计算
![]()
5.参考值 安静状态下健康成年人空腹静脉血,乳酸浓度一般低于2mmol/L(0.6~2.2mmol/L)。动脉血中乳酸水平为静脉血中乳酸水平的1/2~2/3。餐后乳酸水平比基础空腹值高20%~50%。新生儿毛细血管血中的乳酸水平比成年人的水平约高50%。CSF乳酸水平与血液乳酸水平无关。0-16岁儿童的脑脊液乳酸水平为1.1~2.8mmol/L。健康成年人24h尿液乳酸排出量为5.5~22mmol/d。
6.附注
(1)本法操作表中的试剂及其加量适用于自动分析仪操作。各实验可根据自动分析仪的型号设定参数。分别监测测定管个标准管的吸光度升高速率,计算乳酸的浓度。
![]()
(2)有条件的实验室,可用荧光光度法监测NADH,测定灵敏度更高。
(3)也可用氯化硝基四氮唑蓝(NBT)呈色法测定NADH的生成量。在酚嗪二甲酯硫酸盐(PMS)的存在下,使NADH的氢传递给NBT,还原生成紫红色的NAD+(吸收峰在530nm),可进行比色法测定。
(4)在本法的反应过程中,样品中乳酸的含量与反应过程中NADH的生成量呈等摩尔关系。因此,可根据NADH的摩尔吸光度(ε=6220)来直接计算乳酸的浓度。但是,仪器必须校准,反应条件必须标准化,必须与标准管法进行比对实验,证明结果准确。
(5)抗凝剂用肝素-氟化钠(1mg肝素,6mg氟化钠可抗凝5ml血液)较好。抗凝血标本置冰浴中送检,应尽快分离出血浆,放水室中待测。草酸钾对LDH有一定抑制作用。
7.临床意义 见全血乳酸测定。
(二)全血乳酸测定
1.原理 在NAD+存在下,LDH催化乳酸,氧化成丙酮酸。加入硫酸肼捕获产物丙酮酸,并促进反应完成。反应完成后生成的NADH与乳酸为等摩尔关系,在波长340nm下测定NADH的生成量,计算乳酸的含量。
2.试剂
(1)50g/L偏磷酸(MPA):称取5.0g MPA,溶于蒸馏水中,并稀释到100ml,新鲜配制。
(2)30g/L偏磷酸:称取3.0g MPA,溶于蒸馏水中,并稀释到100ml,新鲜配制。
(3)Tris-硫酸肼缓冲液,pH 9.6(Tris 79mmol/L;硫酸肼400mmol/L):取1mol/L氢氧化钠350ml,加入Tris 4.79g,硫酸肼26g,EDTA·2Na 0.93g,以1mol/L氢氧化钠调制pH 9.6,用蒸馏水稀释到500ml,4℃保存可稳定8d。
(4)27mmol/L NDA+溶液:根据需要量称取NDA+溶于蒸馏水中,4℃可稳定48h。
(5)LDH溶液:市售LDH原液,用生理盐水稀释成1 500U/ml(如用sigmaⅢ型LDH,该制品从牛心提制,每毫升含10mg蛋白,每毫克蛋白具有LDH活性400~600U,用盐水稀释成3g/ml蛋白即可)。
(6)1mmol/L乳酸标准液(9.08mg/dl):精确称取L-乳酸锂9.6mg(或DL-乳酸锂19.2mg),以少量蒸馏水溶解,加入25μl浓硫酸,用蒸馏水稀释到100ml,4℃保存可长期稳定。
3.样本采集与处理 下列措施可防止标本及时采取后血液乳酸及丙酮酸发生变化。
(1)应在空腹及休息状态下抽血。抽血时不用止血带,不可用力握拳。如非用止血带不可,应在穿刺后除去止血带至少等待2min后再抽血。最好用肝素化的注射器抽血,抽取后立即注入预先称量的含有蛋白沉淀剂(预冷至4℃)的试管中。如用血浆测定,每毫升血用10mg氟化钠及2mg草酸钾抗凝,立即冷却标本,并在15min内离心。
(2)抽血前试管编号,称重(wm)后,放入冰浴中,每份标本最好做双管分析。抽血后,立即注入上述试管中,每管2ml。颠倒混合3次,不可产生气泡,待试管温度与室温平衡后,再称重(wb)。静置至少15min后,离心沉淀(每分钟4000转,15min)。上清液必须澄清。计算稀释因素D。
![]()
4.操作 按表3-24进行。
表3-24 乳酸测定操作步骤
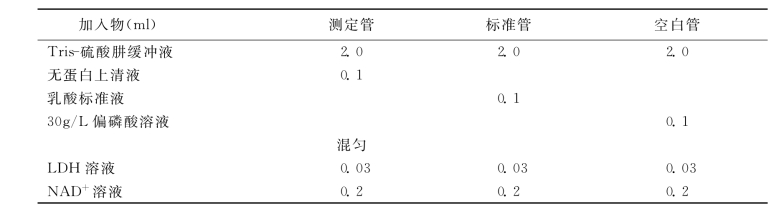
混匀,置室温15min后,用分光光度计波长340nm,比色杯光径1.0cm,以空白调零,读取各管吸光度。
5.计算

式中,2.33为反应液的总体积(ml);6.22为DADH的毫摩尔吸光度;0.1为上清液体积(ml)。
6.参考值 全血乳酸0.5~1.7mmol/L(5~15mg/dl)。血浆中乳酸含量约比全血中的含量高7%。脑脊液乳酸含量与全血接近,但中枢神经系统疾病时可独立改变。24h尿液排出乳酸量为5.5~22mmol。
7.附注
(1)偏磷酸一般是有偏磷酸(HPO3)及偏磷酸钠(NaPO3)组成的易变混合物,偏磷酸在水溶液中形成各种多聚体(HPO3)x。氢离子催化此多聚体,水化成正磷酸(HPO3+H2O→ H3PO4)。正磷酸不沉淀蛋白质,偏磷酸溶液沉淀蛋白质的能力在4℃时仅能维持大约1周。
(2)本法线性范围达5.6mmol/L(50mg/dl)。
(3)本法不用过氯酸作蛋白沉淀剂。过氯酸不能沉淀黏蛋白,干扰丙酮酸的酶法测定(若需用同一滤液作丙酮酸测定),使LDH的酶促反应变慢。
(4)一般乳酸锂未标明“L-”或“DL-”均为DL-型,L-型乳酸锂价格昂贵。
8.临床意义 组织严重缺氧时可导致三羧酸循环中丙酮酸需氧氧化的障碍,丙酮酸还原成乳酸的酵解作用增强,血中乳酸与丙酮酸比值增高及乳酸增加,甚至高达25mmol/L。这种极值的出现标志着细胞氧化过程的恶化,并与显著的呼吸增强,虚弱,疲劳,恍惚及最后昏迷相联系。即使酸中毒及低氧血症已得到处理,此种高乳酸血症常为不可逆的,见于休克的不可逆期,无酮中毒的糖尿病昏迷和各种疾病的终末期。
在休克,心功能失代偿,血液病和肺功能不全时,常见的低氧血症同时有高乳酸血症,在低氧血症原发条件处理后常是可逆的。在肝脏灌流量降低的病例,肝脏对乳酸的清除率显著降低,亦会出现乳酸酸中毒。
血液丙酮酸测定主要用于维生素B1缺乏症的诊断。维生素B1的焦磷酸酯是丙酮酸在细胞内进一步氧化分解为乙酰辅酶A时的脱羧辅酶。维生素B1缺乏时,体内丙酮酸的氧化发生障碍,使丙酮酸的含量增加。
病毒性脑膜炎CSF中LA含量无变化,而结核性脑膜炎和化脓性脑膜炎CSF中LA含量升高,一般高于0.3g/L,且结核性脑膜炎CSF中LA含量经有效化疗1个月之后方才降至正常,而化脓性脑膜炎CSF只需1周有效治疗后即可正常。肺结核伴肺坏损所致机体严重缺氧时,可致血中LA含量升高。
三、荧光素钠实验
荧光素钠实验(fluorescein sodium test,FST)是由日本学者藤井、板田最早提出用于诊断结核性脑膜炎的一种生化实验。
1.原理 CSF流出的主要通道是脉络丛上皮细胞的间隙,正常情况下该通道存在一定负电荷,在pH下降的环境中能抑制带负电荷的物质通过,而促进带正电荷的物质通过,荧光素钠带正电荷。当患者患结核性脑膜炎时,由于MTB代谢,CSF中pH下降,当注射一定荧光素钠后,CSF荧光素钠含量升高,即FST阳性。
2.试剂
(1)10%荧光素钠注射液。
(2)标准管的配制:用10%荧光素钠分别稀释成2×10-7、3×10-7、5×10-7、6×10-7、1× 10-6和3×10-6不同浓度的荧光素钠,各取2ml于试管中,用蜡封固后,避光保存。
3.方法 按0.3ml/kg计算荧光素钠的用量,深部肌内注射10%荧光素钠液,2h后常规腰穿取CSF 2ml,置于标准管相同的试管中,在日光或紫外光下,以黑色为背景目测与标准管相比,亦可用分光光度计比色。
4.结果判断 FST≥6×10-7为阳性,FST 3~6×10-7为可疑,FST<3×10-7为阴性。
5.参考值 FST为阴性。
6.临床意义 结核性脑膜炎和新型隐球菌性脑膜炎患者FST为阳性,其他类型脑膜炎患者FST为阴性。结核性脑膜炎和新型隐球菌性脑膜炎患者FST为阳性,其他类型脑膜炎患者FST为阴性。
四、总唾液酸测定
总唾液酸(total sialic acid,TSA)又称涎酸,是神经氨酸的N乙酰或乙醇酰衍生物。人体内TSA仅是乙酰神经氨酸,它是细胞膜糖蛋白和糖脂的重要成分,位于膜糖蛋白的侧链末端,参与细胞表面的多种生理功能。
TSA测定方法较多,其中以Aminoff介绍的硫代巴比妥法应用最为普遍,以海军医学研究所的试剂盒最为简便、实用。该试剂盒内含N-乙酰神经氨酸标准液1瓶(1m=50μg)、TSP测定试剂1瓶(500ml)。
1.原理 用过碘酸将唾液酸氧化成甲酰丙酮酸,甲酰丙酮酸与硫代巴比妥酸反应生成粉红色产物,红色产物最大吸收549nm,其吸光度与样品中总唾液酸浓度成正比。
2.方法 按表3-25操作。
表3-25 总唾液酸测定
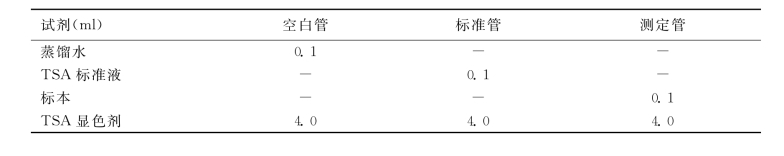
置沸水中煮沸15min,冷水冷却后以每分钟2 000转离心5min,空白管调零后,取上清液570nm比色测其A值。
3.计算
4.参考值 血清TSA<0.599g/L。
5.临床意义
(1)结核病患者中痰菌阳性血清TSA含量30%~40%的升高,随有效抗结核治疗而下降;约90%的肺癌患者血清TSA含量升高,随病情进展而持续升高;结核球患者血清TSA含量不升高。因此,检测血清TSA含量,可用于结核与肺癌的鉴别诊断。
(2)结核性胸(腹)膜炎患者胸腔积液(或腹水)和血清TSA含量均升高,其胸腔积液(或腹水)TSA/血清TSA之比≥0.5;而肿瘤合并胸腔积液(或腹水)者血清中TSA升高,但升高幅度大于结核性胸(膜)膜炎,其胸腔积液(或腹水)TSA与血清TSA之比<0.5。
(3)漏出液TSA含量均小于0.3g/L
五、色氨酸实验
1.原理 色氨酸(tryptophan,Try)经酸与甲醛作用之后,与亚硝酸钠产生紫色反应。结核性脑膜炎患者硝酸作用,引起类似Try一样的紫红色反应。
2.试剂
(1)浓盐酸。
(2)2%甲醛。
(3)0.6g/L亚硝酸钠溶液须新鲜配制,仅能保存1周。
3.方法
(1)取CSF 1.0ml于试管中,加浓盐酸5.0ml,2%甲醛1滴,混匀后放置5min。
(2)沿管壁徐徐加入0.6g/L亚硝酸钠溶液3ml,静置3min使其分层后,观察结果。
4.结果判断 两液交界处显紫色环者为阳性,两液交界处显棕色或黄色为阴性。
5.临床意义 如果CSF外观无色透明,而该试验阳性,多为结核性脑膜炎所致。结核性脑膜炎其阳性率较高,经链霉素治疗后阳性率下降。乙型脑炎偶见阳性,血性和脓性CSF该实验可呈阳性。故此实验特异性不高。
(綦迎成 刘 泓)
[1]熊礼宽.结核病实验诊断学.北京:人民卫生出版社,2003:201-222
[2]张敦熔.结核病新概念.北京:中国农业科技出版社,1995:44-48
[3]何家荣.实用结核病学.北京:科学技术文献出版社,2000:91-92
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














