在实验室工作中,配制试剂是一项经常性的工作,试剂配制不当,特别是标准液配制不准,或是在使用中不小心造成污染,常导致实验结果不准确。因此,每一个实验工作者必须认真做好试剂的配制与使用工作。
一、常用试剂浓度表示法及其计算
溶液浓度,就是在一定量(重量或体积)的溶液或溶剂中所含溶质的量。由于应用的目的不同,表示溶液浓度的方法很多,常用的表示方法有百分浓度、体积比浓度、滴定度、相对密度、物质的量浓度、质量浓度、质量摩尔浓度等。
(一)百分浓度
1. 质量百分浓度
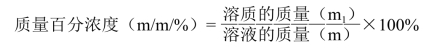
质量百分浓度符号为m/m%或Am,即100g溶液中所含溶质的克数。例如,10% KNO3表示100g该溶液中含有KNO3 10g。
2. 体积百分浓度

体积百分浓度的符号常用V/V%或Av表示,例如,5%盐酸表示100ml溶液中含有5ml浓盐酸。
3. 质量体积百分浓度 一般用于配制溶质为固体的溶液。以100ml溶液中所含固体溶质的克数表示的浓度,即指100ml溶液中所含溶质的克数。

例如,10%NH4Cl溶液表示100ml溶液中含NH4Cl 10g。配制时称取固体NH4Cl 10g,溶于少量水中,然后用水稀释至100ml,混匀即成10%NH4Cl溶液。
4.其他 除了使用溶液百分浓度外,有时还采用千分浓度表示,即1 000份溶液中含溶质的份数。
(二)体积比浓度
体积比浓度是指A体积液体溶质和B体积溶剂相混的体积比,常以(VA+VB)或A∶B符号表示。例如,(1+5)HCl溶液表示1体积市售盐酸与5体积水相混合而成的溶液。有些分析规程中写成1∶5 HCl(或1∶5=HCl∶H2O),其含义相同。写成1∶5容易误看成1.5,所以建议写成(1+5)的形式为好。
(三)摩尔浓度
1.体积摩尔浓度(即摩尔浓度) 指1 000ml溶液中所含溶质的摩尔数,以符号mol/L表示。例如,氢氧化钠分子量为40,2mol/L氢氧化钠溶液就是将80g氢氧化钠(40×2=80g)溶于蒸馏水中,最后使其体积恰等于1L时所得到的溶液。
![]()
2.质量摩尔浓度 用1 000g溶剂中含有溶质的摩尔数来表示的溶液浓度,通常用m表示。例如,0.5m的硝酸钾溶液,即指在1 000g的水中溶有0.5mol的硝酸钾。
3.摩尔分数 溶质的摩尔分数是溶质的摩尔数与溶液的总摩尔数之比。设N和N0分别代表溶质和溶剂的摩尔数,X和X0分别代表溶质和溶剂的摩尔分数,溶液的总摩尔数是N0+N,则:

二、溶液浓度间的换算
关于上面列举的几种常用的溶液浓度表示方法,尽管它们的表达形式不同,但彼此之间都有一定的关系,可以相互换算。溶液浓度间的换算,包括浓溶液的稀释和各类浓度表示方法之间的换算,现分别列举如下。
(一)质量百分浓度的稀释方法
可用交叉图法(又称对角线图式法)进行质量百分浓度的溶液稀释和配制的计算。其原理是基于混合前后溶质的总量不变。
设两种欲混合溶液浓度分别为a和b,取a溶液x份,b溶液y份,混合。混合后溶液浓度为c,则:
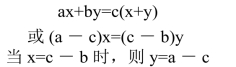
式中,a为浓溶液的浓度;b为稀溶液的浓度(如果稀溶液是水,则b=0);c为混合后溶液浓度;x为应取溶液的份数;y为应加入稀溶液(或水)的份数。
若用图解法表示:
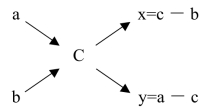
计算时a、b、c单位必须相同。
例1:用50%NaOH溶液与20%NaOH溶液混合,配制30%NaOH溶液。
解:用图解法
①画出交叉图
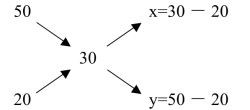
②算出x、y
x=c-b=30-20=10
y=a-c=50-30=20
取50%NaOH溶液10份和20%NaOH溶液20份,混合即得到30%NaOH溶液30份。
③如果要配总体积1 000ml的30%NaOH溶液,则按下面公式计算出应取浓、稀溶液的体积。
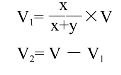
式中,x、y分别为应取浓、稀溶液的份数;V1为应取浓溶液体积(ml);V2为应取稀溶液体积(ml);V为混合后(即要配制的)溶液总体积(ml)。
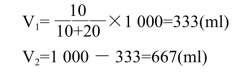
量取333ml的50%NaOH溶液和667ml的20%NaOH溶液,混匀,即得30%NaOH溶液1 000ml。
例2:配制18%H2SO4480g,需用多少克96%的浓H2SO4稀释得到?
解:根据交叉图算出应取浓H2SO4与水的份数。
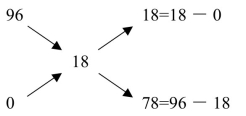
把18份重量的浓H2SO4和78份重量的水相混合,可得18%H2SO4。现在配制480g18%H2SO4,需要96%浓H2SO4的质量为:
![]()
需要水的质量为:
480-90=390(g)
将90g96%浓H2SO4缓慢加入盛有390g水的烧杯中,混匀,即配成480g18% H2SO4。
(二)物质的量浓度的稀释方法
加水稀释溶液时,溶液的体积增大,浓度相应降低,但溶液中溶质物质的量并没有改变。根据溶液稀释前后溶质的量相等的原则,可以得到稀释规则:
CB1×V1=CB2×V2
式中,CB1、CB2分别代表浓溶液和稀溶液的物质的量浓度(mol/L);V1、V2分别代表浓溶液和稀溶液的体积(ml)。
例:用浓度为18mol/L的浓H2SO4溶液,配制500ml 3mol/L的稀H2SO4溶液,需浓H2SO4多少毫升?怎样配制?
解:根据稀释规则:
CB1×V1=CB2×V2
18×V1=3×500
V1=83.3(ml)
取83.3ml 18mol/L浓H2SO4缓慢加入水中,使总体积为500ml,即配成500ml 3mol/LH2SO4溶液。
(三)质量百分浓度与质量摩尔浓度间的换算
例:求60%H2SO4溶液的质量摩尔浓度。
解:60% H2SO4溶液即每100g溶液中含H2SO460g,含水40ml。
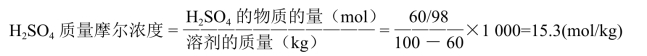
60%H2SO4溶液的质量摩尔浓度为15.3mol/kg。
(四)质量浓度与物质的量浓度间的换算
例:100g/L的NaOH溶液的物质的量浓度为多少?

100g/LNaOH溶液的物质的量浓度为2.5mol/L。
(五)重量浓度与体积浓度间的换算
质量浓度与体积浓度间互相换算时,必须有一个媒介——溶液的密度,借助于密度可以得知溶液的质量和体积的关系。
例:市售H2SO4密度=1.84g/ml,质量百分浓度为98%,求其物质的量浓度。
解:1L H2SO4中含H2SO4的质量为:
1.84×1 000×98%=1803(g)
1L溶液中含的物质的量为:
1803÷98=18.4(mol)
市售H2SO4的物质的量浓度为18.4mol/L。
三、溶液的配制
(一)一般溶液的配制
1.用固体试剂配制溶液
(1)质量浓度溶液的配制:算出制备所需质量浓度的一定质量溶液的固体试剂的用量和蒸馏水量,用台秤称取所需的量,放入烧杯中,再用量筒取所需的蒸馏水注入同一烧杯中并搅拌,使固体完全溶解。将溶液倒入试剂瓶中,贴上标签,即得到所需质量浓度的溶液。
(2)物质的量浓度溶液的配制:算出配制一定体积的溶液所需的固体试剂的用量,用台秤称取所需的固体试剂,放在烧杯中,加入少量的蒸馏水搅拌,使固体完全溶解后转入容量瓶中,用蒸馏水稀释至刻度。将溶液倒入试剂瓶中,贴上标签,即得到所需的物质的量浓度溶液(此溶液经标准溶液标定后可作为标准溶液)。
2.用液体(或浓溶液)配制溶液
(1)体积比溶液的配制:按体积比,用量筒量取液体(或浓溶液)和溶剂的用量,按一定方法在烧杯中将两者混合并搅拌均匀。将溶液转移到试剂瓶中,贴上标签,即得到所需要的体积比溶液。
(2)物质的量浓度溶液的配制:从有关的表中查出液体(或浓溶液)相应的质量浓度、相对密度,算出配制一定体积的物质的量浓度所需要的液体(或浓溶液)的量。用量筒量取所需的液体(或浓溶液),加入装有少量蒸馏水的烧杯中混匀。如果溶液发热,需冷却至室温后再将溶液转移到相应的容量瓶中,用蒸馏水定容,然后移入试剂瓶中,贴上标签,即得到所需的物质的量浓度溶液(此溶液经标准溶液标定后可作为标准溶液)。
(二)标准溶液的配制
1.用固体试剂(基准物)配制标准溶液 算出一定体积的标准溶液所需的固体试剂的量,并在分析天平上准确称取,将其放在干净的烧杯中,加适量蒸馏水使其完全溶解。将所配溶液转移到容量瓶中,用少量蒸馏水洗涤烧杯2~3次,冲洗液也转入容量瓶中,再加蒸馏水至标线,塞上塞子,将溶液摇匀后转入试剂瓶中,贴上标签,即得到所需的标准溶液。
2.用较浓标准溶液配制标准溶液 算出配制标准溶液所需已知标准溶液的用量,再用吸管量取已知用量的标准溶液放入给定体积的容量瓶中,加蒸馏水至刻度,摇匀,倒入试剂瓶中,贴上标签,即得到所需的标准溶液。
(三)溶液配制的注意事项
1.称量要精确,特别是在配制标准溶液、缓冲液时,更应注意严格称量。有特殊要求的,要按规定进行干燥、衡重、提纯。
2.一般溶液都应用蒸馏水或去离子水(即离子交换水)配制,有特殊要求的除外。
3.化学试剂根据其质量分为各种规格(品级),除一般化学试剂的分级外,还有一些规格,如纯度很高的光谱纯、层析纯,纯度较低的工业用药典纯(相当于四级)等。配制溶液时,应根据实验要求选择不同的规格的试剂。
4.试剂应根据需要量配制,一般不宜过多,以免积压浪费,过期失效。
5.试剂(特别是液体)一经取出,不得放回原瓶,以免因量器或药勺不清洁而污染整瓶试剂。取固体试剂时,必须使用洁净干燥的药勺。
6.配制试剂所用的玻璃器皿都要清洁干净。存放试剂的试剂瓶应清洁干燥。
7.试剂瓶上应贴标签,写明试剂名称、浓度、配制日期及配制人。
8.试剂用后要用原瓶塞塞紧,瓶塞不得沾染其他污物或沾污桌面。
9.有些化学试剂极易变质,变质后不能继续使用。
四、酸碱溶液的标定
酸碱滴定法又叫中和法,是滴定分析法的一种,它是以酸碱反应为基础的滴定分析法。在酸碱滴定中,常用盐酸和氢氧化钠溶液作为滴定剂。由于浓盐酸易挥发,氢氧化钠易吸收空气中的水和二氧化碳,故采用此类滴定剂直接配制无法保证准确,只能配制成近似浓度的溶液,再用标准溶液或基准物标定其浓度。
(一)用草酸标准溶液标定氢氧化钠溶液的浓度
1.滴定前的准备 取一支洁净的酸式滴定管用蒸馏水淋洗3次,再用标准草酸溶液淋洗3次,注入标准的草酸溶液到“0”刻度处。取一支洁净的吸管,用蒸馏水淋洗3次,再用待测浓度的氢氧化钠溶液淋洗3次,用移液管吸取25ml待测浓度的氢氧化钠溶液注入洁净的锥形瓶中,加2~3滴甲基橙指示剂,摇匀。
2.滴定 右手持锥形瓶颈部,左手大拇指、示指、中指转动旋塞,让酸液逐滴滴入瓶内,右手不断摇动锥形瓶,使溶液混匀。滴定开始时,液体滴出速度可稍快一些,但只能是一滴一滴地加,不可形成一股液流。酸液滴入碱液中时,局部会出现橙色,随着摇动橙色很快消失。当接近终点时,橙色消失较慢,此时,应逐滴加入酸液,每加1滴酸液,都要将溶液摇动均匀,注意橙色是否消失,直到滴入一滴草酸溶液,瓶内溶液恰好由黄色变为橙色,即达到滴定终点,记下滴定管液面的读数。再重复滴定2次,将3次所用草酸的体积取平均值,计算氢氧化钠溶液的浓度。
(二)用已知浓度的碱液(或基准物)标定盐酸溶液的浓度
1.滴定前的准备 碱式滴定管经洗涤、装液,逐出橡皮管和尖嘴内的气泡后,调节液面至“0”刻度位置。用移液管吸取25ml待测的盐酸溶液,放入洁净的锥形瓶中,加入2滴酚酞指示剂。
2.滴定 将锥形瓶放在滴定管下面,右手持锥形瓶,左手挤压橡皮管内的玻璃球滴定氢氧化钠标准溶液,当瓶内溶液恰好由无色变为红色时即达终点,记下滴定液面的位置。再取待测浓度的盐酸溶液,用氢氧化钠标准溶液重复滴定2次。取3次所用氢氧化钠溶液体积的平均值计算盐酸溶液的浓度。
(何肖娟)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















