实训三 菠萝蛋白酶的制备及鉴定
实训目的
(1)系统地学习蛋白质提取、分离纯化技术的原理及实训技术。
(2)熟练掌握硫酸铵盐析法、蛋白质含量测定、蛋白质纯度鉴定等实训技术。
(3)掌握菠萝蛋白酶的酶活性检测方法。
实训原理
菠萝蛋白酶,相对分子质量为33 000,等电点为9.55,最适pH值为5.0~8.0,最适温度为40~70℃。菠萝蛋白酶是典型的巯基蛋白酶,广泛存在于菠萝的果实、芽、叶及茎中,能分解蛋白质、肽、酯和酰胺,其成品为浅黄色、无定形粉末,稍溶于水,不溶于乙醇、丙酮、氯仿、乙醚,微有臭味,其酶活性能被半胱氨酸激活,而受重金属抑制。菠萝蛋白酶用途广泛,可用于干酪、明胶、水解蛋白的生产,也可作为一种食品添加剂,可使肉质嫩化、啤酒澄清,还可以治疗生物体水肿及多种炎症,能迅速溶痂,对正常组织无害,适用于中、小面积深度烧伤的治疗。
要研究某种蛋白质的结构和功能,生产具有高生物活性的蛋白质类激素、酶等,第一步工作就是从复杂的混合体系中分离出蛋白质并且进行纯化分析。
1.蛋白质分离纯化的一般程序
(1)选择一种目的蛋白质含量丰富、稳定性好的样品材料。
(2)将目的蛋白质从样品中抽提出来。
(3)确定分离纯化的方法,使粗品的纯度达到预定要求。
(4)建立灵敏、特异、精确的检测手段,分步测定目的蛋白质的含量,检验目的蛋白质的纯度。
(5)在操作、分析过程中注意保护目的蛋白质的稳定性,防止其变性。
2.蛋白质的分离纯化方法
利用蛋白质溶解度不同的分离纯化方法有盐析法、等电点沉淀法等,主要生产方法有单宁沉析法、高岭土吸附法和超滤法。
盐析法是粗分离蛋白质的重要方法之一。在稀盐溶液中,蛋白质的溶解度随盐浓度的增加而升高,这种现象称为盐溶。但当盐浓度增加到一定量时,蛋白质溶解度又逐渐下降,直到某一浓度时便从溶液中析出,称为盐析。这是因为蛋白质分子吸附某种盐离子后,其带电表层使蛋白质分子彼此排斥,而蛋白质分子与水分子间的相互作用却加强,因而溶解度提高,但当大量中性盐加入时,水的活度降低,进而导致蛋白质分子表面的电荷逐渐被中和,水化层逐渐被破坏,最终引起蛋白质分子相互聚集并从溶液中析出。
用于盐析的中性盐通常有硫酸铵、硫酸钠和硫酸镁等,而以硫酸铵的效果为最佳,它在水中溶解度大而温度系数小(在25℃时,其溶解度为767g/L;在0℃时,其溶解度为697g/L),分离效果好,能保持蛋白质的天然构象,且价廉易得。不同蛋白质在盐析时所需盐浓度不同,故调节盐浓度可适当将蛋白质分离。如鸡蛋清中的球蛋白在半饱和硫酸铵溶液中沉淀,清蛋白在饱和硫酸铵溶液中沉淀。
3.菠萝蛋白酶活性测定
酪蛋白是一种蛋白质,它被菠萝蛋白酶降解生成的酪氨酸在紫外光区275 nm波长处有吸收峰,根据测定275nm波长处的吸光度,可以判定菠萝蛋白酶的酶活性。吸光度的大小与酪氨酸含量的多少有关,吸光度大说明酪氨酸含量高,也意味着菠萝蛋白酶分解的酪蛋白多,酶活性也高。
4.菠萝蛋白酶的含量测定
由于蛋白质中存在着含有共轭双键的酪氨酸和色氨酸,因此蛋白质溶液在紫外光区280nm波长处具有吸收峰。某蛋白质溶液的浓度与其在一定波长光线下的吸光度存在对应关系,即在一定浓度范围内,蛋白质溶液在此波长处的吸光度与其浓度成正比关系,因此利用这一性质可进行蛋白质定量测定。该方法迅速、简便,不消耗样品,低浓度盐类不干扰测定,可测定浓度为0.1~1.0mg/mL的蛋白质溶液的蛋白质含量。
5.菠萝蛋白酶的纯度测定
冷冻干燥是指通过升华的方法从冻结的生物产品中去掉水分或其他溶剂的过程。升华是指溶剂(如水)像干冰一样,不经过液态,从固态直接变为气态的过程。冷冻干燥得到的产物称为冻干物。传统的干燥会引起材料皱缩,破坏细胞,在冷冻干燥的过程中样品的结构不会被破坏,因为固体成分被在其位置上的冰支持着。在冰升华时,它会在干燥的剩余物质里留下孔隙,这样就保留了产品的生物和化学结构及其活性的完整性。
在实验室中,冷冻干燥有很多不同的用途,它在许多生物化学与制药应用中是不可缺少的,它被用于获得可长时期保存的生物材料,如酶、血液与药品,除长期保存的稳定性以外,它还保留了其固有的生物活性与结构。冷冻干燥能得到干燥状态的样品,使样品成分稳定,也不需改变样品的化学成分,是理想的分析辅助手段。
实训材料
新鲜菠萝50g。
实训试剂
1.盐析粗酶提取液
(1)0.1mol/L磷酸盐缓冲液(PBS)(pH=7.8)200mL。
(2)0.2%的单宁溶液:取0.2g单宁加入100mL蒸馏水中溶解。
(3)固体硫酸铵。
(4)5%苯甲酸钠溶液,10%EDTA-Na,5%的维生素C溶液。
2.测酶活性试剂
(1)1%酪蛋白溶液(pI=4.8)50mL:加0.5g酪蛋白(进口装)于50mL 0.1mol/L的PBS(pH=7.8)中,在50~55℃水浴条件下溶解,不停搅拌,约需1h才能溶解。
(2)激活剂(0.5%硫代硫酸钠溶液):取0.5g硫代硫酸钠加100mL蒸馏水溶解。
(3)5%三氯乙酸(TCA)50mL。
实训器材
(2)离心机(冷冻式或非冷冻式)。
(3)752型紫外分光光度计。
(4)恒温水浴锅。
(5)电子分析天平。
(6)托盘天平。
(7)剪刀、纱布。
(8)冰箱。
(9)真空泵和冷冻干燥机。
(10)滤纸、pH值试纸。
(11)玻璃器皿:试管、烧杯(100mL、200mL)、吸管、玻璃棒、移液管或移液器(5mL、1mL、0.5mL)、漏斗、量筒(100mL)、培养皿。
实训步骤
1.粗酶提取
粗酶提取的步骤如下。
新鲜菠萝(每一组)50g+50mL 0.1mol/L PBS(pH=7.8)
↓
榨汁机搅拌
↓
用2~4层纱布过滤于烧杯中
↓
加5%苯甲酸钠溶液1mL,搅匀,用于防腐,分装于离心管(50mL)
↓
平衡离心(4 000r/min,15min)
↓
弃沉淀,取上清液,量体积,倒入小烧杯,
在搅拌条件下,加入10%EDTA-Na 4mL、5%的维生素C溶液1mL
↙ ↘
缓慢加入6g固体硫酸铵(形成的硫
酸铵溶液的饱和度小于30%) 加入0.2%的单宁溶液4mL
↘ ↙
边加边搅拌,倒入离心管(每组1~2支离心管)
↓
离心管在4℃下放置1.5h
↓
平衡离心(4 000r/min,15min)
↓
取沉淀,再加0.1mol/L PBS(pH=7.8)8mL溶解,如果不能完全溶解,平衡后离心(4 000r/min,10min),弃沉淀,取上清液(酶液),进行酶活性测定
2.酶活性测定方法
酶活性测定时各试剂的加入量和顺序如表4-1所示。
表4-1 酶活性测定数据表
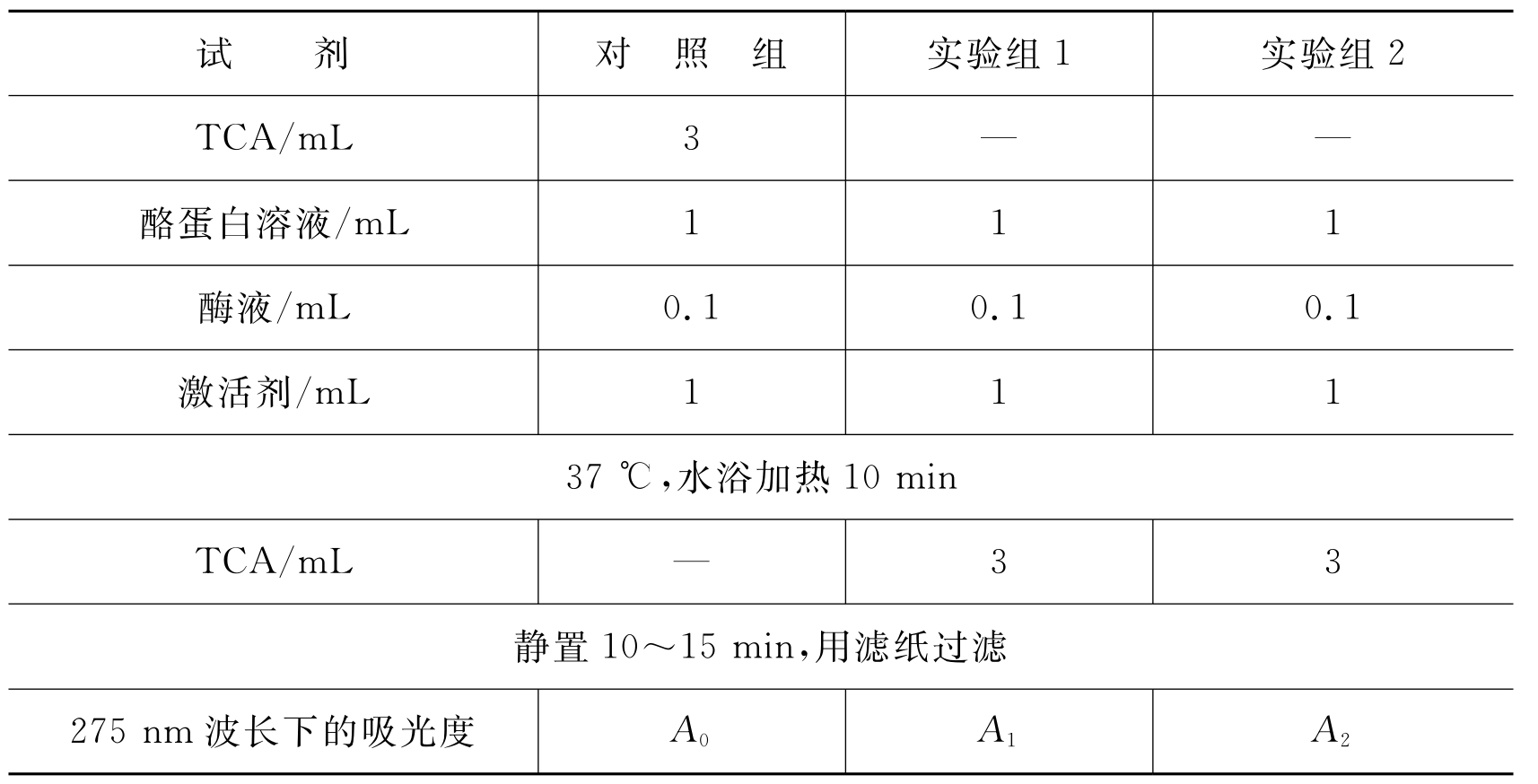
酶活性单位:在上述条件下(37℃,酶促反应10min),每10min吸光度变化0.01的酶含量称为1个酶活性单位(U)。计算公式: 1mL酶液的酶活性单位(U)=[(A1+A2)/2-A0]/0.01×0.1
3.酶的含量测定
取3支试管,编号,按表4-2加入试剂。
表4-2 酶含量测定记录表
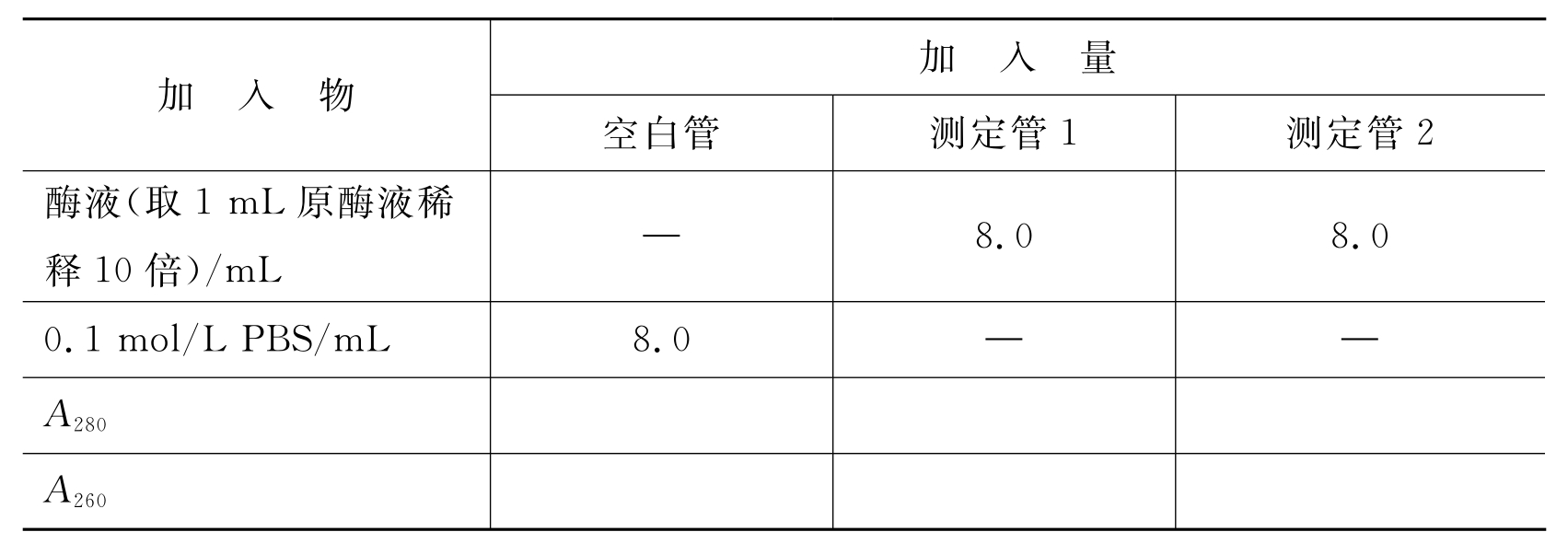
将上述3支试管中物质混匀,用紫外分光光度计在280nm、260nm波长下,以空白管调零,测定样品的吸光度。
按下式计算酶的质量浓度:
酶的质量浓度(mg/mL)=1.45×A280-0.74×A260
式中:A280为酶在280nm波长处测得的吸光度;
A260为酶在260nm波长处测得的吸光度。
4.酶的纯度鉴定
利用真空冷冻干燥法除去酶液中的水分,得到酶的干粉状成品,计算酶的纯度。
(1)检查系统是否清洁和干燥,真空泵与冷冻干燥机是否连接,接通电源,检查排气口、冷冻管的密封性。
(2)加样:将样品置于冷冻舱里的隔板上,关闭密封管开关。
(3)冷冻:打开冷冻开关,等待20~30min,直到冷冻舱的温度低于-40℃。
(4)抽真空:打开真空泵开关,等待20~30min,直到系统压力低于10Pa。
(5)监控过程:确保系统参数(冷冻温度、真空压力)在正常范围内,定期检查冷冻舱中的结冰情况,决定是否要除霜;观察样品是否干燥完全,一般干燥过程至少需要24h,具体时间通过目测而定。
(6)关闭系统:关闭总开关,接上排气管或打开密封管开关以解除真空状态。关闭真空开关,关闭冷冻开关,取出样品,称重,记录数据。
按照下列公式计算:
酶的纯度=(酶的质量/成品的质量)×100%
注意事项
(1)在用固体硫酸铵盐析时,要边加边搅拌,注意控制硫酸铵的浓度,避免其他蛋白质混入发生沉淀,影响酶的纯度,增加后续分离纯化的难度。
(2)在进行酶提取时,要注意提取过程的温度控制,在整个实训过程中,都要将酶液样品置于4℃环境下,防止酶失活。
(3)在酶液保存时要注意冰结晶会造成物理剪切及蛋白质变性,应避免酶的反复冻融,如果酶需要冻存,应分装成小管后冻存。
(4)在进行酶活性测定时,要避免其他蛋白质或酶的污染,避免溶液剧烈振荡,避免溶液中混入蛋白质变性剂。
思考题
(1)如何防止酶在分离纯化过程中变性?
(2)如何提高实训中酶的含量和纯度?
(3)通过实训比较利用固体硫酸铵和单宁两种提取方法的优点和缺点。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














