第一节 蛋白质的检测
一、蛋白质浓度的测定
蛋白质含量可从它们的物理化学性质,如折射率、比重、紫外吸收和染色等测定而得知;或用化学方法,如定氮、双缩脲反应及Folin-酚试剂反应等方法来测定。
1.双缩脲法 当脲加热至180℃时,两分子脲缩合,释放出一分子氨而形成双缩脲,双缩脲结构可在碱性溶液中与Cu2+形成紫红色铜-双缩脲复合物。蛋白质或2肽以上的多肽,含有多个与双缩脲结构类似的肽键,所以,蛋白质在碱性溶液中也能与Cu2+形成紫红色复合物,其颜色的深浅与蛋白质的含量成正比,而与蛋白质的相对分子质量及氨基酸成分无关,故可用比色法来测定蛋白质含量。测定蛋白质浓度为1~10mg/ml。常用于需要快速但并不需要十分精确的测定。
2.Folin-酚试剂法 又名Lowry法,它是在双缩脲反应的基础上发展起来的。Folin-酚试剂由试剂A和B两部分组成。试剂A是碱性铜试剂,相当于双缩脲试剂;试剂B含有磷钨酸和磷钼酸。在碱性条件下,蛋白质与碱性铜试剂产生双缩脲反应,形成紫红色的蛋白质与铜的复合物,然后此复合物中的酪氨酸和色氨酸残基还原试剂B中的磷钼酸-磷钨酸,产生深蓝色,此深蓝色物质为钼蓝和钨蓝的混合物,其呈色强度与蛋白质浓度呈正相关,可用比色法测定蛋白质的浓度。光吸收峰值可选500~800nm之间的某处。由于Folin-酚试剂与蛋白质作用包含两种呈色反应,灵敏度较双缩脲法高。该法可测定蛋白质浓度范围为25~250μg/ml。
3.考马斯亮蓝G-250染色法(Bradford法) 考马斯亮蓝G-250是一种蛋白质染料,在酸性条件下呈棕红色。当它所含的疏水基团与蛋白质通过疏水作用结合后变为蓝色,其呈色强度与蛋白质浓度呈正相关。当染料与蛋白质结合后会引起染料最大光吸收峰的改变,从465nm变为595nm。该法测定蛋白质浓度不但灵敏度高,而且测定的浓度范围广,每个实验室都可方便地运用。该法可测定的蛋白质浓度范围为10μg/ml~10mg/ml。
上述3种方法的显色反应均需通过可见分光光度计进行比色定量。测定时,待测样品的浓度必须在所作标准曲线的浓度范围之内,如超出范围需将样品稀释或重新制作符合要求的标准曲线。为精确起见,最好每次测定都制作一条标准曲线。
4.紫外吸收法 由于蛋白质中酪氨酸和色氨酸残基的苯环含有共轭双键,因此蛋白质具有吸收紫外光的性质,吸收高峰在280nm处。在此波长范围内,蛋白质溶液的光吸收值与其含量呈正比关系,可用作定量测定。测量蛋白质浓度范围为0.2~2mg/ml。该测定法简单、灵敏、快速、不消耗样品,低浓度的盐类不干扰测定。但利用紫外吸收法测定蛋白质含量准确度较差,这是由于:①对于测定那些与标准蛋白质中酪氨酸和色氨酸含量差异较大的蛋白质,有一定的误差。故该法适用于测定与标准蛋白质氨基酸组成相似的蛋白质。②若样品中含有嘌呤、嘧啶等吸收紫外光的物质,会出现较大干扰。
5.其他方法 如定氮法、二辛可宁酸(bicinchoninic acid,BCA)法等。定氮法比较繁复,但较准确,往往以定氮法测定好浓度的蛋白质可以作为其他测定方法的标准蛋白。BCA法原理与Lowry法相似,即在碱性环境下蛋白质与Cu2+络合并将Cu2+还原成Cu+,BCA与Cu+结合形成稳定的紫蓝色复合物,在562nm处有高的光吸收值并与蛋白质浓度成正比,据此可测定蛋白质浓度,检测下限可达5μg/ml。
(一)一般步骤
聚丙烯酰胺凝胶电泳(PAGE)的一般步骤为:制胶、电泳、染色、结果保存。
1.制胶 聚丙烯酰胺凝胶是用单体丙烯酰胺(Acr)和交联剂亚甲基双丙烯酰胺(Bis)经催化剂的作用在一定的制胶装置中聚合而成。聚丙烯酰胺凝胶的机械强度好、有弹性、透明;化学性质相对稳定;对pH和温度变化较稳定;在很多溶剂中不溶;是非离子型的,没有吸附和电渗作用;通过改变浓度和交联度,可以控制孔径变动在极广泛的范围;制备凝胶的重复性好;由于纯度高及不溶性,因此还适用于少量样品的制备,而不至于污染样品。
聚丙烯酰胺凝胶的机械性能、弹性是否适中是很重要的。胶太软不易成形,尤其在制作板型电泳的薄片状凝胶时,太软很难操作;胶太硬则脆,也易折断。凝胶的透明度、黏着度是否合适也影响分离效果。凝胶的机械性能、弹性、透明度、黏着度以及凝胶中网孔的大小取决于凝胶总浓度和Acr(a)与Bis(b)两者之比例。当a/b<10时,胶脆而易碎,呈乳白色;当a/b>100时,胶呈糊状;当a/b为30左右时,胶为透明且有弹性的凝胶。凝胶总浓度的计算公式为:
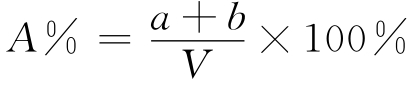
式中,A%为凝胶浓度,a、b分别为Acr、Bis的质量,V为凝胶溶液的体积。凝胶浓度越高,凝胶中网孔越密,可以分离的蛋白质相对分子质量范围越小。
聚丙烯酰胺凝胶聚合的催化体系有两种。
(1)化学聚合:化学聚合的催化剂通常采用过硫酸铵或过硫酸钾,此外还需要一种脂肪族叔胺作为加速剂,最有效的加速剂为N,N,N′,N′-四甲基乙二胺(TEMED)。在叔胺的催化下,由过硫酸铵形成氧的自由基,后者又使单体形成自由基,从而引发聚合作用。叔胺要处于自由碱基状态下才有效。所以在低pH时,常会延迟聚合作用。分子氧阻止链的延长,妨碍聚合作用,一些金属也能抑制聚合。冷却可以使聚合速度变慢。通常控制这些因素使聚合在1小时内完成,以便使凝胶的性质稳定。
(2)光聚合:光聚合通常用核黄素为催化剂。不一定加TEMED亦能聚合,但加入则可加速聚合。光聚合通常需要有痕量氧存在,核黄素经光解形成无色基团,后者被氧再氧化形成自由基,从而引发聚合作用。但过量的氧会阻止链长的增加,应该避免过量的氧存在。光聚合通常用日光灯或普通钨丝灯泡作光源,直接日光或室内强散射光也可以。
2.电泳 不同种类的PAGE所选用的电泳仪器以及相应的电泳电压不同。经电泳后,蛋白质混合物中不同的组分将依据不同种类电泳的原理得到分离,聚集于凝胶的不同位置。具体在后面的PAGE分类中介绍。
电泳过程中有时会产生高热,可在电泳装置中添加冷凝水来降温。
3.染色 电泳完毕后,为观察分离效果,需要对凝胶进行染色,才能使蛋白位置显现出来。常用的染色剂有:氨基黑10B、考马斯亮蓝R-250、硝酸银等。
4.结果保存 显色后需将凝胶拍照或扫描以记录结果,或者直接通过干胶来保存。
(二)PAGE的分类
PAGE中,根据相对分子质量不同的原理来分离蛋白质的方法有SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)和聚丙烯酰胺梯度凝胶电泳(PG-PAGE);根据等电点不同的原理来分离蛋白质的方法有聚丙烯酰胺凝胶等电聚焦电泳(IEF-PAGE)。
1.SDS-PAGE 其原理是:在蛋白质溶液中加入β-巯基乙醇或DTT后,β-巯基乙醇或DTT能使蛋白质分子中的二硫键还原,而SDS能使蛋白质分子中的氢键、疏水键打开,并结合到蛋白质分子上,形成蛋白质-SDS复合物。在一定条件下,SDS与大多数蛋白质的结合比为1.4∶1。由于SDS带有大量的负电荷,与蛋白质结合时,掩盖了不同种类蛋白质原有的电荷差别,使各种蛋白质-SDS复合物都带上相同密度的负电荷,所以,SDS-PAGE中不同蛋白质的分离只与相对分子质量大小相关,而与蛋白质原来的电荷差别无关。SDS与蛋白质结合后,还引起了蛋白质构象的改变。蛋白质-SDS复合物的流体力学和光学性质表明,它们在水溶液中的形状,近似于雪茄烟形的长椭圆棒,不同蛋白质-SDS复合物的短轴长度都一样,约为1.8nm,而长轴则随蛋白质的相对分子质量成正比地变化。这样的蛋白质-SDS复合物在凝胶电泳中的迁移率,不再受蛋白质原有电荷和形状的影响,而只是椭圆棒的长度也就是蛋白质相对分子质量的函数。
图6-1为细胞中提取的总蛋白质经SDS-PAGE分离后的同一张凝胶先经考马斯亮蓝染色,后经银染色的实验结果比较,可见绝大多数蛋白条带银染色的灵敏度要高于考马斯亮蓝染色。

图6-1 细胞总蛋白SDS-PAGE的实验结果
注:泳道M为蛋白质分子量标准,泳道1~7为不同来源的细胞中提取的总蛋白
不同的凝胶浓度适用于不同的蛋白质相对分子质量分离范围(表6-1),可根据所测蛋白质的相对分子质量选择最适凝胶浓度,并尽量选择相对分子质量范围和性质与待测样品相近的蛋白质作为分子量标准。
表6-1 SDS-PAGE的有效分离范围
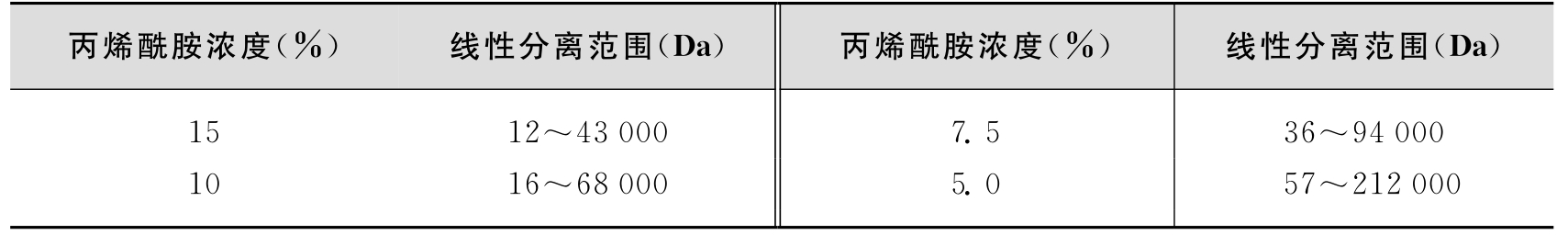
注:双丙烯酰胺:丙烯酰胺摩尔之比为1∶29。
引自萨姆布鲁克J,弗里奇EF,曼尼阿蒂斯著.分子克隆实验指南.第2版.北京:科学出版社,1992.881。
并非所有的蛋白质都能用SDS-PAGE来测定其相对分子质量,已发现有些蛋白质用这种方法测出的相对分子质量是不可靠的。这些蛋白质有:电荷异常或构象异常的蛋白质,带有较大辅基的蛋白质(如某些糖蛋白)以及一些结构蛋白,如胶原蛋白等。还应该注意的是:如果蛋白质是由亚基或两条以上肽链组成,那么,在SDS、DTT等的作用下,肽链间的二硫键将被打开,解离成亚基或单个肽链,所以测得的将是亚基或单条肽链的相对分子质量。
SDS-PAGE根据有无浓缩效应分为连续系统和不连续系统。不连续系统采用电泳基质的不连续体系(即凝胶层的不连续性、缓冲液离子成分的不连续性、pH的不连续性及电位梯度的不连续性),使样品在不连续的两相间,即浓缩胶和分离胶之间积聚浓缩成很薄的起始区带,然后再进行电泳分离。但连续系统化学性质温和,不致使蛋白质、酶等活性物质完全失活,并且较少出现迁移率假性变动的情况,制备相对方便,因此也常被采纳。
2.PG-PAGE 线性梯度凝胶电泳中,蛋白质在电场中向着凝胶浓度逐渐增高的方向即孔径逐渐减小的方向迁移,随着电泳的继续进行,蛋白质受到孔径的阻力越来越大。起初,蛋白质在凝胶中的迁移速度主要受两个因素的影响:①蛋白质本身的电荷密度,电荷密度越高,迁移速度越快;②蛋白质本身的大小,相对分子质量越大,迁移速度越慢。当蛋白质迁移所受到的阻力大到足以完全停止它前进时,低电荷密度的蛋白质将“赶上”与它大小相似,但具有较高电荷密度的蛋白质。因此,在梯度凝胶电泳中,蛋白质的最终迁移位置仅决定于它本身分子的大小,而与蛋白质本身的电荷密度无关。经过长时间电泳后,所有大小不同的分子进入凝胶孔径梯度中,大、小分子分别滞留于与其分子大小相当的凝胶孔径中,不再向前移动,因而得到分离。该法可测相对分子质量范围大,并且可以直接测定天然状态的蛋白质,但只适用于球蛋白,对纤维状蛋白误差大。PG电泳时,需要2000V以上的高压,并且需要一个叫梯度混合器的特殊装置来制备梯度胶,操作比较复杂。
3.IEF-PAGE 它是利用蛋白质分子之间等电点的不同,在一个稳定的、连续的、线性的pH梯度中进行蛋白质的分离。蛋白质分子是典型的两性电解质分子,含可电离的基团有氨基、羧基、咪唑基、胍基、酚基及吲哚基等。蛋白质在各种pH值的带电情况是这些电离基团电离情况的总结果。蛋白质由于带电,在电场中会泳动,静电荷为正,则向负极泳动;静电荷为负,则向正极泳动;某一pH值处蛋白质的带电情况正负相抵,在电场中不泳动,该pH即为该蛋白质的等电点(pI),不同的蛋白质pI不同。当蛋白质混合物处于一个pH梯度逐渐升高的介质中时,在电场的作用下蛋白质会按pI大小的不同,聚焦于与pI大小相同的pH处。这种按pI大小在pH梯度中相对应的位置进行聚焦的行为,称为等电聚焦。IEF-PAGE中蛋白质的分离只和蛋白质的等电点有关,而和蛋白质的相对分子质量无关,聚丙烯酰胺凝胶在该方法中只是作为防扩散、抗对流的支持介质而发挥作用。IEF-PAGE具有分辨率高、重复性好、操作简便和迅速等优点,在生物化学、分子生物学、遗传学及临床医学等研究中应用广泛。不仅适用于分离分析,而且也适用于分离制备,尤其是同工酶和激素受体的制备。
4.双向凝胶电泳(two-dimensional gel electrophoresis,2-DGE) 两种类型的PAGE组合而成2-DGE电泳,如IEF/SDS-PAGE、IEF/PG-PAGE。样品经第一向电泳分离后,再以垂直于它的方向进行第二向电泳,分辨率高于任一种单一方法。图6-2为细胞总蛋白经IEF/SDS-PAGE 2D电泳的凝胶银染色实验结果。

图6-2 细胞总蛋白经IEF/SDS-PAGE 2D电泳的凝胶银染色实验结果
三、酶联免疫吸附试验
免疫酶技术是将酶标记在抗体(或抗原)分子上,形成酶标抗体(或酶标抗原),称为酶结合物。酶结合物与相应的抗原(或抗体)发生免疫反应,形成酶标记的免疫复合物,该复合物作用于底物使之呈色,根据颜色的有无和深浅,定位或定量抗原(或抗体)。
酶联免疫吸附试验(ELISA)是免疫酶技术的一种,其特点是利用聚苯乙烯微量反应板(或球)吸附抗原(或抗体),使之固相化,免疫反应和酶促反应都在其中进行。在每次反应后都要反复洗涤,这既保证了反应的定量关系,也避免了未反应的游离抗体(或抗原)的分离步骤。在ELISA中,酶促反应只进行一次,而抗原、抗体的免疫反应可进行一次或数次,即可用二抗(抗抗体)、三抗再次进行免疫反应,这就便于根据需要自行设计实验。ELISA既具有抗原抗体反应的特异性,又具有酶促反应的生物放大作用。因此,可作为基因表达产物的定性定量测定方法。表6-2是各种常用的ELISA。
表6-2 各种常用的ELISA
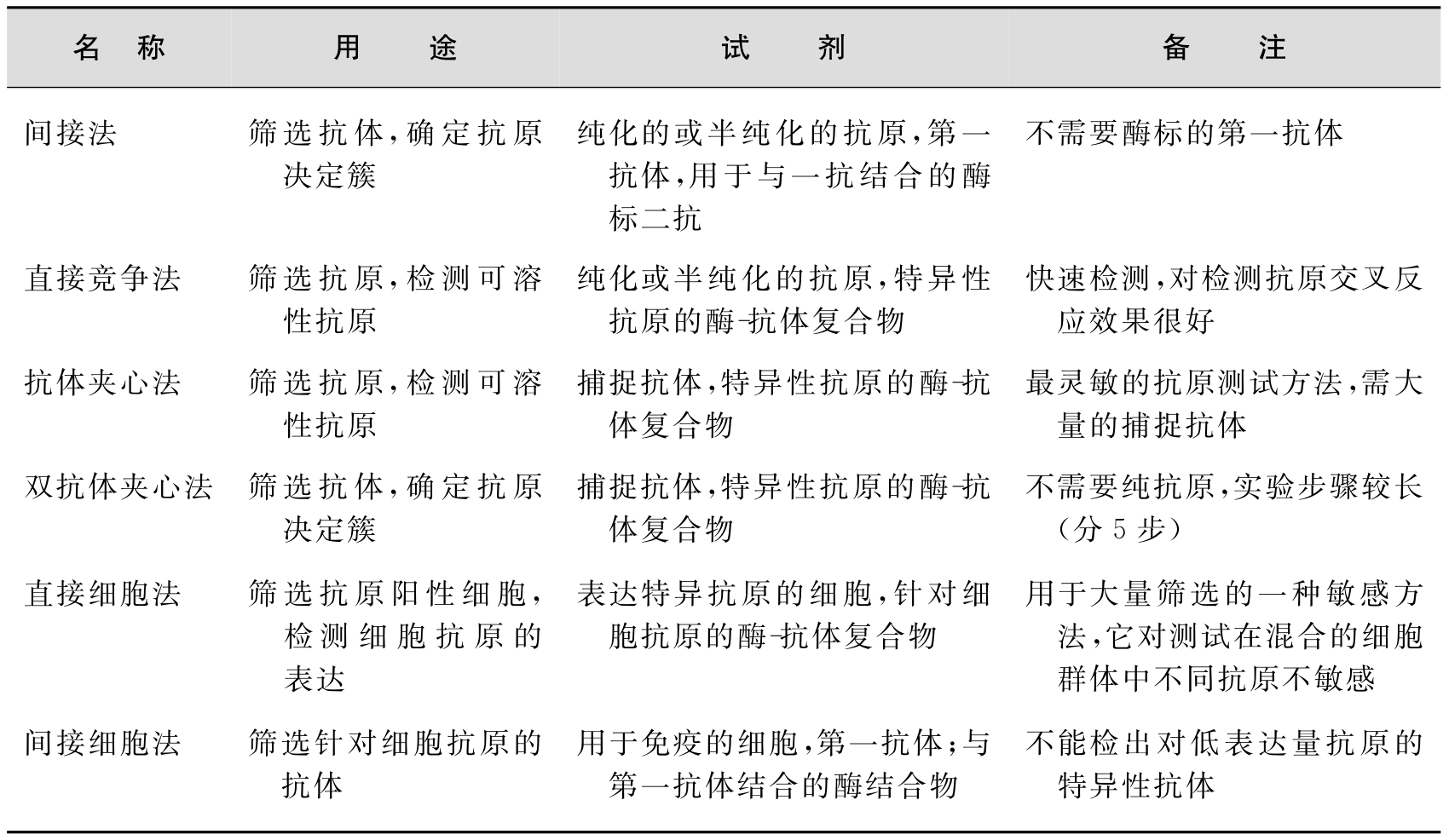
引自李永明,赵玉琪等著.实用分子生物学方法手册.北京:科学出版社,1998,362。
四、Western印迹分析
Western印迹(Western blot)分析是将蛋白质转移并固定在化学合成膜之类的固相支持物上,然后以特定的亲和反应、免疫反应或结合反应以及显色系统分析此印迹。其实验原理如图6-3所示。
Western印迹分析需要较好的蛋白质凝胶电泳技术,以使蛋白质达到好的分离效果;同时要注意凝胶的用量,要使蛋白质容易转移到固相支持物上。另外,蛋白质在电泳过程中获得的条带被转印到膜上后,在随后的保温阶段应不能丢失和扩散。Western印迹分析需要的主要试剂用量较少,特异性高,实验过程较短,操作比较容易,主要包括如下步骤。
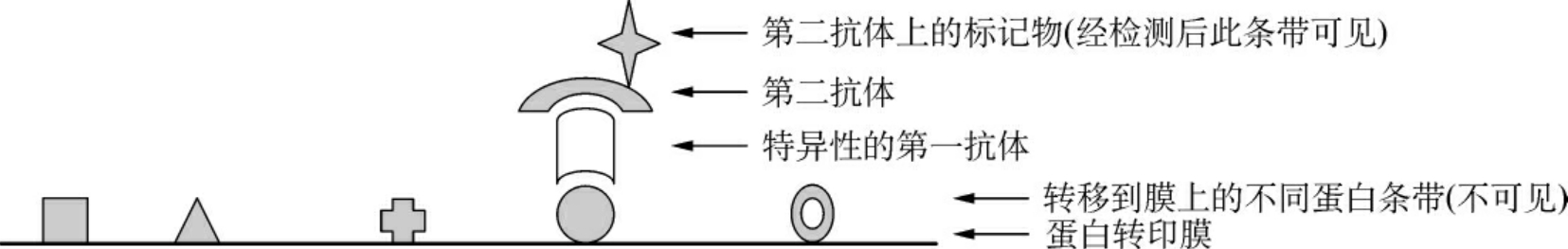
图6-3 Western印迹分析原理示意图
1.蛋白质样品的制备、上样样品的准备和蛋白质电泳 各种哺乳动物的细胞在物理性质和生物学性质方面存在着很大差异,目前还很难找到一种简单的裂解方法使得所有蛋白质均呈溶解状态并保留其免疫反应性,同时又不被降解。现在常用的方法是通过机械破碎或去污剂(如SDS、NP-40)裂解,使细胞内的蛋白质溶解出来,再通过剪切除去DNA,得到的溶液即为细胞总蛋白溶液。为防止蛋白质的降解,可在裂解液中加入蛋白保护剂,如DTT、β-巯基乙醇;还可加入蛋白酶的抑制剂,如PMSF。制备好的蛋白质样品,用于电泳前,需经过浓度测定。上样样品的多少根据所选择的PAGE方式确定,如选择的是SDS-PAGE,其上样量一般最多为30μg/mm2载荷面。
2.转膜固定 蛋白质样品进行PAGE分离,可选择前面介绍的几种PAGE中适合的一种,常选用SDS-PAGE、2D-PAGE;电泳分离的蛋白质条带或蛋白质点从胶上通过半干或湿法转移到膜上,常用的转印膜有PVDF、尼龙膜、硝酸纤维素膜。图6-4为半干转移法转移“三明治”叠加情况的示意图。蛋白质是否转移成功,可通过用预染的蛋白质相对分子质量标准或用丽春红染色来判别。
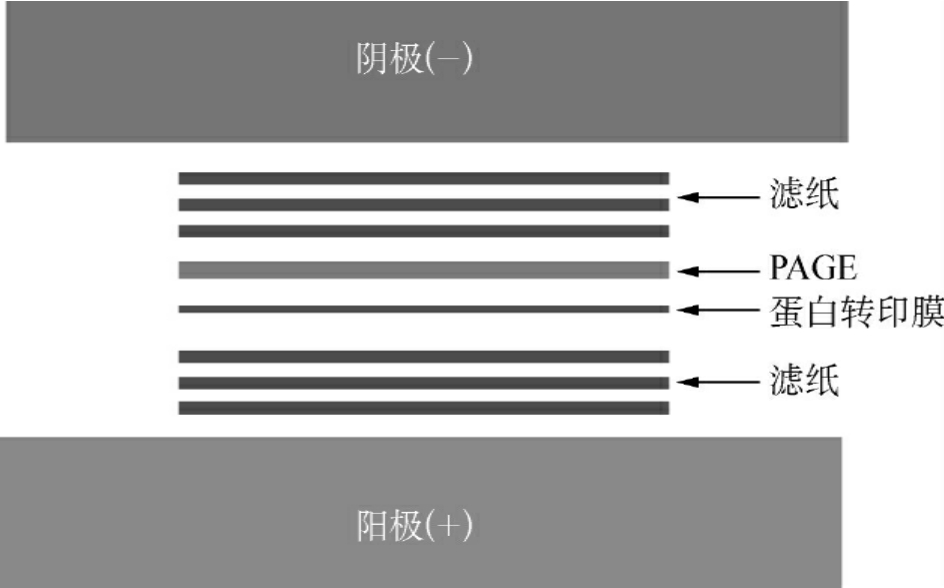
图6-4 半干转移法转移“三明治”叠加情况示意图
3.封闭 转印膜除了可与电转移时的蛋白质结合外,还可与作为检测试剂的特异性的第一抗体发生非特异性结合,从而使Western印迹的背景加深,因此需对膜上的潜在结合位点进行封闭处理,以封闭未吸附蛋白的部位,使膜上没有特异性一抗非特异吸附的位点,以保护特异性一抗结合到膜上时只与靶蛋白反应。封闭液可选择脱脂奶粉、牛血清白蛋白等。
4.第一抗体与靶蛋白的结合 第一抗体,简称一抗。是针对待检测蛋白的特异性抗体,可选择单克隆抗体或多克隆抗体。单克隆抗体特异性好,但敏感性差;多克隆抗体反之。如果目标蛋白含量少或经过变性处理(如SDS-PAGE时SDS对蛋白的变性作用),则往往倾向于选择多克隆抗体。
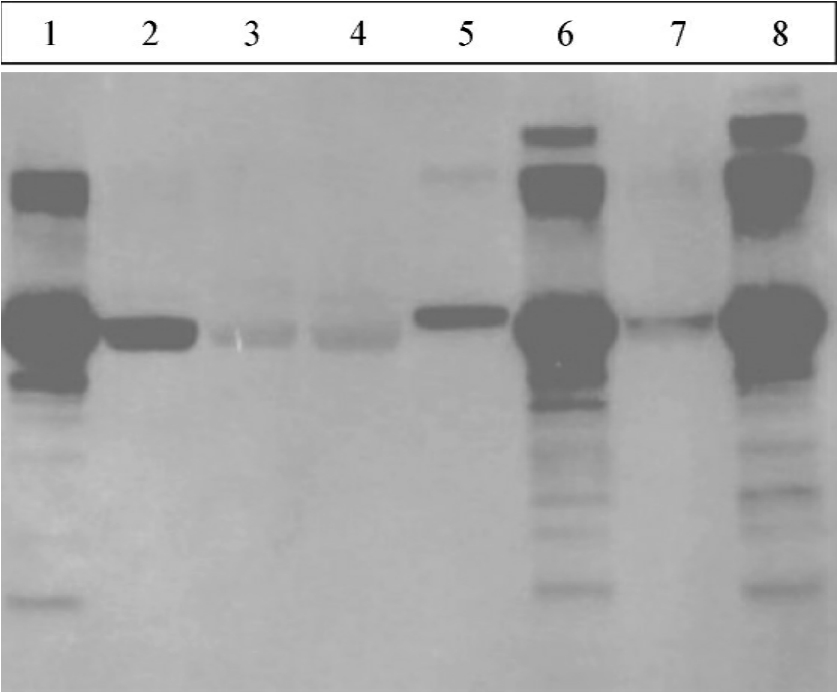
图6-5 Western blot检测不同动物血清中某蛋白的表达情况(化学发光法检测)
注:5为Invitrogen公司购买的相对分子质量标记物,余为各不同动物的血清样品,结果显示某蛋白表达在不同物种中有差异
特异性一抗在封闭液中先与已转有靶蛋白的膜一同温育,形成抗原-抗体复合物。
5.第二抗体与一抗的结合 第二抗体,简称二抗。是抗一抗种属IgG的抗体,可用酶(辣根过氧化物酶或碱性磷酸酶)、生物素、放射性等标记,经与膜一起温育后,形成抗原-第一抗体-第二抗体复合物。于是,经标记的二抗就被固定在固相膜上被检测蛋白所在的位置,再根据标记物的不同,选择不同的检测方法,即可显示出靶蛋白在膜上所处的位置。
6.显色反应或放射自显影 通过酶显色、化学发光、放射自显影等方法确定靶蛋白在膜上的位置。将结果拍照或扫描以记录。图6-5所示为Western印迹分析经化学发光检测的实验结果。
五、蛋白质芯片
蛋白质芯片(protein chips),又称为蛋白质微阵列。它是在一种固相支持物表面按照预先设计的方法固定大量的探针蛋白,形成高密度排列的探针蛋白点阵。一个蛋白质芯片可以容纳一个蛋白质家族所有成员或一种蛋白质的所有变异体。实验时,将带有特殊标记(如荧光染料标记)的待测蛋白质样品与该芯片进行孵育反应,探针可以捕获样品中的待测蛋白质并与之结合,然后通过检测器对标记物进行检测,计算机分析计算出待测样品的结果。在此基础上,可发展到对各种蛋白质、抗体及配体的检测,从而可以高效地大规模获取生物体中蛋白质的信息。可以用来研究蛋白质的亚细胞定位、蛋白质与蛋白质之间的相互作用,以及对蛋白质的功能进行生物化学分析,将会对蛋白质组研究及医学生物学的发展有很大的推动作用。
蛋白质芯片根据制作方法和应用的不同分为两种:①是将能够识别复杂生物溶液(如细胞裂解液)中靶蛋白的高度特异性配体进行点阵,最普遍的形式是抗体或抗体模拟物芯片。在这种芯片里,能结合具体抗原的抗体(或模拟物)高密度地排列在芯片上,裂解液经过芯片并与其作用后,将芯片洗涤,采集芯片上的信息,通常是通过标记了的裂解液或者是能识别感兴趣的抗原的二抗来进行监测。②是将许多蛋白质,甚至是细胞中的整个蛋白质组点样在芯片上每一个确定的点,主要应用于高度平行检测天然蛋白质活性。例如,假定你想了解所有与蛋白质X相关的蛋白,那么就可以将蛋白质X用荧光标记,再与蛋白质功能芯片共孵育。“发亮”的斑点即可以认为是蛋白质X结合于该点的蛋白上,两种蛋白可能存在相关性。
蛋白质芯片技术是一种高通量、微型化及自动化的蛋白质分析技术,将成为生物化学和分子生物学研究中强有力的分析工具。相对于DNA芯片研究的进展速度,蛋白质芯片的研究进展显得相对滞后。主要有以下问题亟待解决:①寻找材料表面的修饰方法;②简化样品制备和标记操作;③增加信号检测的灵敏度,如低拷贝蛋白质的检测和难溶蛋白质的检测;④高度集成化样品的制备及检测仪器的研制和开发。这些问题不仅为蛋白质芯片技术增加了难度,同时也是蛋白质芯片能否从实验室推向临床应用的关键所在。
六、蛋白质组学分析技术
随着人类基因组序列草图的完成,基因功能的研究成为生命科学的研究重点。蛋白质作为基因功能的执行者,成为目前研究的热点,蛋白质组学(proteomics)由此产生。蛋白质组学的研究对象是蛋白质组(proteome),即一种细胞或一种组织所表达的全部蛋白质,其研究的主要技术路线为复杂蛋白质混合物的分离、分离后多肽的质谱(mass spectrometry,MS)鉴定和蛋白质组数据库的查询,其中蛋白质分离是蛋白质组研究的核心技术。下面介绍几种蛋白质组学研究的技术路线。
1.2-DGE-MS(双向凝胶电泳-质谱法)分析系统 蛋白质组研究主要包括样品或组织中的蛋白质分离和分离蛋白质的鉴定两个关键步骤。该法的主要技术是2-DGE、质谱分析和生物信息学技术。
蛋白质组学研究中常用的2-DGE,第一向为IEF-PAGE,是基于等电点不同将蛋白质分离,第二向为SDS-PAGE,是基于相对分子质量不同而将蛋白质分离。作为一种经典的蛋白质分离手段,2-DGE可以较快地获取样本整个蛋白质组变化的宏观信息,同时也可以借助后续的方法进行微观分析,并且该方法有很好的分离能力,分辨率较高,还具有高通量的优势。但2-DGE尚存在一些问题:①疏水性蛋白、低丰度蛋白、极酸和极碱性蛋白难于检测;②分辨率和可重复性还不能完全满足当前需要,有待进一步提高;③蛋白质分离的规模化和自动化水平有待提高。
2-DGE完成后,找出需要的靶蛋白点,从凝胶中回收目的蛋白点,继续质谱分析。质谱分析主要通过对多肽、蛋白质的质量测定、肽质量指纹图谱测定及氨基酸序列测定来完成2-DGE分离的蛋白质点的鉴定。
质谱分析得到的结果需要通过生物信息学技术来分析、获取有用的信息。生物信息学是生物与计算机科学以及应用数学学科相互交叉而形成的一门新兴学科。它通过对生物学实验数据的获取、加工、存储、检索与分析,达到解释数据所蕴含的生物学意义的目的。
2.LC-MS(液相色谱法-质谱法)联用系统 液相色谱是另一种广泛应用于蛋白质组研究中的分离技术。它与质谱结合,并与电离喷雾质谱(ESI-MS)或电离喷雾串联质谱(ESI-MS/MS)联用,借助计算机的联机检索,实现了高通量筛选和鉴定蛋白质混合体系的要求。色谱分析法与2-DGE相比,具有操作过程简单、分析速度快、分离效果好、灵敏度高等优点,尤其将分离物直接与质谱连接,实现了分离和鉴定一次完成。目前,蛋白质组研究中高效液相色谱与质谱联用的方式有一维色谱-质谱联用技术、多维色谱-质谱联用技术以及亲和色谱-质谱联用技术等。
3.蛋白质芯片-质谱联用系统 蛋白质芯片在蛋白质组研究中的作用主要是研究差异显示蛋白质和蛋白质间的相互作用。使用时,先将需要的样本按一定的程序做好前处理,然后在每个芯池内点入检测的样品,利用特定的探针和特定蛋白质结合的特性,将样品中的特定蛋白质分离出来,然后对芯片上的蛋白质直接进行质谱检测,从中得到样品中特定蛋白质的相对分子质量、含量、等电点、糖基化和磷酸化位点等信息。
七、其他检测方法
对于蛋白质的检测,除了如上介绍的方法外,还可以从多个方面着手考虑其他检测方法,如相对分子质量、等电点、氨基酸排列顺序、蛋白质的结构、生物学活性等,相应的检测方法本章就不多做介绍了。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















