实验二 Folin酚法(Lowry法)测定蛋白质的含量
【实验目的】
1.掌握Lowry法测定蛋白质含量的原理。
2.了解Lowry法的优缺点和适用范围。
【实验原理】
在强碱性溶液中,双缩脲(NH2-CO-NH-CO-NH2)与CuSO4生成紫色络合物,称为双缩脲反应。凡具有酰胺基或两个直接连接的肽键的物质都有双缩脲反应,因此蛋白质在碱性环境下也能与铜离子发生双缩脲反应。
Folin酚甲试剂由碳酸钠、氢氧化钠、硫酸铜及酒石酸钾钠组成。蛋白质中的肽键在碱性条件下,与酒石酸钾钠络合铜盐溶液起作用,生成紫红色蛋白质-铜络合物。
Folin酚乙试剂是由磷钼酸和磷钨酸、硫酸、溴等组成。此试剂在pH=10的碱性条件下,易被蛋白质中酪氨酸和苯丙氨酸残基还原,呈蓝色反应(钼蓝和钨蓝的混合物),显色随时间不断加深。在一定的反应时间和蛋白浓度范围内,蛋白质的含量与蓝色深浅成正比。因此可以通过可见光分光光度计测定650 nm处的光吸收值,利用标准曲线法测定蛋白质的浓度。
Lowry法的优点:灵敏度高,最低能检测0.005 mg/ml的蛋白质,通常检测范围是0.02~0.25 mg/ml;也适用于测定酪氨酸、色氨酸的含量。
Lowry法的缺点:费时;因为显色随时间不断加深,需要精确控制操作时间,以保证每管的显色时间一致;专一性较差,干扰物质较多。干扰双缩脲反应的基团(如-CO-NH2、-CH2-NH2、-CS-NH2)以及在性质上是氨基酸或肽的缓冲剂(如Tris缓冲剂以及蔗糖、硫酸铵、巯基化合物)均可干扰Lowry反应。此外,干扰酚类呈色反应的酚类及柠檬酸也影响实验结果。浓度较低的尿素(约0.5%左右)、胍(0.5%左右)、硫酸钠(1%)、硝酸钠(1%)、三氯乙酸(0.5%)、乙醇(5%)、乙醚(5%)、丙酮(0.5%)等溶液对显色无影响。这些物质浓度高时,必须做校正曲线。若样品酸度较高,显色后色浅,则必须提高碳酸钠-氢氧化钠溶液的浓度1~2倍。
因为Folin酚乙试剂仅在酸性pH值条件下稳定,而双缩脲的还原反应只在pH=10的情况下发生,故当Folin酚乙试剂加到碱性的铜-蛋白质溶液中时,必须立即混匀,以便在磷钼酸-磷钨酸试剂被破坏之前,还原反应即能发生。由于各种蛋白质含有不同量的酪氨酸和苯丙氨酸,显色的深浅往往随不同的蛋白质而变化。因而本测定法通常只适用于测定蛋白质的相对浓度(相对于标准蛋白质)。
【实验器材】
研钵、冰盒及玻棒、50 ml离心管、冷冻离心机、50 ml量筒、试管和试管架、移液器和枪头、可见光分光光度计。
【药品试剂】
1.小白菜。
2.浓度为0.25 mg/mL的标准蛋白质溶液。
3.待测蛋白质溶液。
4.Folin酚试剂甲:每次使用前,将50份(a)与1份(b)混合,即为试剂甲。
(a)将10 g Na2CO3、2 g NaOH和0.25 g酒石酸钾钠(NAC4H4O6·4H2O)溶解于蒸馏水中,然后定容到500 ml。
(b)0.5 g硫酸铜(CuSO4·5H2O)溶解于蒸馏水中,然后定容到100 ml。
5.Folin酚试剂乙:在2 L磨口回流瓶中,加入100 g钨酸钠(Na2Wo4·2H2O),25 g钼酸钠(Na2MoO4·2H2O)及700 ml蒸馏水,再加50 ml 85%磷酸,100 ml浓盐酸,充分混合,接上回流管,以小火回流10小时,回流结束时,加入150 g硫酸锂(Li2SO4),50 ml蒸馏水及数滴液体溴,开口继续沸腾15分钟,以便驱除过量的溴。冷却后溶液呈黄色(如仍呈绿色,须再重复滴加液体溴的步骤)。稀释至1 L,过滤,滤液置于棕色试剂瓶中保存。使用时用标准NaOH滴定,酚酞作指示剂,然后适当稀释,约加水1倍,使最终的酸浓度为1 mol/L左右。
【实验方法】
1.制备总蛋白样品:称取小白菜10 g,在研钵中碾成匀浆,加水10 ml后继续碾10分钟,倒入离心管中,另加20 ml水将研钵中的剩余物洗入离心管,5000 r/min离心10分钟。取上清液10 ml定容到50 ml,此为待测蛋白质样品。
2.制备标准蛋白质浓度曲线和测定待测样品:标记试管,按表3-3依次向试管中加入各溶液,充分混匀。取玻璃比色杯,以0管作为零测定溶液在650 nm下的光吸收值。实验需要精确控制操作时间,具体操作如下:在试管中加入终体积为1 ml的标准蛋白水溶液。第1支试管加入5 ml试剂甲后,开始计时,1分钟后,第2支试管加入5 ml试剂甲,2分钟后加第3支试管,以此类推。全部试管加完试剂甲后若已超过10分钟,则第1支试管可立即加入0.5 ml试剂乙,立刻混匀;1分钟后第2支试管加入0.5 ml试剂乙,2分钟后加第3支试管,以此类推。待最后一支试管加完试剂后,30℃放置20分钟,然后开始测定650 nm光吸收。每分钟测定一个样品。
表3-3 Lowry法实验设计表
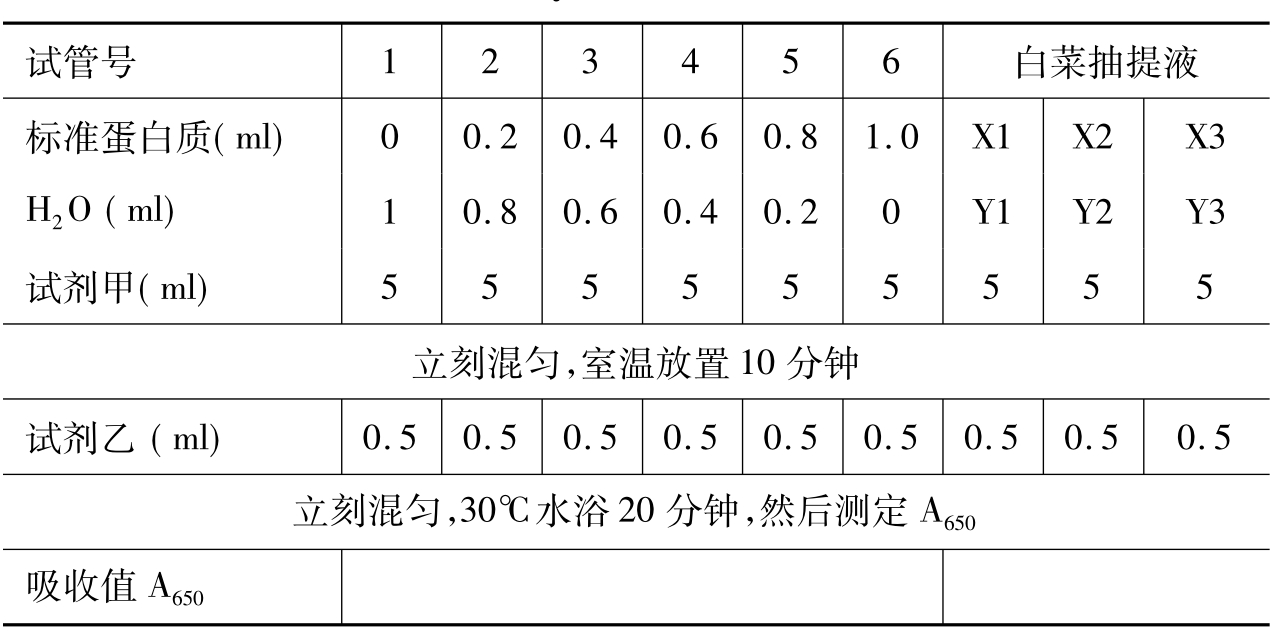
3.数据处理:以蛋白质浓度(mg/ml)为横坐标,光吸收值(A280)为纵坐标做标准曲线。从标准曲线上查出稀释后的样品浓度,乘以稀释倍数后计算样品溶液的实际浓度,求三个稀释倍数样品的平均值。
【注意事项】
1.待测样品1、2、3应为不同稀释倍数,样品量X1+水量Y1= 1 ml;
2.加入试剂甲或者试剂乙后,需立刻混匀,方能保证反应正常进行。
3.精确控制反应时间,保证每管反应时间一致。
【思考题】
1.简述Folin酚法测蛋白质含量的优缺点。
2.Folin酚法测定蛋白质含量时有哪些注意事项?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














