一般而言,蛋白质在体外的折叠过程是一个比较低效的过程,但是在生物体内,新合成的肽链从核糖体上释放出来以后总是很快就折叠形成其天然的具有生物活性的空间构象。这是因为机体合成蛋白质新生肽链的速度很快,尤其是当机体受到外界刺激时,必须以最快速度作出应答,进行自我保护,免受伤害,即使没有受到外界刺激,如果不能迅速折叠,也可能要被降解或形成无活性聚集体。为此,机体细胞中存在很多可以帮助新生肽链折叠修复肽链错误折叠的蛋白质分子,这种蛋白质分子称为分子伴侣(molecular chaperones)。
分子伴侣最初被命名为热休克蛋白(heat shock protein,HSP),目前热休克的概念已经远远超出了对热所引起的刺激,热休克应答泛指机体对各种形式的外界和生理应激作出的有序应答。分子伴侣的作用机制——GroEL-GroES复合物研究得较为清楚:首先,GroEL-ATP复合物的形成(图7-2中的①),注意GroEL的形态变化以及与GroES的结合解离;实心的球代表未完全折叠的肽链,空心的球为已折叠的肽链,此复合物的一端和一分子的GroES结合,同时水解ATP。生成的GroEL-ATPGroEL-ADP-GroES是一个稳定的复合物(图7-2中的②),这个复合物的上下两个半分子具有十分不同的性质,和GroES结合的GroEL环(处于邻近位置的)在结构上发生了很大的改变,形成一个宽的内部空穴。这空穴利用了GroES的圆顶结构部分不让溶剂进入。非折叠的蛋白质肽链可以结合在邻近和远离的两个位置上,但是只有结合在邻近位置上的非折叠蛋白质肽链,才能发生折叠的重排。然后是图7-2中的③和④的步骤,下部结合的GroES和ADP同时被释放,随后消耗另一个ATP的能量,GroES结合到上部的GroEL环,形成另一个GroEL-GroES复合物。接着,与图7-2中的②步骤一样,在另一批ATP的参与下,肽链在此复合物中进一步折叠(图7-2中的⑤、⑥)。一旦肽链折叠完成,就不能再与GroEL结合,正确构象的蛋白质与GroES、ADP一起从复合物中离去。如果肽链的构象依旧不正确,则可重复图7-2中的③~⑥步骤,直至多肽链达到正确折叠。
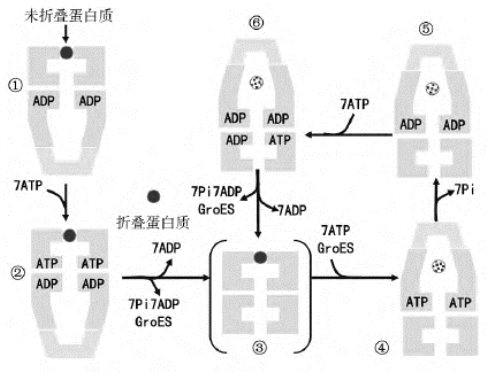
图7-2 分子伴侣GroEL/GroES在帮助新生肽链折叠过程中的作用和变化
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















