7 育苗新技术
【学习重点】
了解组培育苗、无土栽培育苗和容器育苗的优缺点;掌握组培育苗、无土栽培育苗和容器育苗技术。
育苗新技术是指在育苗方式、方法和规模上,应用先进的科学技术、现代的设施和经营理念进行园林苗木繁育,以满足城镇园林绿化市场的需求。
随着科技技术的发展,在生产实践中,组织培养育苗、无土栽培育苗和容器育苗等先进的繁殖技术可以增加园林苗木的繁育速度和提髙苗木质量,同时可以使园林植物新品种得到快速应用,为城镇园林绿化提供了充足的苗木资源。与传统的育苗技术(嫁接、扦插、压条等)相比,其特点是育苗技术科学化,育苗操作管理省力化、机械化和自动化,苗木生产标准化。
7.1 组织培养育苗
植物的组织培养是指在无菌条件下将离体的植物器官(如根、茎、叶、茎尖、花、果实等)、组织(如形成层、表皮、皮层、髓部细胞、胚乳等)、细胞(如大孢子、小孢子、体细胞等)、胚胎、原生质体等接种在人工配制的培养基上,在适宜的培养条件进行培养,诱导出愈伤组织、不定芽、不定根,最后形成完整的植株的技术。由于是在试管内培养,而且培养的是脱离植物母体的培养物,因此也称离体培养和试管培养。
7.1.1 植物组织培养概况
植物组织培养与细胞培养开始于19世纪后半叶,当时植物细胞全能性的概念还没有完全确定,但基于对自然状态下某些植物可以通过无性繁殖产生后代的观察,人们便产生了这样一种想法即能否将植物体的一部分在适当的条件下培养成一个完整的植物体,为此许多植物科学工作者开始了培养植物组织的尝试。
1839年德国植物学家施莱登(Schleiden)和德国动物学家施旺(Schwann)提出细胞学说,指出细胞是生物有机体的基本结构单位;细胞(特别是植物细胞)又是在生理上、发育上具有潜在全能性的功能单位。在此理论基础上,1902年德国植物生理学家Haberlandt提出了高等植物的器官和组织可以不断分割,直至单个细胞的观点,并指出每个细胞都具有进一步分裂、分化、发育的能力。他用组织培养方法,培养植物的叶肉细胞,试图培养出完整的植株,来证实这一观点。但由于当时实验条件等限制,未获成功。不过这一观点却吸引和指导了很多科学工作者继续进行探索和研究。
在此后的50多年中,关于植物组织培养中的器官的形成和个体发育方面的研究进展很快。1958年,英国学者Steward在美国将胡萝卜髓细胞培养成为一个完整的植株。这是人类第一次实现了人工体细胞胚,使Haberlandt的愿望得以实现,也证明了植物细胞的全能性,对以后的植物组织和细胞的培养产生了深远的影响。随后有许多科学工作者用植物的幼胚、植物的器官,通过组织培养获得了完整的植株。随着对组织培养条件的不断研究,培养技术的不断改善,以及由于植物激素种类的增加和广泛应用,使人们能更好地控制植物细胞的生长和分化,大大促进了植物组织培养技术的发展。
我国植物组织培养的研究工作开展也较早。1931年李继侗培养银杏的胚。1935~1942年罗宗洛进行了玉米根尖的离体培养。其后罗士伟进行了植物幼胚、根尖、茎尖和愈伤组织的培养。20世纪70年代以后我国开展植物花药培养单倍体育种,在园林植物方面对杉木、北美红杉、银杉、樟子松、柳杉、白皮松、欧洲赤松、油松、雪松、银杏、中山柏等进行了组织培养,其中大多数已诱导出不定芽,有些还生了根。特别是2005年的全国科学大会以来,我国植物组织培养方面进行了大量研究,取得了一系列举世瞩目的成就,不少研究成果已走在世界的前列。
进入21世纪,植物组培技术日趋成熟和完善,对组织培养中,细胞的生长、分化的规律有了新的认识,研究目的明确。同时由于近代的分子生物学、细胞遗传学等有关学科的新成就,各学科之间的相互渗透和促进,以及PCR(聚合酶链式反应)和原位杂交等新技术的迅速发展,都对植物组织培养的研究有着深刻的影响,促进了植物组培技术的发展,并开始应用于实践,取得了很大发展。
7.1.2 植物组织培养的特点与种类
7.1.2.1 植物组织培养的特点
1.植物组织培养的优点
(1)保持原有品种的优良性状,形成整齐一致的无性系。
(2)培育脱毒苗,加速发展脱毒植株,减轻园林苗圃病害的危害程度。
(3)节省土地,培养条件可以人为控制,组培苗生长周期短,繁殖率高。
(4)繁殖材料需要量少,可以扩大濒危植物的繁殖系数。
(5)管理方便,利于工厂化生产和自动化控制。
(6)保存种质资源。
2.组织培养育苗的缺点
(1)操作技术繁杂。
(2)要求有一定设备条件及试验基础,试验阶段的成本较高。
7.1.2.2 植物组织培养的分类
1.根据用做外植物体的植物材料不同来划分
(1)器官培养 以很少的植物器官(如根尖和根切段,茎尖、茎节和茎切段,叶片、叶柄、叶鞘、子叶,花瓣、花药、花丝,果实,种子等)为材料进行无菌培养形成新植株。
(2)组织培养 以分离出的植物各部位的组织(如分生组织、形成层、木质部、韧皮部、表皮层、胚乳组织、薄壁组织、髓等)或诱导出的愈伤组织为外植体材料进行无菌培养形成新植株。
(3)胚胎培养 通过对幼胚、子房等的培养使发育不完全的胚胎部分形成完整植株的过程。胚胎培养又分为胚乳培养、原胚培养、种胚培养等。胚胎培养在某种程度上可以克服远缘杂交胚的败育障碍。采用胚乳进行培养,为三倍体植物育种开辟了新的途径。
(4)细胞培养 指对单个体细胞或较小细胞团的培养。
(5)原生质体培养 指对去掉细胞壁后所获得的原生质体的离体培养。通常分为非融合培养、融合培养等类型。可进行植物体细胞杂交,形成新个体,为品种改良开辟新途径。
2.根据所用的培养基不同来划分
(1)固体培养 使用固体培养基进行组织培养。
(2)液体培养 使用液体培养基进行组织培养,又可细分为静止培养、旋转培养、震荡培养等。
7.1.2.3 植物组织培养的应用
1.快速繁殖苗木
对于不能用普通繁殖法或用普通繁殖法繁殖太慢的植物,如兰科植物和许多观叶植物,组织培养技术是实现商品化生产的最佳途径。
对于某些稀有植物或有较大经济价值的植物,由于受到地理环境和季节的限制,依靠自然条件在短时期内需要达到一定数量是很困难的,而通过组织培养的方法能够满足这一要求。
2.培育脱毒苗
有很多植物都带有病毒,严重影响植物的生长,给农业、林业等带来灾害。特别是无性繁殖植物,如康乃馨、马铃薯等,由于病毒是通过维管束传导的,因此利用这些植物营养器官繁殖,就会把病毒带到新的植物个体上而发生病害。但是感病植株并不是每个部位都带有病毒,如茎尖生长点尚未分化成维管束的部分可能不带病毒。若利用组织培养法进行茎尖培养,再生的植株有可能不带病毒,从而获得脱毒苗。
3.保存植物种质资源,挽救濒于灭绝的植物
长期以来人们想了很多方法来保存植物,如储存果实,储存种子,储存块根、块茎、种球、鳞茎;用常温、低温、变温、低氧、充惰性气体等,这些方法在一定程度上收到了好的或比较好的效果,但仍存在许多问题。主要问题是付出的代价高、占的空间大、保存时间短,而且易受环境条件的限制。植物组织培养结合超低温保存技术,可以给植物种质保存带来一次大的飞跃。因为保存一个细胞所占的空间仅为原来的几万分之一,而且在-193°液氮中可以长时间保存,不像种子那样需要年年更新或经常更新。
环境的不断变化使许多种类的植物面临灭绝的危险,而且许多种植物已经灭绝,留给人类的只是一种遗憾。实践证明,通过组织培养的方法可以使一部分濒危的植物种类得到延续和保存;如果再结合超低温保存技术,就可以使这些植物得到较为永久性的保存。
4.新品种培育
通过花药和花粉组织培养可以获得单倍体植物,然后通过染色体加倍,就培育出了纯系的植物新品种,而且使新品种的培育过程简化,大大缩短了育种时间。
在远缘杂交中,杂交后形成的胚珠往往在未成熟状态时,就停止生长,不能形成有生活力的种子,因而杂交不孕,这给远缘杂交造成极大困难。利用组织培养技术进行胚胎培养,可以把多数植物的成熟或未成熟胚培养完整植株,克服了远缘杂交不亲和的障碍。
通过胚乳培养可获得三倍体植株,为诱导形成三倍体植物开辟了一条新途径。三倍体加倍后得到六倍体,可育成多倍体品种,其中植物组织培养技术是不可缺少的。
通过原生质体融合,可部分克服有性杂交不亲和性,而获得体细胞杂种,从而创造新种或育成优良品种。
5.植物产品的工厂化生产
植物细胞在代谢过程中,能够产生一些有机化合物,如人参皂甙(人参)、奎宁(金鸡纳)、除虫菊酯(除虫菊)、茉莉花油(茉莉)、番红素(番红花)等,它们可以用做药物、杀虫剂、香料、色素等。以前,人们都是利用植物体来提取或合成这些有机化合物的。20世纪50年代,生物学家发现,植物细胞在液体培养基上的分裂速度,比在固体培养基上的要快得多。经过30多年的努力,人们终于能够大规模培养植物细胞,并从中提取所需的物质了。
总之,现在的植物组织培养仍然处于发展阶段,远远没有达到它的高峰期,很多机理人们还没有搞清楚,它的潜力还远远没有发挥出来。相信在今后的几十年内,组织培养将会有更大的发展,在农业、林业、制药业、加工业等方面将会发挥更大的作用,创造出更大的经济效益。
7.1.3 组织培养的基本条件
7.1.3.1 生产设施
1.实验室
(1)化学实验室 植物组织培养时所需器具的洗涤、干燥、保存;药品的称量、溶解、配制;培养基的配制和分装;高压灭菌;植物材料的预处理以及生理生化分析等各种操作,都在化学实验室进行。其要求与一般化学实验室要求相同。
(2)接种室(无菌室) 进行各种无菌操作的工作室,用以植物材料的分离、接种、培养物的转移等。要求室内光滑平整,地面平坦无缝,避免灰尘积累,便于清洗和消毒。室内应定期用甲醛或高锰酸钾熏蒸消毒灭菌,也可以用紫外灯照射20min以上。室内设有超净工作台或接种箱,用于无菌接种。
(3)培养室 为人工条件下培养接种物及试管苗的场所。要求室内整洁,有控温和照明设备。室内温度要求恒温,均匀一致,有自动调节温度的设备,一般要求温度为25~27℃,或依所培养的植物而定。光源以白色荧光灯为好,还应有培养架等装置。
(4)洗涤室 如果工作内容少,洗涤的器皿不多,可在化学实验室进行。若育苗量大,需要一间装有水槽的洗涤室用于清洗各种用具。地面要耐湿并能排水。灭菌锅、蒸馏水器、干燥箱等可从化学实验室移入洗涤室,以便操作。
除以上必备实验室外,有条件的还可设观察室、贮存室、细胞学实验室及摄影室。
2.主要仪器设备及器材
(1)天平 感量0.1~0.01g天平,用于称量大量元素、琼脂和蔗糖等;感量0.001~0.0001g天平用于称量植物激素、微量元素、维生素等。
(2)酸度计 配置培养基时用来测定培养基的pH值。
(3)蒸馏水器 用来制取蒸馏水。去离子水是用离子交换器制备的,但不能除去水中的有机物。
(5)烘箱 用于烘干玻璃器皿。
(6)高压灭菌锅 用于培养基、无菌水、接种器械的灭菌消毒。
(7)超净工作台 用于无菌接种。
(8)双目实体解剖镜 在解剖较小的植物体时,如茎尖生长点的剥离,用来观测材料。
(9)细菌过滤器、细菌滤膜 用来进行溶液的常温除菌。
(10)空调 通过升温及降温来保持培养室温度的相对恒定。
(11)光照培养箱 供光照培养用,多用于外植体分化培养和试管苗生长。
(12)摇床或旋转床 液体培养用,其中摇床多用于细胞悬浮液培养。
(13)增湿机和除湿机 用于改善培养室湿度。
(14)日光灯 通常在培养架每层上方配置两支功率为30W的日光灯以补充光照。
除上述大件仪器设备外,还需必备的玻璃器皿和用具有培养皿、烧杯、试管、量筒、三角瓶、刻度吸管、滴管、漏斗、洗瓶、滴瓶、酒精灯、解剖刀、解剖针、剪子、镊子、纱布、棉花、牛角匙、牛皮纸、牛皮筋、特种铅笔、电炉、pH值试纸等。
7.1.3.2 常用药品和试剂
组织培养所需药品和试剂主要用于培养基的配置,也有部分用于外植体消毒。主要有以下几类:
1.消毒药品
主要有次氯酸钠(钙)、氯化汞、过氧化氢、漂白精片、溴水、硝酸银等。
2.无机盐类
包括大量元素(C、H、O、N、P、K、Ca、Mg、S等)和微量元素(Fe、Cu、Mo、Na、Zn、Mn、B、Co等)两类。
3.有机化合物
主要有蔗糖、维生素类(维生素B1、B3、B6、生物素、叶酸等)、氨基酸(甘氨酸、丙氨酸、丝氨酸、谷氨酰胺等)、肌醇、螯合剂等。
4.植物生长调节剂
(1)生长素 主要有IAA(吲哚乙酸)、NAA(萘乙酸)、2,4-D(2,4-二氯苯氧乙酸)和IBA(吲哚丁酸)。
(2)细胞分裂素 主要有KT(激动素)、6-BA(6-苄基腺嘌呤)、ZT(玉米素)等。
(3)赤毒素 以赤霉素GA3运用最广泛。
5.有机附加物
包括人工合成和天然的有机物,常用的有酵母提取物、椰乳、果汁等及相应的植物组织提取液。此外,琼脂在组培中作为凝固剂,是外植体的支持体;活性炭、抗坏血酸、谷胱甘肽等对防止褐变有较为明显的效果。
6.水
培养基用水原则上使用蒸馏水、去离子水等。
7.1.3.3 环境条件
1.光照
初代培养和继代培养阶段光照强度为1000~3000lx,生根和小植株阶段以3000~10000lx为宜。每日光照时间12~16h,黑白交替。目前多用40W日光灯,在灯管下15~20cm左右培养,不可离得太远。
2.温度
通常培养物温度控制在25±2℃。温度过低,幼苗生长缓慢;温度高,容易发生褐变。特别在夏季高温时要注意降温。
3.气体
培养物产生的乙烯、二氧化碳、乙醇等气体会影响其生长和分化。采用能透气的封口膜为培养瓶封口,利于瓶内气体与外界交换。
4.清洁卫生
注意保持培养基室的清洁、干燥、卫生,不要与外界空气交流太多,这样可以避免培养瓶的再污染。
7.1.4 植物组织培养技术
1.玻璃器皿的洗涤
新购置的玻璃器皿都会有游离的碱性物质。使用前,先用1%的稀盐酸浸泡一夜,然后用肥皂水洗尽,清水冲洗,最后用蒸馏水冲一遍,干后备用。已用过的各种玻璃器皿尤其是分装培养基的大批三角瓶等,均应先用洗衣粉洗净后,清水冲洗干净,再放入洗液中浸24h后用清水(最好为流水)冲洗干净,再经蒸馏水冲洗2~3次,然后放入烘箱中烘干备用。
洗液的配制:一般采用重铬酸钾50g,加入蒸馏水1L,加温溶化,冷却后再缓缓注入90ml工业硫酸。
2.培养基的制备
(1)培养基成分 组织培养的培养基种类较多,但基本成分是类似的,都包括无机盐类、有机化合物、植物生长调节剂、琼脂、水等。一般可大致分为两个部分,即培养基主要成分(包括各种无机盐、有机化合物等)和附加成分(包括植物生长调节剂和有机附加物等)。几种培养基主要成分和附加成分详见表7-1和表7-2。
表7-1 几种培养基主要成分(单位:mg/L)
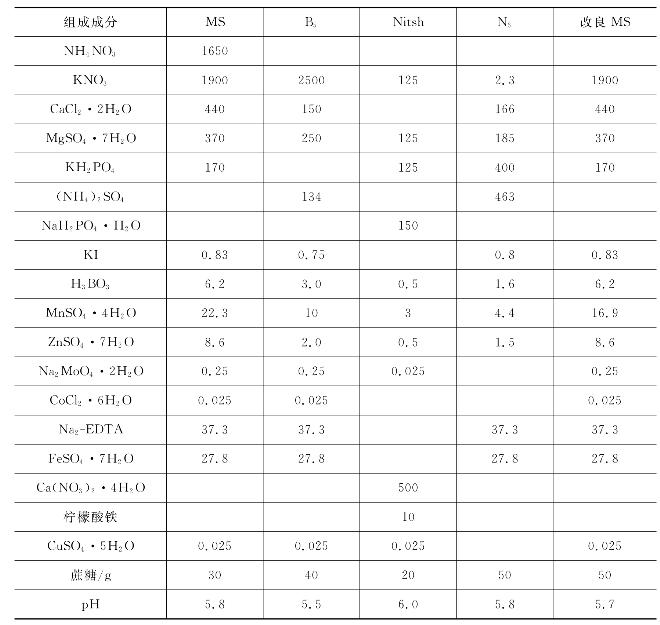
表7-2 几种培养基附加成分(单位:mg/L)
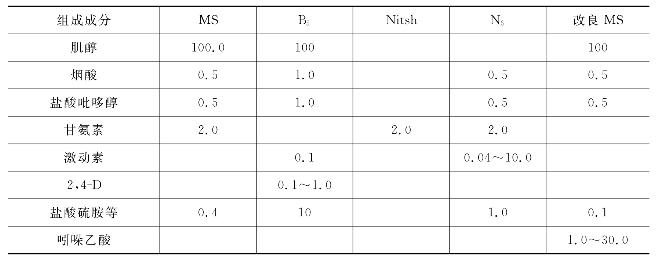
(2)培养基的配制
①母液的配制与保存:培养不同植物,需要配制不同的培养基。为了减少工作量,可先把药品配成母液(即浓缩液),再稀释10~100倍,其中大量元素倍数略低,一般为10~20倍,微量元素和有机成分及铁盐等可扩大50~100倍。
母液一般在2~4℃的冰箱内保存,但保存时间不宜过长,一般几个月左右。
②培养基的配制程序:首先根据培养基配方按需要量和顺序吸取各种母液及其他药液,混合在一起,并加入蒸馏水定容至所需体积。将蔗糖放入熔化的琼脂中溶解,然后注入混合液中,搅拌均匀后用1mol的HCl或NaOH调整pH值。配制好的培养基要趁热分注,倒入试管、三角瓶等培养器皿中,一般占容器1/4~1/3为宜,最后加塞或封口,准备灭菌。
(3)培养基的灭菌 由于培养基内有丰富的营养物质,极利细菌和真菌繁殖,造成污染,影响组培的成功,因此培养基灭菌是必不可少的一个环节。培养基灭菌一般采用高温髙压灭菌。把培养基放入高压灭菌锅中,压力为78.5~107.9kPa,温度为121℃,灭菌时间15~20min。
3.外植体的获取与消毒
(1)外植体的获取 从田间采回的准备接种用的材料称为外植体。一般常用作组织培养的材料有鳞茎、球茎、茎段、茎尖、花柄、花瓣、叶柄、叶尖、叶片等,它们的生理状态对培养时器官的分化有很大影响。一般来讲,年幼的实生苗比年龄老的成年树容易分化,顶芽比腋芽容易分化,萌动的芽比休眠的芽容易分化。此外可以用未成熟的种子、子房、胚珠及成熟的种子为材料。
(2)外植体的消毒 将接种材料用自来水冲洗干净,擦干,然后在超净台上或接种箱内将接种材料浸在饱和漂白粉溶液里进行表面灭菌15~30min,也可用2%的次氯酸钠浸15~30min进行灭菌,还可用0.1%的升汞溶液加适量吐温,进行表面灭菌8~2min。灭菌时间快到时倒去灭菌溶液,用无菌水刷洗多次,然后用无菌纱布吸干接种材料外部的水分。
4.接种
接种是组织培养过程中易于污染的一个环节,操作过程必须在无菌条件下进行。
(1)接种前的准备工作
①每次接种前,应提前30min打开接种室和超净工作台上的紫外线灯进行消毒,然后打开超净工作台的风机,吹风10min。
②操作人员进入接种室前,用肥皂把手洗干净,换上经过消毒的工作服和拖鞋,并戴上工作帽和口罩。
③开始接种前,用70%的酒精棉球仔细擦拭手和超净工作台面。
④准备一个灭过菌的培养皿或不锈钢盘,内放经过高温消毒的滤纸片。解剖刀、医用剪刀、镊子、解剖针等用具应预先浸在95%的酒精溶液内,置于超净工作台的右侧。每个台位至少备2把解剖刀和2把镊子,轮流使用。
⑤接种前先点燃酒精灯,然后将解剖刀、镊子、剪子等在火焰上方灼烧后,晾干备用。
(2)接种技术
①用镊子将植物材料夹到已高压消毒、盛有滤纸的培养皿中,在超净工作台上将外植物体切成3~5mm的小段;在双筒解剖镜下剥离的茎尖分生组织大小约为0.2~0.3mm;经过热处理的材料可带2~4个叶原基,切生长点长约0.5mm。
②将培养瓶倾斜拿住,打开瓶塞前,先在酒精灯火焰上方烤一下瓶口,然后打开瓶塞,并尽快将外植体接种到培养基上。注意,材料一定要嵌入培养基,而不是放在培养基上面或全部埋入培养基内。将瓶塞在火焰上旋转灼烧数秒钟,塞回瓶口,包好包头纸,做好标记即可。
③每切一次材料,解剖刀、镊子等都要放回酒精内浸泡,再灼烧。
5.培养
(1)初代培养 也称诱导培养。培养基由于植物种类的不同而不同,通常是MS基本培养基加入适量的植物生长调节剂及其他成分。首先在一定温度(22~28℃)下进行暗培养,待长出愈伤组织后转入光培养。此阶段主要诱导芽体解除休眠,恢复生长。
(2)继代培养 也称增殖培养。将见光变绿的芽体组织从诱导培养基转接到芽丛培养基上,在每天光照12~16h、光照强度1000~3000lx条件下培养,不久即产生绿色丛生芽。将芽丛切割分离,进行继代培养,扩大繁殖,平均每月增殖一代,每代增殖5~10倍。为了防止变异或突变,通常只继代培养10~12次。根据需要,一部分进行生根培养,一部分仍继代培养。
(3)生根培养 培养基通常为1/2MS培养基加入适量的植物生长调节剂,如1/2MS+NAA(或IBA)0.1mg/L。切取增殖培养瓶中的无根苗,接种到生根培养基上进行诱根培养。有些易生根的植物在继代培养中通常会产生不定根,可以直接将生根苗移出进行驯化培养。或者将未生根的试管苗长到3~4cm长时切下来,直接栽到蛭石为基质苗床中进行瓶外生根,效果也非常好,省时省工,降低成本。这个阶段可筛选淘汰生长不良和感病的试管苗。
(4)炼苗与移栽 组培苗一般长至高5~80cm,有3~5条根后即可移栽出培养瓶。移出前要加强培养室的光照强度和延长光照时间,进行光照锻炼,一般进行7~10d。然后将瓶盖全部打开或打开一半,让试管苗暴露在空气中锻炼1~2d,以适应外界环境。但打开的时间不要太久,以免引起培养基发霉。从培养瓶中取出的幼苗要用水轻轻将附着在根上的琼脂洗掉,然后移栽到基质中。
组培苗对基质的要求较髙,基质必须严格消毒。基质一般以黄心土、碧糠灰、炭化稻壳、河沙、泥炭、珍珠岩或蛭石等为材料。根据不同的园林苗木材料运用以上不同的基质材料进行配比,制成无菌的基质。
移栽组培苗必须特别小心,因为组培苗十分脆弱,很容易受伤。使组培苗根系处于伸展状态。浇透水后,用塑料薄膜覆盖,保持空气的相对湿度在90%以上,温度在25℃左右(±2℃),勿使阳光直晒。一星期后,注意逐渐通气及浇灌适量的水,幼苗即能成活。试管苗成活后,再移至苗圃的幼苗池中进行培养,待壮苗后移至大田栽培。
7.2 无土栽培育苗
无土栽培育苗是指不用天然土壤,而利用蛭石、泥炭、珍珠岩、岩棉等天然或人工合成材料作基质和营养液进行的育苗,或者利用水培及雾培进行育苗的方法,有时也称营养液育苗。
7.2.1 无土栽培的概况
早在几个世纪以前,不论国内或国外都有用水来培养和研究植物的记载,但是这种方法只是一种原始的、不完全的无土栽培形式。到20世纪40年代,无土栽培才被作为一种新的栽培形式,开始大面积地用于农业生产。20世纪50年代后,这种技术在世界许多国家得到了应用,如意大利、荷兰、联邦德国、瑞典、丹麦、西班牙、苏联、美国、日本、印度、斯里兰卡、科威特等国家都先后建立了无土栽培基地和水培场。目前,无土栽培的面积不断扩大,在新西兰,50%的番茄靠无土栽培生产;在意大利的园艺生产中,无土栽培占有20%的比重;在日本,无土栽培生产的草莓占总产量的66%、青椒占52%、黄瓜占37%、番茄占27%、总面积已达2000hm2。荷兰是无土栽培面积最大的国家,2000年统计已超过1万hm2。目前无土栽培技术已在全世界100多个国家应用发展。
我国无土栽培技术在研究应用起步较晚,而较原始的无土栽培技术却有悠久历史。我国的无土栽培在生产上的应用始于1941年,当时上海一个华侨农场进行了营养液栽培,由于生产成本太高而只得放弃。后来很长一段时间我国没有商业性的无土栽培。20世纪70年代后期,山东农业大学首先开始无土栽培生产试验,并取得了成功;80年代,进口的温室及无土栽培设施相继投产,主要应用在蔬菜生产中。近几十年来,我的无土栽培发展异常迅猛。1985年全国无土栽培的面积只有0.7hm2,2002年发展到865hm2。目前我国无土栽培绝大部分用于蔬菜生产和花卉生产,无土栽培的发展为我国园林、花卉、园艺、农业、林业等生产实现工厂化、自动化和清洁卫生开辟了广阔的前景。
7.2.2 无土栽培育苗的特点与种类
7.2.2.1 无土栽培育苗的特点
1.无土栽培育苗的优点
(1)产量高、品质好、商品率高。
(2)省水、省肥。
(3)无毒、无臭、无菌,清洁卫生,不污染周围环境。
(4)节省劳力,降低劳动强度。
(5)病虫害少,无连作障碍,生产过程可实现无公害化。
(6)充分利用土地资源,不受场地和空间限制。
2.无土栽培育苗的缺点
尽管无土栽培具有上述的优点,但无土栽培的应用还受到一定条件的限制,它本身也具有一些缺点。
(1)最初一次性投资大,耗能较多,生产苗木成本较高。
(2)生产管理过程较为复杂,技术要求较高。
(3)如果管理不当,易造成某些病害的大范围传播。
7.2.2.2 无土栽培育苗的分类
1.根据是否使用固体基质来划分
(1)无固体基质栽培 指作物根系不用固体基质固定,根系直接与营养液接触。按照根系与营养液接触的状态不同,无固体基质栽培又可分为水培和喷雾栽培两种类型。
①水培:将营养液以液体状态接触根系。水培方法有营养液膜法(NFT)、深液流法(DFT)、动态浮板法、浮板毛管法等。
②喷雾:喷雾又称气培,将营养液用喷雾状态接触根系。
(2)固体基质栽培 用固体基质固定根系,使作物根系通过基质吸收营养液和氧。固体基质栽培的类型和方法繁多,大体上可分为有机固体基质和无机固体基质两类。目前,世界各国大多采用无机固体基质。
①有机固体基质:采用草炭、锯末、树皮、稻草和稻壳等物质作基质。这些基质或来自有机物,或本身就是有机物。在各种有机基质中,以草炭的应用最广,其次是锯末。这些有机物在使用前要进行发酵处理。
②无机固体基质:采用岩棉、蛭石、砾石、砂、陶粒、珍珠岩、聚乙烯和尿醛泡沫塑料等无机物质作基质。在各种无机基质中,以岩棉使用最多。
2.根据营养液利用情况来划分
(1)开路系统式 营养液不能循环利用。最好选用阳离子代换量高的有机基质,以减少营养液中的矿质流失。
(2)闭路系统式 营养液可流回贮液池,能循环利用。
7.2.3 无土栽培育苗的基本条件
7.2.3.1 生产设施
1.生产设备
(1)容器 育苗钵、育苗板、育苗箱、塑料盆、陶瓷盆、水族箱等。
(2)育苗床 主要的作用是培养幼苗。常用的育苗床有:
①简易式育苗床:主要用于小规模的无土栽培。将塑料盆装上无土栽培基质,并置于临时性的床体中。
②现代化育苗床:建立在保护地中,其空气湿度、环境温度等周边环境状况由计算机控制。
(3)栽培床 用于种苗定植到成品出圃阶段。常用的栽培床有:
①水泥床:一般床宽20~30cm,深12~20cm,长1~10cm,通常涂以沥青或其他材料防止渗水。为了使营养液能够很好地循环,在建造时应保持1/200~1/100的坡度。
②塑料床:由塑料制成的专用无土栽培槽,通常宽60~80cm,深15~20cm,长150~200cm。
2.供液系统
(1)人工浇灌 主要是人工用喷壶等器具将配置好的营养液对所栽培的植物逐株浇灌,此法对小规模的无土栽培十分实用。
(2)滴灌系统 这是一个开路系统,它通过一个高于栽培床1m以上的营养液槽,在重力的作用下,将营养液输送到30~40m远的地方。通常每1000m2栽培面积可用一个容积为2.5m3营养液槽来供液。营养液先要经过过滤器,再进入直径为35~40mm的管道,然后通过直径为20mm的细管道进入栽培植物附近,最后通过发丝滴管将营养液滴到植物根系周围。
这种供液系统通常会因为管道堵塞造成植株缺液,因此在配制营养液时必须考虑在使用过程中是否有沉淀析出,并需对营养液进行严格过滤。当堵塞发生时,可用磷酸清洗发丝滴管等部位。该供液系统用于袋栽的效果很好。
(3)喷雾系统 它是一个闭路系统,将营养液以雾状保持一定的间隔喷洒在植物的根系上,适于很多植物的栽培。
(4)液膜系统 这是一个闭路系统。其装置一般由栽培床、贮液罐、电泵与管道等组成。在操作时,先将稀释好的营养液用水泵抽到高处,然后使其在栽培床上由较高一端向较低一端流动。一般栽培床每隔10m要设置一个倾斜度为1%~2%的回液管,使营养液回流到设置在地下的营养液槽中。通常1000m2栽培面积可安装一个4~5m3的营养液槽。营养液膜系统主要采用间歇供液法,通常每小时供液10~20min。
7.2.3.2 基质
1.基质应具备的特点
(1)理化性质稳定,且具有良好的通气、保水和排水性能。
(2)能支撑植物直立生长。
(3)具有保温、调温作用。
(4)有一定强度,能长期使用。
2.常用基质
一般常用基质主要蛭石、珍珠岩、鹅卵石、石砾、岩棉、泥炭、陶粒、炉渣、沙、稻壳等。
3.混合基质
无土栽培也常使用混合基质。混合基质容量低,孔隙度较大,通常是2~3种基质相混合。如:泥炭∶蛭石=1∶1;泥炭∶河沙=3∶1;泥炭∶锯末=1∶1;泥炭∶蛭石∶锯末=1∶1∶1;泥炭∶蛭石∶珍珠岩=1∶1∶1;泥炭∶蛭石∶河沙=2∶1∶1;泥炭∶珍珠岩∶河沙=2∶2∶1;炉渣∶泥炭=6∶4等,均在我国无土栽培生产商获得了较好的应用效果。
育苗和盆栽基质混合时,常加入一些矿质养分,如:
(1)康乃馨混合基质 0.5m3粉碎泥炭,0.5m3蛭石或珍珠岩,3kg石灰石(最好是白云石),1.2kg过磷酸钙(20%五氧化二磷),3kg复合肥(氮、磷、钾含量分别为5%、10%、5%)。
(2)中国农业科学院蔬菜花卉研究所无土栽培盆栽基质 0.75m3泥炭,0.13m3蛭石,0.12m3珍珠岩,3kg石灰石,1kg过磷酸钙(20%五氧化二磷),1.5kg复合肥(15∶15∶15),10kg消毒干鸡粪。
4.栽培基质处理
无土栽培基质使用一个阶段后,会吸附较多的盐类和其他物质,必须经适当的处理才能继续使用。
(1)清洗盐分 用清水冲洗基质,监控处理液的电导率确定清洗效果。
(2)消灭病菌 可采用高温灭菌,即将高压水蒸气通入微潮的基质中,或将基质装入黑色塑料袋置于日光下暴晒,适时翻动。也可采用药剂灭菌法,即每立方米基质均匀喷洒甲醛50~100ml,覆膜2~3d后,打开薄膜,摊开基质,使剩余甲醛散发到空气中。
(3)离子导入 定期给基质浇灌高浓度的营养液。
(4)氧化处理 如沙、砾石等在使用一段时间后表面变黑,这是由于环境中缺氧而生成了硫化物的结果。可将基质置于空气中,游离氧与硫化物反应,从而使基质恢复原色。也可用不会对环境造成污染的过氧化氢来进行处理。
7.2.3.3 营养液
1.营养液的基本要求
营养盐溶于水即成为营养液。营养液中包含植物生长所必需的元素,如N、P、K、S、Ca、Mg、Fe、Mn、Cu、B、Zn、Mo等。营养液的浓度对植物生长来说是非常重要的,一般营养液的浓度为0.5/1000~5/1000,但个别植物能忍受较髙的浓度。苗木的发育阶段不同,使用浓度不同,幼苗期浓度宜低,成苗期可逐渐增高。
在无土栽培的过程中,植物根系不断向营养液分泌有机酸等物质,故要经常调节营养液的pH值,通常用磷酸、碳酸钾调节,保持营养液的pH值为5.5~6.5。根据植物种类调节,每周测试一次。营养液的温度控制在8~30℃。同时注意保持营养液中溶解氧的含量,以利于根系的生理活动。
2.配置营养液的原料
(1)水 水是营养盐的溶剂,水的性质与无土栽培有紧密的关系。水源有很多,有雨水、井水、泉水、自来水、河水、海水等。它们的性质有很大差异,其中主要是含盐量的不同,有“硬水”及“软水”之分。“硬水”的硬度较大,即含盐量较大,会影响营养液的浓度,水的硬度(营养盐)超过毎升100mg就不可作为无土栽培用水,要进行软化处理后方可使用。水的软化处理可以使用硫酸。10ml浓硫酸可使每立方米的硬水降低1度(1度为10mg)。也可使用草酸来处理,要使水的硬度降低1度,每立方米要用22.5g的工业草酸。
(2)化合物 常见的有硝酸钾、硝酸铵、硝酸钙、磷酸二氢钾、磷酸二氢铵、硫酸钾、硫酸镁、硫酸铜、硫酸锌、硫酸锰、硼砂、络合铁等。
(3)络合剂(螯合剂) 常见的有EDTA、DTPA、CDTA等,常用于配置铁盐。
3.常用营养液配方
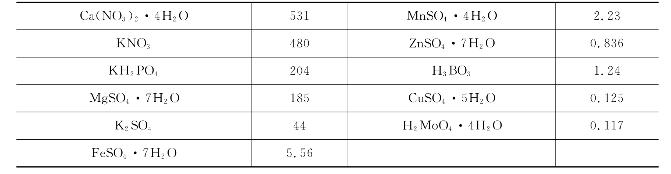
几种常见营养液的配方见表7-3、表7-4、表7-5、表7-6、表7-7,以供参考。
表7-3 希勒尔(Hiller)营养液配方(单位:mg/L)
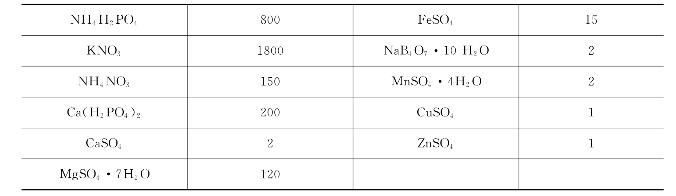
表7-4 特鲁法特与汉普营养液配方(单位:mg/L)
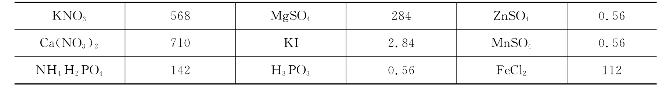
表7-5 观叶花卉营养液配方(单位:mg/L)
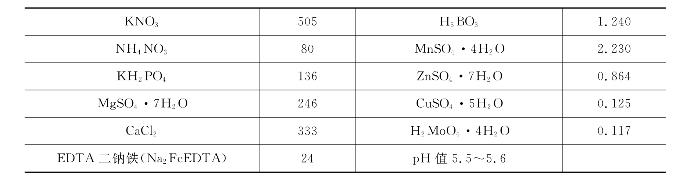
表7-6 兰花常用的营养液配方(单位:mg/L)
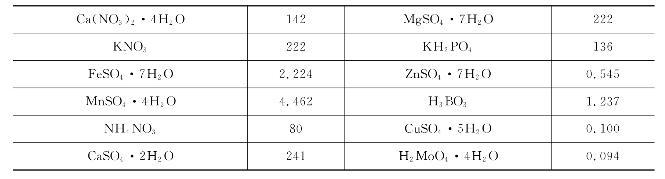
表7-7 非洲菊营养液配方(单位:mg/L)
7.2.4 无土栽培育苗技术
7.2.4.1 营养液制备
配置、贮存和使用营养液时特别注意不能产生难溶的沉淀。营养液的配置一般包括浓缩贮备液(母液)配置和工作营养液配置两部分。生产上一般用母液稀释工作营养液。
1.母液的配制
把配方中不会产生沉淀的化合物放在一起溶解,通常分为三部分,分别称为A母液、B母液、C母液。A母液一般包括Ca(N03)2、KNO3(100~200倍)。B母液一般包括NH4H2PO4、MgSO4(100~200倍)。C母液包括铁元素和微量元素(1000~3000倍)。
根据要配置的母液量和浓缩倍数计算出配方中各成分用量,准确称取A、B母液中的各成分,分别在各自的贮存容器中依次充分溶解后加水至所需体积,搅拌均匀即可。配置C母液时,先称取FeSO4·7H2O的溶液缓慢倒入溶有EDTA-Na2的溶液中制成(络合)铁盐溶液;再称取C母液所需的其他微量元素化合物,分别溶解后缓慢加入铁盐溶液中,并加水至所需体积,搅拌均匀。
2.工作营养液的配置
在贮存池内放入约需配体积1/2~2/3的清水,量取所需A母液的用量倒入并搅匀,再量取B母液的用量,开启水阀,随清水加入贮液池,搅匀。最后量取C母液。C母液的加入方法同B母液。定容并调整pH值。
7.2.4.2 营养液的控制与补充
由于植物不断吸收营养液中的水分及营养物质,因此必须对消耗的水分及营养物质进行补充。在营养液盆或容器内做一个标记,可以把营养液的最髙水位及最低水位表示出来,水的高度应介于两个标记之间,若营养液使用较长,可以完全更新该营养液;若营养液使用较短,水和营养液可交替补充。夏季每周补充一次营养液,冬季每两周补充一次,4周完全更新一次。水的消耗是经常的,而营养盐相对消耗时间较长。当测出营养物质含量不缺少时,只需补充水。如果营养物质含量很低,则需对营养液进行完全更新。夏天8个星期、冬天12个星期就应全部更换营养液。
营养液浓度的调节应注意以下问题:
(1)植物生长表现正常的情况下,当营养液量减少时,只加水而不补充营养液。
(2)在向贮液槽和大面积的无土基质补充营养液时,要多部位注入,注液点之间的距离不超过3m。
(3)生长迅速的一、二年生草花、宿根花卉、球根花卉,在生长高峰阶段均可使用原液,以后可酌情使用1∶1或其他比例的稀释液。
7.2.4.3 营养液的增氧措施
增氧措施主要是利用机械和物理的方法来增加营养液与空气的接触机会,增加氧气在营养液中的扩散能力,从而提高营养液中氧气的含量。常用的加氧方法有落差、喷雾、搅拌、压缩空气4种。
夏天将营养液池建在地下,通过降低营养液的温度增加溶氧量,也可通过降低营养液的浓度来增加溶氧量。
7.2.4.4 无土栽培方式
1.水培
(1)营养液膜技术(NFT) 营养液膜栽培的基本装置包括供液池、供液管道、供液水泵和栽培床,如图7-1所示。供液池用于贮存和循环回流的营养液,一般设在地下,可用砖头、水泥砌成,里外涂以防水物质,也可用塑料制品、水缸等容器。其容积大小应根据供应的面积和栽植株数确定。栽培床用以种植作物,是在1/100坡降的平整地面铺一层黑色或黑白双面聚乙烯薄膜,以适当方式使其成槽状供定植与固定作物根系,并供应营养液,营养液在床面呈薄层(0.5~1.0cm厚)循环液流。供液装置由供应水泵(小型潜水泵或离心泵)和供液管道〔自来水管或塑料管)将经水泵提取的营养液分流输入各栽培床中。回水管是用于栽培床循环后回流的营养液再退回贮液池中,以供再次使用,一般用塑料管。控制系统主要控制营养液的供应时间流量、电导度、pH值和液温等。
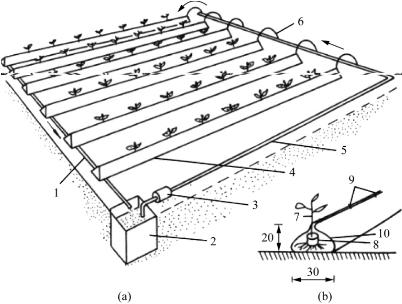
图7-1 营养液膜设施组成示意图
(a)全系统示意图 (b)大株型植株适用的种植槽
1.回流管道 2.贮液池 3.水泵 4.种植槽 5.供液主管
6.供液毛管 7.带有培育钵的幼苗 8.育苗钵 9.夹子 10.塑料薄膜
(2)深液流技术(DFT) 深液流水培与营养液膜栽培差不多,不同之处是流动的营养液较深(5~10cm),植物大部分根系浸泡在营养液中,其根系的通气靠向营养液中加氧来解决。这种系统的主要优点是解决了在停电期间营养液膜栽培系统不能正常运转的困难。该系统的基本设施由种植槽、定植网或定植板、贮液池、水泵、营养液循环系统等部分组成。
2.喷雾培(气培)
将营养液用喷雾的方式,直接喷在植物的根系上。喷雾培的栽培床可用硬质塑料板、泡沫塑料板、木板或水泥混凝土等制成,形状多种多样,如图7-2、图7-3、图7-4所示。根系在容器中的内部空间悬浮,植株固定在塑料板上。栽培床要求能够盛装营养液,并能够将喷雾后的营养液回流到营养液池中。栽培床的形状和大小要考虑植株的根系伸入到床内之后,安装在床内的喷头要有充分的空间将营养液均匀喷射到各株的根系上。
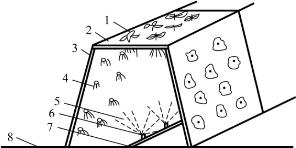
图7-2 梯形喷雾培种植槽示意图
1.植株 2、3.泡沫塑料板 4.根系 5.雾状营养液 6.喷头 7.供液管 8.地面
图7-2为梯形、图7-3为A形栽培床,床的底部可用混凝土制成深约10cm左右的槽,用于盛接多余的营养液。而在槽的上部可用铁条做成梯形或A形的框架,然后将已开了定植孔的泡沫塑料定植杯放置在这个框架上方,即可定植作物了。
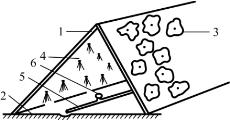
图7-3 A形喷雾培种植槽示意图
1.泡沫塑板 2.塑料薄膜 3.植株地上部分 4.根系 5.供液管 6.喷头
图7-4的种植槽与深液流水培的类似,但槽的深度要比深液流水培深,可达25~40cm。在槽的上部放置泡沫定植板,栽培作物时营养液从槽的近上部安装的管道上的喷头中喷出,而槽底可盛装2~3cm深的营养液层(即半喷雾培),也可以不保留此营养液层,让多余的营养液随时流回到贮液池中。
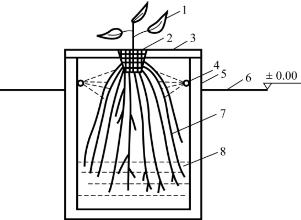
图7-4 半喷雾培种植槽示意图
1.植株 2.定性杯 3.定位板 4.喷头 5.种植槽 6.地面 7.根系 8.营养液
3.基质栽培
基质系统可以是开放式的,也可以使封闭式的。由于封闭式系统的设施投资较高,而且营养液管理比较复杂,因而在我国目前的条件下,基质栽培以开放式系统为宜。下面介绍几种主要的基质栽培方式。
(1)钵培 在花盆、穴盘等栽培容器中添充基质,栽培植物。从容器的上部供应营养液,下部设排液管,将排出的营养液回收于贮液灌中供循环利用,也可人工浇灌。
(2)槽培 将基质装入栽培槽,然后种植植物。目前多在温室地面上直接用砖(木条、竹竿等)筑栽培槽。为了防止渗漏并使基质与土壤隔离,通常在槽的基部铺1~2层塑料薄膜。槽面一般宽0.48m,深15~20cm,长度根据灌溉能力、温室结构以及田间操作所需步道等因素来决定,槽的坡度至少为0.4%。如有条件,可在槽底铺一根多孔排水管,由水泵或利用重力把营养液供给植株。
(3)袋培 用塑料薄膜袋填装基质栽培植物,用滴灌供液,营养液不循环使用。
①枕式袋培:按株距在基质袋上设置直径为8~10cm的种植孔,按行距呈枕式摆放在地面或泡沫板上,安装滴灌供应营养液。通常采用混合基质,每袋装基质20~30L。袋底或两侧开2~3个直径为0.5~1.0cm的小孔,使多余营养液流出,防止沤根。
②立式袋培:将直径15cm、长2m的柱状基质袋直立悬挂,从上端供应管供液,在下端设置排液口,在基质袋周围栽培植物。
(4)岩棉培 生产上,一般把岩棉切成不同规格的方块,如制成边长为7~10cm的小块,或制作长90~120cm、宽20~30cm、厚7~10cm的岩板,在岩棉块的中央或在岩棉板上按一定的株距打孔,在孔内栽培植物。岩棉块除了上下两面外都要用黑色塑料薄膜包裹,以防止水分蒸发和盐类在岩棉块周围积累,还可提高岩棉块温度。当幼苗第一片真叶出现时,可把小岩棉块套到更大的岩棉块中,用滴灌管供营养液。
7.3 容器育苗
容器又称营养器(营养钵)。利用各种容器装入培养基质培育苗木,称容器育苗。
7.3.1 容器育苗概况
在国外,20世纪50年代后期开始用容器培育造林用苗木。20世纪60年代,塑料工业的发展为容器育苗提供了更好的容器材料,加速了容器育苗的发展。20世纪70年代,世界各国应用容器育苗达到了髙潮,并且大规模应用于生产中,如巴西的容器育苗占其造林育苗总量的92%,泰国为90%,挪威为50%,瑞典为11%,芬兰为30%,加拿大为24%。我国容器育苗开始于20世纪50年代末期,70年代有较快的发展。
容器育苗已经被广泛应用于蔬菜、花卉、苗木、观赏植物等的栽培,成为集约化设施栽培的重要组成部分之一。在园林事业方面,我国各地也开始大力发展容器育苗,不仅节省种子,而且可以提高苗木质量和成活率。在园林植物的繁殖方面既可以用容器播种育苗,又可以用容器进行扦插繁殖。例如,北京西南郊苗圃,利用容器进行雪松和其他松柏类树种的播种繁殖以及迎春、木槿等花木类的扦插繁殖,均获得了良好的效果。
近年来,国内外容器育苗技术与塑料棚、温室等技术相结合,控制育苗的环境条件方面发展很快。国外已从小型的、简易的塑料温室(棚)发展到以人为控制温度、湿度和光照等全部自动控制,并有报警设备的大型的、永久性的现代化温室,而且通过电子计算机检测系统,能自动监测气温、空气相对湿度、土壤温度和湿度以及通风效率等。
7.3.2 容器育苗的特点
1.容器育苗的优点
(1)发芽率高,节省种子。
(2)有利于培育优质壮苗。
(3)可缩短育苗年限,育苗工序少。
(4)可提髙苗木移植成活率,移植后没有缓苗期,生长快,质量好。
(5)延长绿化植树的时间,不受植树季节的限制,便于劳动力的调配。
(6)培育时可以不占用肥力较好的土地,不受土壤条件限制。
(7)苗木均匀整齐,适合于机械化作业,有效地提高了劳动生产率。
2.容器育苗的缺点
(1)容器育苗单位面积产苗量低。
(2)容器育苗成本较高。
(3)容器育苗操作技术比一般育苗复杂。
7.3.3 容器育苗的基本条件
7.3.3.1 生产设施
1.育苗容器
育苗容器应具备下列条件:有利于苗木生长,制作材料来源广,加工容易,成本低廉,操作使用方便,保水性能好,浇水、搬运不易破碎等。
(1)育苗容器种类
①根据栽植特点分类:可分为不可回收的容器(在土壤中不能被微生物分解,造林时要将苗木从容器中取出,如多孔聚苯乙烯泡沫塑料营养杯、转孔硬质聚苯乙烯营养杯及其他用聚苯乙烯、聚乙烯做成的容器)和可回收的容器(在土壤中可以被土壤分散或被微生物分解,造林时不必将苗木从容器中取出,连同苗木一起栽入造林地,如泥炭容器、黏土营养杯、蜂窝式纸杯、细毡纸营养杯、纸质容器以及蜂窝状地膜制成的容器)。
②根据形状分类:可分为圆形、圆锥形、正方形、六角形、棱柱形、书本形、蜂窝形等,其中以无底六棱柱形容器为最好。其内壁有6个突起的棱状结构,根系可以沿内夹角向下延伸,避免形成根团。
③根据制作容器的材料分类:可分为纸质容器、(软质、硬质、生物降解)塑料容器、泥炭容器、轻型基质网袋容器、营养杯、营养篮等。容器内部常设有2~6条纵向棱状突起,苗木根系沿棱线向下伸展,防止根系在容器中盘旋。
(2)容器的规格 育苗容器的规格与树种、育苗期限、苗木规格和育苗地立地条件有关,容器规格影响到育苗的产量和育苗成本,规格的选择受到苗木大小和费用开支的限制。在保证栽植效果的前提下,尽量采用小规格容器。一般常规容器高10~25cm,直径5~15cm。
2.常用育苗容器简介
(1)塑料薄膜袋 用聚乙烯、聚氯乙烯、聚苯乙烯等制成的一种农用薄膜容器。这种容器耐腐期限长,使用范围也较广,规格可根据育苗的需要而定,多种培养基质均可装填,育苗可达1年,适于较多的树种育苗。薄膜袋不宜栽入种植穴,造林时应先将容器袋除去再行栽植,以免限制幼苗根系生长和污染土壤。
(2)营养砖 是一种外表不带容器的砖块,一般由泥炭、木屑、腐熟树皮等制成,造林时带砖块栽植。这种容器在我国南方应用较广泛,适宜于生长快、根系发达的桉树等树种的育苗。
(3)草泥杯 用秸秆混以泥浆制作成的杯状容器。这种容器的优点是可以就地取材,容易制作,但用工较多,搬运也不方便,在大面积的育苗造林中,一般不宜采用。
(4)泥炭杯 用泥炭土做成的容器,肥力较高,适用于我国北方有泥炭分布的地区。
(5)纸杯 用牛皮纸或旧报纸黏合而成的育苗容器。可做成双层,底部不粘合,容器呈筒状,可重复使用2~3次,成本低。带纸杯栽植便于机械化作业。
(6)蜂窝塑料薄膜容器 是近年新研制和推广的蜂窝状容器,具有携带方便、装填基质省工以及利于工业规模化、标准化生产等优点,是一种很有发展前景的容器,可广泛应用于林木育苗。起苗造林时,蜂窝状成群体结构的容器自动分离成单株带薄膜土团。
(7)草炭容器 草炭容器与其他种类容器的主要区别是制作原料比较特殊。该容器选用腐殖质类经多年腐熟的草纤维原料(草炭、添加草类浆料经过特殊工艺处理按一定比例合成浆料),再经工厂化系列合成、制作工艺而制成的一种容器。它是一种可回收容器,造林时不用撤掉容器,可随苗木一起植入地下,是一种无公害容器。容器适用于干旱和半干旱地区育苗与造林,也适用于农业、蔬菜、花卉等领域育苗。与其他容器相比,草炭容器具有通气性好、直立性强、质地较轻并含有一定量肥料、无公害、易分解等优点。
(8)穴盘容器 用聚乙烯、聚氯乙烯、聚苯乙烯等制成,有各种规格的板块,穴盘上孔穴数量有50、72、100、128、200、288、392等,外形尺寸一般为54.4cm×27.9cm×(3.5~5.5)cm。
3.工厂化育苗设施
工厂化育苗是利用轻基质材料,采用机械化精量播种技术,一次成苗。要求装备自动控温、调湿、通风、滴灌、喷水、喷药设备及进行基质消毒、搅拌、播种等作业的机械。
(1)基质消毒机 是一种小型蒸汽锅炉,将蒸汽引入基质后覆盖薄膜熏蒸一定时间,达到消毒效果。
(2)基质搅拌机 将基质中各种成分混合均匀。
(3)自动精量播种生产线 由主传送带、填料机、滚压筒、刷子、滚筒打孔器、播种机、覆盖斗、浇水通道、真空泵空压机(产生压缩空气供播种器用)、控制箱等组成,可自动完成穴盘疏松→向穴盘内填料→刮平→在每穴中央打一个孔→点播一粒种子→覆盖并压实→喷淋水的工序。
(4)恒温催芽室 保持高温高湿,温度为25~30℃,相对湿度为95%以上。2/3幼芽露头,即可移入育苗室。
(5)育苗室 温度不低于12~15℃,相对湿度70%~80%,透光率75%,穴盘内基质含水量为60%~70%。
7.3.3.2 培养基质
培养基质又叫营养土,是容器育苗的重要条件。培养基质质量的高低直接影响到容器育苗的质量。培养基质常由几种材料按一定比例混合而成,其配制是容器育苗的关键环节之一。配制培养基质要因地制宜,既要考虑所培育苗木的生物学特性,又要考虑营养土来源是否方便。
1.培养基质应具备的条件
(1)能就地取材或价格便宜。
(2)不会因温度或水分的变化发生变化、变质或板结,理化性质稳定。
(3)保水、排水、保肥性能良好,通气性好。
(4)重量轻,便于搬运。
(5)具有一定的肥力,含盐低,能长期供应种子发芽和幼苗生长所需要的各种营养物质,酸碱度适中。
(6)使用前应进行高温或熏蒸消毒,要求不带草种、害虫、病原体等。
2.培养基质原材料的选择
配置培养基质的材料一般应遵照就地取材的原则选择,主要有黄心土、火烧土、山坡土、塘泥、腐殖质土、园土、菌根土、厩肥、蛭石、珍珠岩等。
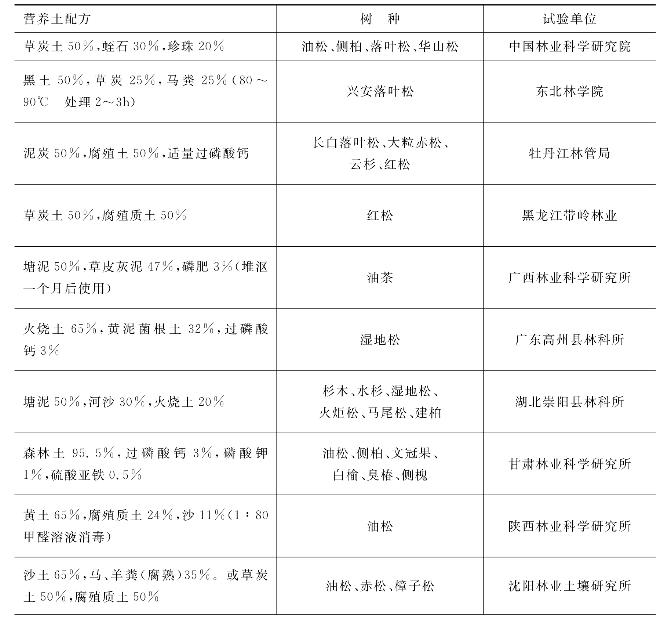
3.培养基质配制的比例
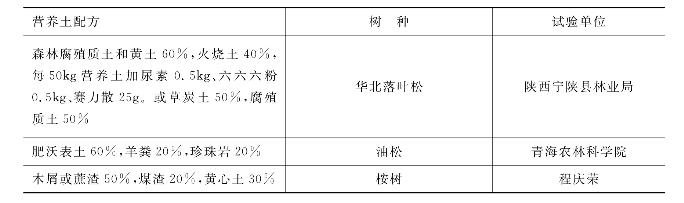
不同国家、不同地区由于科学技术水平不同,当地资源条件不同,自然环境也千差万别,所以采用的营养土配制的比例也没有统一的模式和规定。可以在满足营养土必备条件的基础上将几种材料按一定的比例混合。当然,不同树种的营养土配制比例有所不同。表7-8是我国一些地区营养土配方,以供参考。
表7-8 我国部分地区营养土配方
(续表)
4.培养基质的处理
(1)培养基质的酸碱度调节 营养土的酸碱度应根据培育树种的特性而定。针叶树育苗pH值以5.5~7.0为宜,阔叶树以6.0~8.0为宜。采用施酸、碱性肥料的办法对酸碱度进行调节。如果pH值偏小,可随基肥一起加入Ca(NO3)2、NaNO3等碱性肥料。在pH值为3.5~7.0的情况下,在1kg干泥炭中加入30g很细的石灰石,可把pH值改变一个单位。如果pH偏大,可加入(NH4)2SO4、NH4Cl等酸性肥料。
生长期间对培养基质酸碱度的调节可通过测定容器底部渗透出液(通过容器基质的水)调整。育苗容器需浇足够的水,使其能有水渗透出容器。每次收集的渗出液应为最初渗出的液体,每次收集5ml,以测定pH值。
(2)营养土的消毒 由于营养土材料来源比较广泛,土内常存有对苗木生长有害的病毒、病菌或虫卵等物质,因而必须进行消毒。常用消毒方法有髙温消毒法和药物消毒法。高温消毒法包括日光消毒法、蒸汽消毒法、灼烧消毒法;药物消毒法包括甲醛(甲醛)消毒法、硫磺粉消毒法(北方应用较多)、石灰粉消毒法(南方应用较多)、硫酸亚铁消毒法、代森锌消毒法等。
(3)营养土接种菌根 接种有益微生物能增加根部吸收养分和水分的表面积和范围,增加苗木对干旱、土壤高温和不适宜的土壤酸碱度的适应能力,增加植物对磷素和其他元素的吸收和利用。松类受菌根影响最为显著,例如雪松育苗中,没有菌根会导致生长不良,生长量下降;油松对外生菌有极强的依赖性,在育苗过程中加强外生菌根的应用显得更为重要。例如,中国林科院和晋中苗圃在山西省寿阳县进行的油松育苗外生菌根菌大面积应用试验,所用的菌根菌为彩色亚马勃和厚环乳牛肝菌,与基质混合后装入塑膜容器内,苗木生长100d后,测量幼苗生长情况,并进行造林。试验表明,接种菌根菌后,苗木质量和造林保存率均有明显提髙。
7.3.4 容器育苗技术
7.3.4.1 容器的装土和排列
1.装土
装土前,营养土必须充分混匀,再堆沤一周,目的是使营养土中的有机肥充分腐熟,以防烧伤幼苗。装土时不要装得过满,一般比容器口约低1~2cm即可,留出浇灌营养液或水的余地。边装边将营养土压紧。装土可人工操作或机械化操作。
2.排列
容器排列一般宽1m左右,长度不限。容器的下面要垫水泥板或砖块,塑料板也可以,主要为了防止植物的根系穿透容器长入土地中,从而影响根系的生长和形成不完整的根系。若在容器架上育苗,上下层间距应在1m以上,以不影响光照为原则。
7.3.4.2 容器播种育苗
种子应播种在容器中央,发芽率高的播种1~2粒,经催芽处理的好种子可播1粒,发芽率低的播种2~3粒。播后覆土,覆土厚度视种粒大小而定,一般为种子直径的1~3倍,覆土以不见种子为度。在室外育苗时,由于天气干旱,容器暴露在空气中,水分蒸发很快,营养土很快就会干燥,影响种子的发芽。为防止水分过度蒸发,可用锯末、细草、稻草覆盖在容器营养土表面,以减少水分蒸腾。不可盖塑料膜,因为会造成短时间高温灼伤幼苗。可人工播种或机械化播种。
7.3.4.3 容器扦插育苗
一些珍贵树种可用营养钵等容器进行扦插育苗。先用细棍在基质上插3~5cm深的小孔,再将处理过的枝条插入小孔中,用手轻轻压实,浇透水。保持基质湿润,至生根后再逐渐减少灌水次数。
7.3.4.4 容器苗的管理
1.浇水
播种后要立即浇水,并且要浇透。对微粒种子要先浇足底水后再播种、覆土,最后用细嘴壶浇少量水湿润种子,以防冲掉种子。出苗和幼苗期要少量勤浇,保持基质湿润;速生期要量多次少,做到基质干湿交替;生长后期要控制浇水;出圃前要停止浇水。
2.控制温湿度
容器育苗能否成功,关键是能否有效控制温湿度。温度太高或太低,会造成苗木灼伤和长势差;湿度不适宜,会引起根系缺氧而导致发霉、烂根或枯萎、死亡。适宜苗木生长的最佳棚内温度为18~28℃,最佳空气相对湿度为80%~95%,土壤水分宜保持在田间持水量的80%左右。控制温度的方法有遮阳网遮阳、喷水、通风和棚内加热等措施。控制湿度的方法有浇水、通风等措施。
3.施肥
不同发育时期要施以不同的肥料。速生期以施氮肥为主,促进苗木快速生长。速生后期施钾肥,促使苗木木质化。施肥只能施液肥,浓度为200~300倍液,不能干施。施肥后要立即用清水冲洗叶片。根据需要,可叶面喷施0.2%~0.3%磷酸二氢钾液或尿素液。
4.间苗和补苗
在容器育苗生产中,往往因为播种量偏大或撒种不均匀而出现密度过大或疏密不均的现象,必须及时间苗和补苗。一般在出苗后20d左右、小苗长出2~4片叶子时进行间苗和补苗。每个容器内保留1株健壮苗,其余苗要拔除。
5.防治病虫害
容器育苗易发生灰霉病,松、杉类苗木还易发生猝倒病。防治方法是及时通风,适当降低空气湿度,使用甲基托布津、退菌特、百菌清、多菌灵等进行防治。对松、杉的苗木立枯病可用敌克松拌种处理。
思考题
1.组培育苗有何优缺点?
2.组织培养的基本条件有哪些?
3.组培育苗的技术要点是什么?
4.无土栽培的基质有哪些?
5.常见无土栽培的方式有哪些?
6.容器育苗营养土怎样配制?
7.容器育苗管理应注意哪些事项?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














