一、酶切反应
根据实验目的选择合适的载体,分别对插入的目的基因与载体进行酶切。如果目的基因和载体内有合适的限制性核酸内切酶切割位点,即可直接用相应的限制酶进行消化。只用一种限制性内切酶的酶切反应即单酶切,酶切后的产物两个末端相同。单酶切反应较简单,但目的基因经单酶切处理后能以两个方向插入到载体中,甚至目的基因酶切片段能串联后再插入到载体中,且可自连(同样处理的载体也有类似不足),因而重组效率较差,不利于重组子的筛选。用两种不同的限制性内切酶切割目的基因称为双酶切,酶切反应本身稍复杂,但得到的目的基因片段只能以单方向插入载体,一般也不存在自连现象,理论上重组效率更高。简而言之,单酶切适用于目的基因或载体两端具有相同的限制酶切割位点,而双酶切则适用于目的基因或载体两端具有不同的限制酶切割位点。后者因酶切后能实现定向连接,在基因工程中被广泛应用。下面介绍这两类酶切反应。
(一)单酶切
进行限制性内切酶切割反应只需简单地将限制性内切酶和DNA样品放在合适的反应缓冲液温育,其中DNA和酶的量、缓冲液的离子强度、孵育温度和时间都依具体的反应而定。
【材料】
(1)质粒DNA(约100ng/μl)。
(2)限制性内切酶:EcoRⅠ(12U/μl,TaKaRa),储存在酶的储存缓冲液中:10mmol/L Tris-HCl、100mmol/L KCl、0.1mmol/L EDTA、1mmol/L DTT、0.15% Triton X-100、0.01% BSA、50% 甘油(pH 7.5)。
(3)10×H酶切缓冲液:500mmol/L Tris-HCl(pH 7.5)、100mmol/L MgCl2、10mmol/L DTT、1 000mmol/L NaCl。
(4)反应停止液(10×加样缓冲液,loading buffer):1% SDS、50% 甘油、0.05%溴酚蓝;或可自行配制:20% Ficoll 400、0.1mol/L Na2EDTA(pH 8.0)、1.9% SDS、0.25%溴酚蓝、0.25% 二甲苯菁(可选)。
(5)双蒸水。
(6)设备:恒温水浴锅、涡旋振荡器、台式离心机。
【操作步骤】
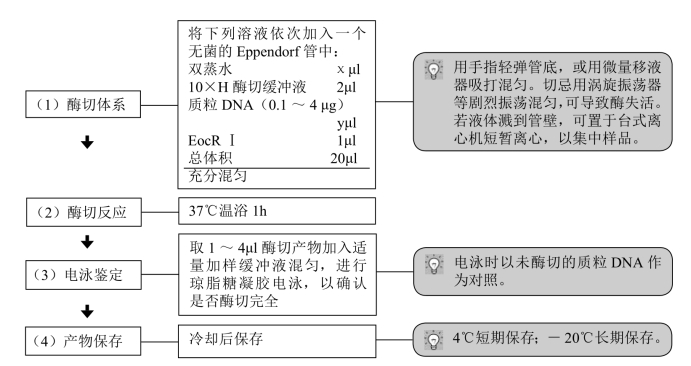
【注意事项】
(1)双蒸水为可变体积,当其他反应成分确定后,用双蒸水将反应体积补足。
(2)反应体系中DNA的最大加入量为200ng/μl(终浓度)。若需酶切大量的DNA,将上述反应体系按相应比例扩大。
(3)根据酶的活力来计算加入的酶量。理论上,1U限制性内切酶在推荐的反应条件下,60min内可完全消化1μg纯化的DNA。但酶的体积应低于反应总体积的1/10,因为酶液中的甘油会抑制酶切反应。
(二)双酶切
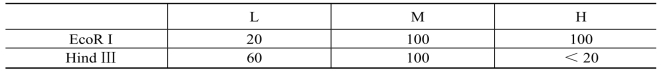
如果具有相同反应条件和反应温度,两种(或更多的)限制酶可同时加入同一反应体系中进行酶切反应。此时主要考虑选择一种适合两种限制酶的缓冲液。商家一般为各种限制酶配备了相应的通用缓冲液,如L、M、H缓冲液等,其区别主要是盐浓度不同,分别代表低盐、中盐、高盐。双酶切时缓冲液的选择方法主要有:①查阅商家提供的一些常用限制酶进行双酶切反应时通用缓冲液的使用表来选择;②查阅所用限制酶在各种通用缓冲液中的相对活性表来选择。以Takara公司的限制性内切酶Hind III和EcoR I为例:根据该表,以Hind III和EcoR I双酶切时选择两种酶活性都较高的M缓冲液最合适。根据表8-1,以Hind III和EcoR I双酶切时选择两种酶活性都较高的M缓冲液最合适。
表8-1 EcoR I和Hind III在通用缓冲液中的相对活性(%)
【材料】
(1)质粒DNA(约100ng/μl)。
(2)限制性内切酶(TaKaRa):Hind III(15U/μl)、EcoR I(12U/μl)。
(3)酶切缓冲液
推荐的Hind III 酶切缓冲液:10×M缓冲液,含100 mmol/L Tris-HCl(pH 7.5),100 mmol/L MgCl2,10 mmol/L DTT,500 mmol/L NaCl。
推荐的EcoR I酶切缓冲液:10×H缓冲液,含500 mmol/L Tris-HCl(pH7.5),100 mmol/L MgCl2,10 mmol/L DTT,1 000 mmol/L NaCl。
(4)反应停止液(10×加样缓冲液):1% SDS,50% 甘油,0.05%溴酚蓝。或可自行配制:20% Ficoll 400,0.1 mol/L Na2EDTA(pH 8.0),1.9% SDS,0.25%溴酚蓝,0.25% 二甲苯菁(可选)。
(5)双蒸水。
(6)设备:恒温水浴锅、涡旋振荡器、台式离心机。
【操作步骤】
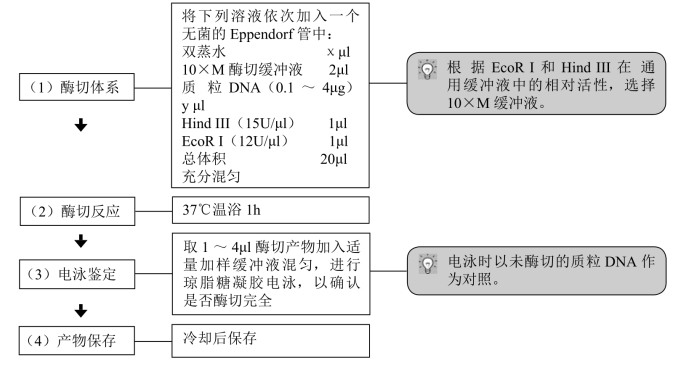
如果两种酶所需的反应条件相差太大,可分2种情况进行酶切:①酶切缓冲液不同,分别属于高盐和低盐类型——首先加入需要低盐浓度的酶消化DNA,然后直接添加高盐缓冲液,进行高盐酶切反应;②不同的酶使用不同的酶切缓冲液——第一个酶切完成后,进行酚∶氯仿抽提、乙醇沉淀,再进行第二个酶的消化。
(三)影响限制性内切酶活性的因素
1.DNA的纯度 酶切反应的效率很大程度上取决于所使用的DNA本身的纯度。污染在DNA制剂中的某些物质,如蛋白质、酚、氯仿、乙醇、EDTA、SDS以及高浓度的盐离子等,都可能影响酶的活性。一般可以通过增加酶量、增大反应体积、延长反应时间,提高对低纯度DNA制剂的反应效率。
2.DNA的甲基化程度 识别序列中特定核苷酸的甲基化作用会强烈地影响酶的活性。
3.DNA的分子结构 通常情况下对整体酶切反应是无关紧要的,但当涉及到局部酶切消化时,则是必须考虑的重要参数。
4.酶切反应的缓冲液 不同限制性内切酶对缓冲液中盐浓度的要求各不相同。用两种酶消化DNA时,若各种酶所需盐浓度相同,则消化可同时进行;若需要的盐浓度不相同,则必须先用低盐浓度的限制酶消化完后,再调整到高盐缓冲系统,加入高盐浓度的限制性内切酶,继续消化。酶切反应中,甘油浓度超过5%(v/v)会抑制内切酶活性,因此在20μl反应体系中,甘油应少于1μl。有些限制性核酸内切酶需要牛血清白蛋白(BSA)作为辅助因子,在使用时必须加入牛血清白蛋白,使其终浓度达到0.1mg/ml,才能使酶正常工作。另一些限制性内切酶虽然不需要牛血清白蛋白作为辅助因子,但加入牛血清白蛋白并不会干扰它们的活性。此外,还需要关注由于缓冲液的改变,产生酶的星号活性(即识别特异性降低,对与原识别序列相似的序列也产生切割反应)。
5.酶切反应的温度 不同的限制性内切酶具有不同的最适反应温度,而且彼此之间有相当大的变动范围。酶切反应的温度低于或高于最适温度,都会影响限制性内切酶的活性,甚至最终导致完全失活。
(四)结果与分析
1.实验结果及分析 如图8-6所示,质粒DNA经单酶切消化成线性质粒,其电泳的迁移速度变慢(第2道);经双酶切后消化成与预期大小一致的2个片段(第3道),结果表明酶切完全。
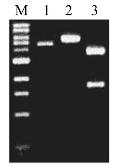
图8-6 质粒DNA的酶切电泳图
M:1 kb DNA marker;1:未酶切质粒DNA;2:EcoR I单酶切;3:EcoR I和XhoI双酶切
2.常见问题及解决方案 见表8-2。
表8-2 酶切反应常见问题及解决方案

(续表)

二、产物回收
在重组DNA或探针标记等实验中,常需要从凝胶中回收和纯化DNA,下面介绍几种常用的方法。
(一)β-琼脂糖酶法
β-琼脂糖酶(Agarase)可以切断琼脂糖[α-L(1,4)- 3,6-半乳糖酐-β-D(1,3)半乳糖多聚体],生成琼脂寡糖,是一种耐高温的琼脂糖酶,反应最适温度为60℃,适合于高温(60℃)下的琼脂糖降解反应。将含有DNA片段的琼脂糖凝胶切下后,在熔解温度下再熔化琼脂糖胶,然后使用本制品降解琼脂糖,再经乙醇沉淀回收目的DNA片段。此方法适用于几十kb以上的长片段DNA的回收,且对DNA片段不产生损伤。
【材料】
(1)DNA样品。
(2)琼脂糖、10 ×加样缓冲液。
(3)β-琼脂糖酶(1 U/μl)。
(4)10 × β-琼脂糖酶缓冲液 。
(5)10 × TAE(10 ×Tris-乙酸)。
(6)TE缓冲液。
(7)异丙醇、无水乙醇。
(8)3mol/L NaCl溶液:盐溶液亦可选2.0mol/L 乙酸铵、0.15mol/L NaCl、0.3mol/L乙酸钠或0.8mol/L LiCl。
(9)设备:电泳槽、电泳仪、紫外灯、手术刀片、恒温水浴锅、涡旋振荡器、台式离心机。
【操作步骤】

【注意事项】
(1)β-琼脂糖酶对1%以下浓度的琼脂糖凝胶的降解效率较高,且对TAE缓冲液制备的琼脂糖凝胶的降解效果好于用TBE制备的凝胶。建议使用低浓度凝胶和TAE。
(2)当溴酚蓝迁移至足够距离时(至少2cm),在长波紫外灯下观察,用清洗过的刀片在目的片段前切下与目的片段同长,宽度适当(一般2cm左右)的胶块。切胶时,可在胶下垫一个新的塑料手套,防止污染。
(3)高温再熔胶容易损伤DNA,建议使用低熔点琼脂糖制备凝胶进行DNA电泳。
(4)进行乙醇沉淀时,建议使用乙酸铵调整盐浓度,以避免低聚糖与DNA结合。如果DNA片段需要进一步进行5'末端磷酸化或连接反应,应避免使用乙酸铵,因为T4多聚核苷酸激酶和T4 DNA连接酶活性会被铵离子所抑制。
(5)回收长片段DNA时,应小心避免物理性损伤。
(6)可以用1倍异丙醇或2~3倍体积的乙醇进行DNA 沉淀。当回收的凝胶体积较大时建议使用异丙醇进行沉淀。
(二)硅胶树脂吸附回收法(试剂盒法)
目前有许多生物技术公司开发出进行此项操作的试剂盒,使用方便、快速,可参照说明书进行。下面以大连宝生物工程有限公司(TaKaRa)的试剂盒(琼脂糖凝胶DNA片段回收试剂盒,Agarose Gel DNA Fragment Recovery Kit Ver.2.0)为例供大家参考。其原理是在NaI 存在的条件下,使含有DNA片段的凝胶融化,然后让DNA片段吸附于硅胶树脂上,再用TE 缓冲液或无菌水洗脱DNA(图8-7)。此方法中DNA片段的回收率高,特别是在回收短片段DNA时效果尤为明显。

图8-7 试剂盒法琼脂糖凝胶DNA片段回收的流程图
【材料】
(1)DNA样品。
(2)琼脂糖、10 ×加样缓冲液。
(3)琼脂糖凝胶DNA片段回收试剂盒。
试剂盒组成:
硅胶树脂(Silica Matrix) 1ml
NaI 溶液 50ml
清洗液* 24ml
*首次使用前,应添加56 ml的无水乙醇。
(4)TE缓冲液。
(5)无水乙醇。
(6)灭菌蒸馏水。
(7)设备:电泳槽、电泳仪、紫外灯、手术刀片、恒温水浴锅、涡旋振荡器、台式离心机。
【操作步骤】
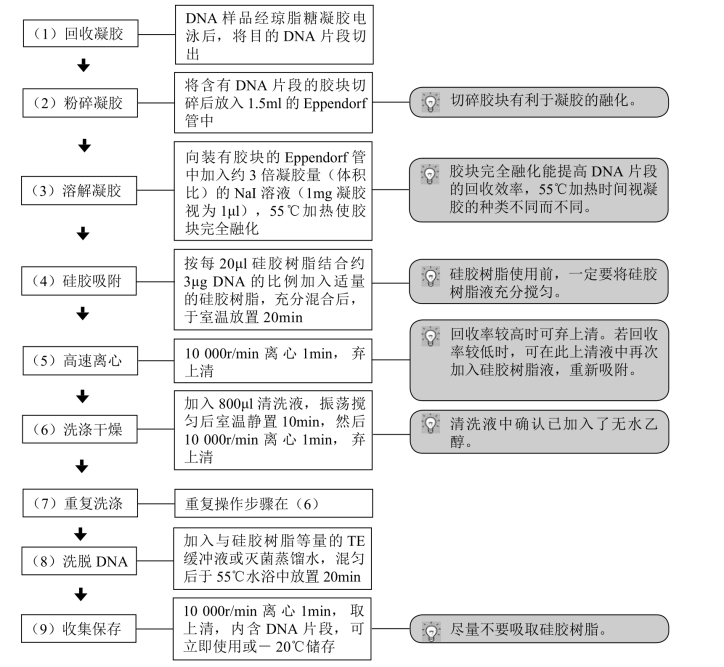
【注意事项】
(1)对电泳使用的凝胶种类没有严格限制,可以使用普通的凝胶。为了保证回收DNA的质量和DNA的回收效率,希望使用高纯度的凝胶,但没有必要一定使用低熔点凝胶等。
(2)硅胶树脂每20μl能结合约3μg的DNA。但回收的DNA片段的量<3μg时,应使用20μl的硅胶树脂液;>3μg时,建议分管操作。
(3)为了提高DNA片段的回收效率,切胶时应尽量去除多余的胶块。
(4)回收的DNA片段纯度较高,可直接用于DNA测序、克隆实验等,同时也可以直接进行各种酶促反应等。
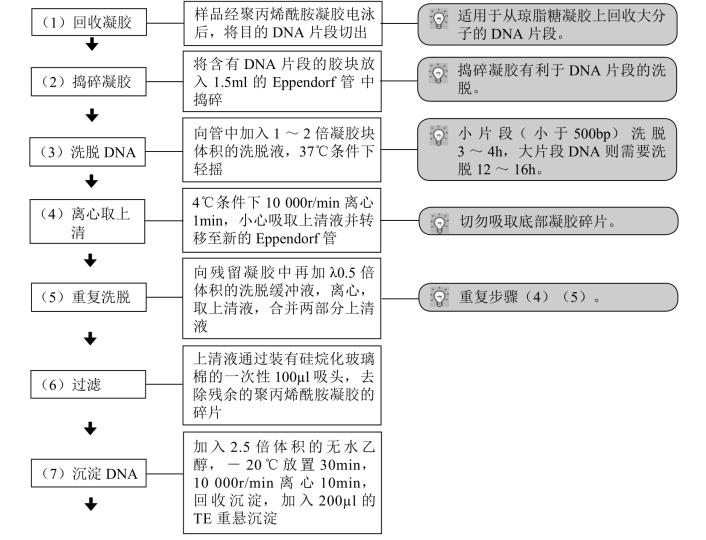
(三)压碎浸泡法
本法适用于从3.5%~5%聚丙烯酰胺凝胶中回收小分子量(<1kb)的DNA片段,亦适用于从琼脂糖凝胶上回收大分子的DNA片段。本法的优点是简单,从聚丙烯酰胺凝胶中分离的DNA纯度高,不含酶抑制物及对转染细胞有毒性的杂质,但回收率低。
【材料】
(1)丙烯酰胺、甲叉双丙烯酰胺、四甲基乙二胺(TEMED)、过硫酸铵(AP)。
(2)洗脱缓冲液:0.5mol/L乙酸铵、10mmol/L乙酸镁、1mmol/L EDTA(pH 8.0)、0.1% SDS。
(3)TE缓冲液。
(4)3 mol/L乙酸钠(pH 5.2)。
(5)无水乙醇、70%乙醇。
(6)设备:电泳槽、电泳仪、紫外灯、手术刀片、恒温水浴锅、涡旋振荡器、台式离心机、摇床。
【 操作步骤】

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















