实验四 质粒DNA的提取、琼脂糖凝胶电泳鉴定和酶切
一、实验目的
学习碱裂解法小量制备质粒DNA的方法,掌握质粒DNA的提取纯化、限制性内切酶酶切及琼脂糖凝胶电泳鉴定的实验原理。
二、实验原理
质粒DNA是存在于细菌中的环状小分子DNA,不同于长链大分子的基因组DNA,游离于细胞质中。由于细胞中的RNA可被碱降解,大分子DNA可与细胞碎片一起沉淀,质粒DNA可用碱法提取。
碱法提取质粒试剂的溶液Ⅰ是含有葡萄糖的Tris缓冲液,目的是溶解沉淀的细菌,由于细菌外有多糖细胞壁,溶液中的葡萄糖使细菌更容易分散在溶液中。溶液Ⅱ含有碱氢氧化钠和去污剂,起着破坏细胞结构和降解RNA的作用,细胞解体后,游离在细胞质中的质粒就释放到溶液中。溶液Ⅲ是酸性的KAC缓冲液,加入溶液Ⅲ后可中和碱性,停止碱降解,K+替代Na+使SDS与大分子DNA和蛋白质一起沉淀。在离心之前由于基因组DNA是线性大分子,尽可能轻柔操作,防止断裂,污染质粒。
上清液经过典型的酚、氯仿三步抽提,将上步未除去的蛋白质和其他杂质除去,再经75%乙醇洗去盐分。
提取出来的质粒电泳后多数情况下在琼脂糖凝胶电泳图上可见三条带。它们从慢到快分别是开环质粒、线形、复制中间类型和超螺旋质粒。用毛细管凝胶电泳可以清楚地分辨各种质粒形式,其中最主要的形式是超螺旋单体(ccc monomer),其次是开环单体。二聚体是复制中间类型,超螺旋二聚体含量与线形单体类似,电泳速度略快于线形单体,线形二聚体和开环二聚体含量很少,如图4-1所示。决定电泳速度的是凝胶孔对DNA分子的阻力大小。因为超螺旋质粒体积最小,在凝胶中阻力最小,开环分子体积最大,通过凝胶的阻力最大,所以呈现如上顺序。
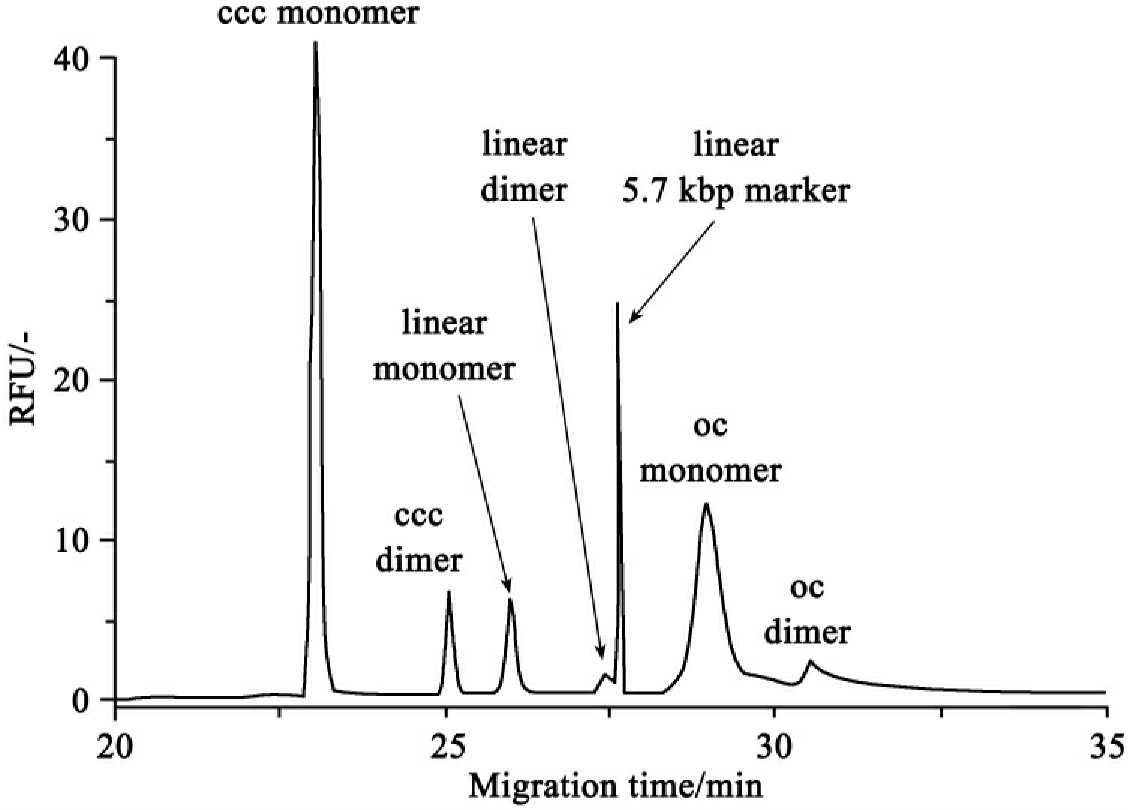
ccc超螺旋;linear线形;oc开环;monomer单体;dimer二聚体;
图4-1 毛细管凝胶电泳分离pUC19质粒各种形式(Schmidt et al,2000)
三、实验仪器、材料和试剂
1.仪器:培养箱,灭菌锅,超净工作台,离心管(1.5mL、7mL),台式高速离心机,微量移液器,枪头(1mL、200μL、10μL),枪头盒,漩涡振荡器和制冰机。
2.材料:带有pUC19质粒的DH5α。
3.试剂:LB培养基(胰蛋白胨10g/L,酵母提取物5g/L,NaCl10g/L,加蒸馏水适量,溶解后加蒸馏水至1L,121℃1个大气压灭菌15min)。
溶液Ⅰ:50mmol/L葡萄糖,25mmol/L三羟甲基氨基甲烷(Tris HCl,pH8.0),10mmol/L乙二胺四乙酸(EDTA,pH8.0)。
溶液Ⅱ:0.4mol/L NaOH,2%SDS,用前等体积混合。
溶液Ⅲ:5mol/L乙酸钾60mL,冰乙酸11.5mL,蒸馏水28.5mL。
Tris-饱和酚,异丙醇,氯仿-异戊醇(24∶1),EcoRⅠ和HindⅢ(TakaRa)。
TE缓冲液:10mmol/L Tris HCl pH8.0,1mmol/L EDTA pH8.0。
四、实验步骤
(一)DNA提取详细步骤和说明
1.在超净工作台上取5mL含有100μg Amp/mL培养基的LB培养液加入灭菌的试管中。
2.用移液枪吸取150μL含有pUC19质粒的DH5α菌液,接入5mL含有氨苄青霉素(100μg/mL)的培养基中37℃摇床培养过夜。
3.取1.5mL菌液于1.5mL离心管中,12000rpm离心30s,去上清液,再取1.5mL菌液加入同一离心管同样离心,去上清液。
4.在沉淀中加入150μL溶液Ⅰ,盖上盖后在漩涡振荡器上混匀,室温下静置5min(也可直接进入下一步,溶液Ⅰ、Ⅱ、Ⅲ加起来体积应少于1/2倍1.5mL)。
5.加入300(2倍)μL的溶液Ⅱ,盖上盖后迅速颠倒混匀10次,冰上放置5~6min,待溶液澄清后进入下一步。注意不要剧烈振荡。
6.加入溶液Ⅰ体积1.5倍(225μL)的溶液Ⅲ,盖上盖后迅速颠倒混匀10次,冰上放置10~15min。注意不要剧烈振荡。
7.13000rpm离心15min,将上清液转移到另一个干净的1.5mL离心管中,加入等体积酚,盖上盖后混匀。
8.13000rpm离心5min,将上清液转移到另一个干净的1.5mL离心管中,加入等体积酚∶氯仿∶异戊醇(25∶24∶1),盖上盖后迅速颠倒混匀。
9.13000rpm离心5min,将上清液转移到另一个干净的1.5mL离心管中,加入等体积氯仿-异戊醇,盖上盖后迅速颠倒混匀。
10.13000rpm离心5min,将上清液转移到另一个干净的1.5mL离心管中,加入1/10倍体积的3mol/L pH5.2NaAC,0.6~0.8倍或等体积异丙醇,盖上盖后混匀,室温或冰上静置20min。这一步的NaAC终浓度是0.3mol/L。
11.13000rpm离心15min,去掉上清液,加入1mL冰冷的70%乙醇,不弹起沉淀,然后13000rpm离心5min,弃上清液,加入冰冷的1mL无水乙醇,13000rpm离心5min,弃上清液,管子里的液体未流干之前不要把管子转回正向,否则微量的液体不易倒干,使干燥时间延长。此步骤的目的是洗去DNA中的盐分和有机溶剂,最后一步洗去水分。
12.倒干液体后管子横放在超净沉淀工作台上,不盖盖子,让其自然干燥,干燥后根据提取的DNA量加入10~20μL TE缓冲液溶解沉淀,加入0.2μL RNase,混匀后在离心机中瞬时离心,使溶液集中在管底。
13.取一个管子按照下面配方加入EcoRⅠ和HindⅢ置于37℃恒温箱2h。用于制备基因组文库。
pUC19DNA20μL,ddH2O5μL,10×M酶切缓冲液3μL,EcoRⅠ1μL,HindⅢ1μL,共30μL,混匀后在酶的最适温度反应2h,参见说明书。
14.酶切后的质粒电泳分离后,切下酶切好的线状DNA,用DNA凝胶回收试剂盒回收。质粒提取过程需要4~5h。
(二)质粒DNA提取流程图
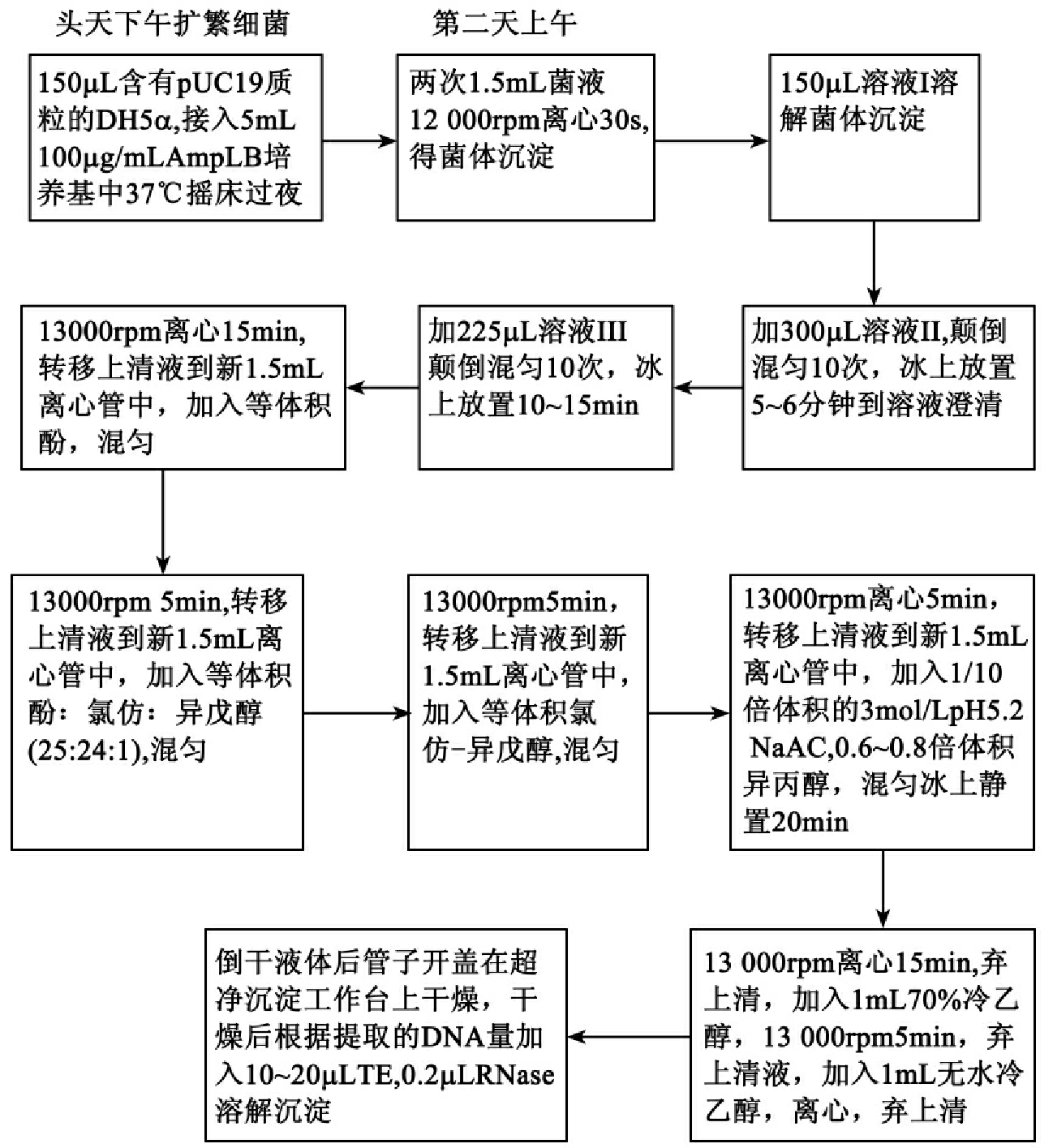
图4-2 质粒DNA提取流程图
五、结果分析
小分子环状DNA在溶液中可呈超螺旋和开环状,还可能有复制中间体。所以提取的质粒DNA一般在琼脂糖凝胶电泳图上是三条带,电泳速度顺序为:超螺旋>复制中间体>开环,如图4-3所示。
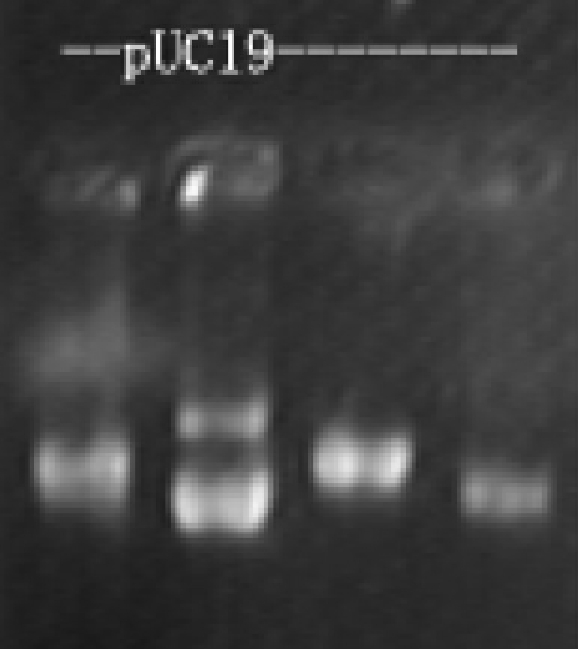
图4-3 质粒pUC19DNA电泳图
六、注意事项
1.溶液Ⅱ混匀时不要剧烈,防止基因组DNA由于机械力断裂成小片段,这样与质粒DNA难以分开。混匀后在冰上放置的时间也不要长,防止碱过度作用使基因组DNA更容易断裂而污染质粒。
2.加溶液Ⅲ混匀时也不要剧烈,混匀后在冰上放置一定时间,是为了使K+能充分置换SDS中的Na+,从而沉淀,同时将蛋白质以及与之缠绕的大分子DNA也沉淀下来。
七、思考题
1.溶液Ⅰ、Ⅱ、Ⅲ的作用分别是什么?
2.为什么在加了溶液Ⅱ到离心前之间的步骤中,溶液不能剧烈振荡?
3.为什么溶液Ⅱ处理的时间有一定限制?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















