第九章 免疫学检测法
学习目标
1.熟悉抗原抗体反应的特点和影响因素。
2.了解免疫学检测常用方法。
免疫学检测技术的用途非常广泛,可用于有关免疫疾病的诊断、疗效评价及发病机制的研究。此外免疫学检测技术在医学生物学研究中对抗原性物质或细胞的定性、定量检查不仅推动了对各种免疫学现象的研究,而且扩大了免疫学与医学生物学许多领域的联系。本章仅介绍常用免疫学检测方法的原理和应用。
第一节 抗原或抗体的体外检测
抗原抗体反应具有高度特异性。在一定条件下,二者结合可出现肉眼可见或仪器可检测到的反应,据此,在体外可用已知的抗原(或抗体)来检测相应未知的抗体(或抗原)。抗体主要存在于血清中,因此,体外的抗原抗体反应又称为血清学反应。
一、抗原抗体反应的特点
(一)特异性
一种抗原一般仅能与它刺激所产生的抗体结合,这种抗原抗体反应的专一性即特异性。抗原抗体的结合就像酶与底物的结合,激素与其受体的结合一样不是化学的反应,而是非共价键的可逆结合。抗原表位和抗体分子可变区构型的互补,造成两分子间有较强的亲和力。空间构型互补程度不同,抗原和抗体分子之间结合力强弱也不同。互补程度高,则亲和力强。
天然抗原分子通常具有多种抗原表位,可刺激机体产生多种特异性抗体。若两种不同的抗原分子具有一种或多种相同的抗原表位,则二者均能与对方抗血清中的相应抗体结合,即发生交叉反应,交叉反应可影响血清学诊断的准确性。采用单克隆抗体进行检测是克服交叉反应的有效方法之一。
(二)可逆性
抗原与相应抗体除空间构型具有互补性外,两者主要是通过分子表面的氢键、疏水键、静电引力和范得华力非共价结合。非共价结合的抗原抗体复合物不稳定,降低溶液的pH或提高溶液离子强度均可使抗原抗体复合物解离,即抗原抗体反应具有可逆性。解离后的抗原和抗体仍能保持原有的理化特性和生物学活性。据此,可通过亲和层析法纯化抗原或抗体。
(三)可见性
抗原与抗体结合后能否出现肉眼可见的反应取决于二者的浓度和比例。在一定浓度范围内,二者比例合适,即抗原略多于抗体时,可出现肉眼可见的反应物(即由网络状抗原抗体复合物形成的沉淀物或凝集物);若二者比例不合适,即抗原或抗体过剩时,可形成小分子抗原-抗体复合物。此种复合物多呈游离状态,不能为肉眼所见。据此在实验过程中,应注意调整反应体系中抗原和抗体的比例,以避免出现假阴性结果。
(四)阶段性
抗原抗体反应分为两个阶段:第一阶段是抗原抗体特异性结合阶段,其特点是反应快,可在数秒钟至数分钟内完成,一般不能被肉眼所见;第二阶段是可见反应阶段,根据参加反应的抗原物理性状的不同,可出现凝集、沉淀和细胞溶解等现象。可见反应阶段所需时间较长,从数分钟、数小时至数日不等,且受电解质、温度和酸碱度等因素影响。
二、抗原抗体反应的影响因素
1.电解质 抗原和抗体具有胶体性质,在中性或弱碱性条件下有较高的亲水性。当抗原与抗体结合后,其亲水性减弱,在电解质作用下,抗原抗体复合物失去较多负电荷,从而使之彼此连接出现肉眼可见的凝集或沉淀现象。试验中常用0.85%的NaCl溶液作为稀释液,以提供适当浓度的电解质。
2.温度 提高温度可增加抗原与抗体分子的碰撞机会,加速抗原抗体复合物的形成。但温度过高(50℃以上)可使抗原或抗体变性失活,影响实验结果。通常抗原抗体反应的最适温度是37℃。
3.酸碱度 抗原抗体反应的最适pH值在6~8之间,pH值过高或过低,即过碱或过酸,均可影响抗原或抗体的理化性状。例如,当反应液中的pH值接近抗原的等电点时,可因抗原自沉而出现非特异性酸凝集,这种凝集现象并不是颗粒性抗原与相应抗体特异性结合的结果,严重影响试验的可靠性。
三、抗原抗体反应的类型和检测方法
根据抗原的性质、参与反应的成分和反应呈现的结果,可将抗原抗体反应分为凝集反应、沉淀反应、补体参与的反应和采用标记物进行的抗原抗体反应。
(一)沉淀反应
可溶性抗原与抗体结合,在两者比例合适时,可形成较大的不溶性免疫复合物。在反应体系中出现不透明的沉淀物,这种抗原抗体反应称为沉淀反应(precipitation reaction)。沉淀反应可在液体中,也可在半固体琼脂凝胶中进行。在液体中进行的沉淀反应如絮状沉淀反应等,由于其操作复杂、敏感性差已被目前所用的免疫比浊法取代。沉淀反应大多在半固体琼脂凝胶中进行,使可溶性抗原或抗体在凝胶中扩散,在比例合适处相遇形成肉眼可见的白色沉淀现象。琼脂扩散试验包括单项琼脂扩散和双向琼脂扩散。此外,将琼脂扩散与电泳技术结合,又可衍生出对流电泳、火箭电泳和免疫电泳等多种检测方法。
1.单向琼脂扩散试验 是在凝胶中进行的沉淀反应。将抗体混入加热溶解的琼脂中,倾注于玻片上,制成含有抗体的琼脂板,在适当位置打孔,将抗原材料加入琼脂板的小孔内,让抗原从小孔向四周的琼脂中扩散,抗原与琼脂中的相应抗体相遇,可在比例适宜处形成以孔为中心的白色沉淀环,鉴于其直径与加入的抗原浓度成正比,所以常用于定量测定人或动物血清IgG、IgM、IgA和C3等,本方法简便,结果易观察,其缺点是需1~2天才能看结果。
2.免疫比浊法 当抗体浓度高,加入少量可溶性抗原,即可形成一些肉眼看不见的小免疫复合物,它可使通过液体的光束发生散射,随着加入抗原增多,形成的免疫复合物也增多,光散射现象也相应加强。免疫比浊法就是在一定的抗体浓度下,加入一定体积的样品,经过一段时间,用光散射浊度计测量反应液体的浊度,来推算样品中的抗原含量。本法敏感、快速简便,可取代单向扩散法定量测定免疫球蛋白的浓度。
3.双向琼脂扩散试验 是在琼脂板上按一定距离打数个小孔,在相邻的两孔内分别放入抗原和抗体材料。当抗原和抗体向四周凝胶中扩散,在两孔间可出现2~3条沉淀线,本法常用于抗原或抗体的定性或定量检测,或用于两种抗原材料的抗原相关性分析。
4.对流免疫电泳 是一种敏感快速的检测方法,即在电场作用下的双向琼脂扩散。将琼脂板放入电泳槽内,使琼脂板的两孔沿着电场的方向,于负极侧的孔内加入抗原,于正极侧的孔内加入抗体,通电后,抗原带负电荷向正极泳动,抗体分子虽也带负电荷,但因分子量大,向正极的位移小,而受琼脂中电渗作用向负极移动,抗原和抗体能较快地集中在两孔之间的琼脂中形成免疫复合物的沉淀线。只需1 h左右即可观察结果。
5.免疫电泳 免疫电泳的方法分成两个步骤,即先进行电泳,再进行琼脂扩散。先将样品加入琼脂中电泳,将抗原各成分依电泳速度不同而分散开。然后在适当的位置上沿电泳方向挖一直线形槽,于槽内加入含有针对各种抗原的混合抗体液,让各抗原成分与相应抗体进行双向琼脂扩散,可形成多条沉淀线。常用此法进行血清的蛋白种类分析,对于免疫球蛋白缺损或增多的等疾病的诊断或鉴别诊断有重要意义。
6.免疫印迹法 免疫印迹法为Western印迹法,用于AIDS的血清抗体检测。第一步,为电泳分离HIV抗原,在电场中根据分子量大小不同,病毒抗原各成分散开。第二步,将电泳分离的蛋白质转移到硝酸纤维膜上,再用酶标记免疫、放射免疫等技术进行检测。该法能对分子大小不同的蛋白质进行分离并确定其分子量和抗原特性,常用于病毒抗体或抗原的检测及目的基因表达产物的鉴定。
(二)凝集反应
细菌、红细胞或表面带有抗原的乳胶颗粒等都是不溶性的颗粒抗原,当与相应抗体结合形成凝集团块,即称为凝集反应(agglutination)。
1.直接凝集反应 是细菌或红细胞与相应抗体结合产生的细菌凝集或红细胞凝集现象,可用于传染病诊断,如肥达反应(Widal reaction),或利用血细胞凝集现象检查血型。
2.间接凝集反应 是用可溶性抗原或抗体与免疫无关的载体颗粒(如胶乳颗粒或红细胞)结合形成致敏颗粒后,再与相应抗体或抗原进行反应出现的凝集现象。将人IgG包被乳胶颗粒检测类风湿关节炎病人血清中的类风湿因子;用甲状腺球蛋白包被乳胶颗粒用于检测甲状腺球蛋白的抗体。也可以将抗体吸附到乳胶颗粒上检查临床标本中的抗原,如细菌或真菌性脑膜炎抗体包被的乳胶颗粒,一旦与含有相应抗原的脑脊液混合,便可发生凝集,可进行快速诊断。故凝集反应既可测定抗原,又可测定抗体,方法简便、敏感。
3.间接凝集抑制试验 是由间接凝集反应衍生而来。将待测可溶性抗原与相应抗体先行混合作用一定时间后,再加入相应抗原致敏的颗粒悬液,若待测抗原与抗体结合,则反应液中游离抗体不复存在,加入相应致敏颗粒就不会出现凝集现象。临床上常用此法进行妊娠诊断。
4.抗球蛋白试验 抗球蛋白试验(antiglobulin test,coombs test)的原理为间接凝集试验。例如,诊断自身免疫溶血性贫血症时,Rh+红细胞与抗Rh血清间的反应。因抗Rh抗体是IgG,只有两个结合价,分子较小(不如IgM结合价多,分子大)很难直接引起Rh+红细胞凝集。如果加入抗IgG的抗体,就可帮助抗Rh的IgG凝集红细胞,提高凝集反应的灵敏度。
(三)补体参与的抗原抗体反应
这一类反应是利用抗体与红细胞表面相应抗原结合后,可使反应体系中补体激活,导致红细胞破坏,出现溶血现象而建立的。补体结合试验和溶血空斑试验均为补体参与的实验。此外,HLA血清学分型法,即补体依赖的微量细胞毒试验也是补体参与的反应,但本试验破坏的靶细胞不是红细胞,而是淋巴细胞。补体结合试验曾广泛用来检测多种细菌、病毒的抗原或抗体,但因操作复杂,易受实验条件影响,目前已被其他方法取代。
(四)免疫标记技术
免疫标记技术是将抗原抗体反应与标记技术相结合,以检测抗原或抗体的一种试验方法。为提高抗原和抗体检测的灵敏性,可选用易显示的物质标记已知的抗原或抗体,通过检测标记物,间接测定待测抗体或抗原。常用的标记物有酶、荧光素、放射性核素、胶体金和铁蛋白等。
免疫标记技术极大地提高了抗原抗体反应的灵敏度,不但能对抗原或抗体进行定性和精确定量测定,而且借助光镜或电镜技术,能够观察抗原、抗体或抗原抗体复合物在组织细胞内的分布和定位。
1.酶联免疫测定法(enzyme immunoassay,EIA)其为当前应用最广泛的免疫检测方法。本法将抗原抗体反应的特异性与酶对底物高效催化作用结合起来,根据酶作用底物后显色,以颜色变化判断试验结果,可经酶标测定仪做定量分析,敏感度可达纳克水平。常用于标记的酶有辣根过氧化物酶、碱性磷酸酶等。它们与抗体结合不影响抗体活性。这些酶具有一定的稳定性,制成酶标抗体可保存较长时间。目前常用的方法有酶标免疫组化法和酶联免疫吸附法。前者测定细胞表面抗原或组织内的抗原;后者主要测定可溶性抗原或抗体。本法既没有放射性污染又不需昂贵的测试仪器,所以较放射免疫分析法更易推广。
(1)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)将抗原或抗体吸附在固相载体表面,使抗原抗体反应在固相载体表面进行,通过洗涤去除未与固相载体结合的游离成分,加底物显色进行测定。ELISA检测方法很多,简介如下。
夹心法:将已知的特异抗体包装在固相载体(塑料板凹孔或纸片)上,加入待检标本,标本中的抗原即可与载体上的抗体结合,洗去未结合的材料后加入该抗原的酶标记抗体,洗去未结合的酶标抗体,加底物显色,用酶免疫检测仪测量颜色的光密度,可定量测定抗原。
间接法:常用于检查特异性抗体。先将已知特异性抗原包被固相载体,加入待检标本(可能含有相应抗体),再加入酶标抗Ig的抗体(即第二抗体),洗涤后再加底物显色,根据颜色的光密度计算出标本中抗体的含量。
(2)BAS-ELISA 生物素(biotin)是广泛分布于动植物体内的一种生长因子,以辅酶形式参与各种羧化酶反应,又称为辅酶R或维生素H。亲和素(avidin)是卵白素和某些微生物中的一种蛋白质,由四个亚基单位组成,对生物素有高度亲和力。在一定条件下,生物素和亲和素均能与抗体、抗原或辣根过氧化酶偶联,而不影响其生物学活性。在生物素-亲和素系统(biotin avidin system,BAS)中,利用亲和素-生物素-酶三分子复合物追踪生物素标记的抗原或抗体,通过酶催化底物显色,可检出相应的抗体或抗原。鉴于抗原或抗体可偶联多个生物素,而且一个亲和素可结合4个生物素分子,因此本试验具有放大效应,可进一步提高检测的灵敏度。例如用此法检测抗原时,可先用已知特异性抗体包被固相,依次加入待测样品、生物素标记的特异性抗体、酶标记的亲和素、最后加底物显色。生物素也能结合核苷酸,因此BAS除用于抗原、抗体检测外,还可用于DNA和RNA的测定。
(3)酶联免疫斑点试验(enzyme linked immunospot assay,ELISPOT) 本试验基本原理是用已知抗细胞因子的抗体包被固相载体(硝酸纤维素膜/PVDF膜),加入待测细胞孵育一定时间后去除细胞,若待测细胞分泌的细胞因子与包被的抗体相对应,即可在细胞周围形成细胞因子(抗原)-抗体复合物。然后加入相应酶标抗细胞因子抗体,并通过底物显色,即可在分泌相应细胞因子的细胞所在处呈现有色斑点。一个斑点表示一个分泌相应细胞因子的细胞,通过计数可推算出分泌某种细胞因子细胞的频率。实验结果需在显微镜下观察,也可用专门仪器(ELISPOT分析系统)计数。酶联免疫斑点试验可直接用于检测T细胞分泌的单一细胞因子。本试验若用已知抗原包被相应载体,也可用来检测分泌特异性抗体的B细胞。
(4)酶免疫组化技术 酶免疫组化技术(immunohistochemistry technique)是用标记的已知抗体与组织或细胞表面抗原发生反应,结合形态学观察对抗原进行定性、定位或定量检测的技术。常用的免疫组化技术包括:酶免疫组化(辣根过氧化酶标记)、金免疫组化(胶体金颗粒标记),免疫电镜技术(铁蛋白、胶体金、过氧化酶标记)等。
2.免疫荧光技术 免疫荧光技术(immunofluorescence technique)是用化学方法使荧光素标记的抗体(或抗原)与组织或细胞中的相应抗原(或抗体)结合,进行定性定位检查抗原或抗体的方法。
(1)直接荧光法 把荧光抗体加到待检的细胞悬液,细胞涂片或组织切片上进行染色,经抗原抗体反应后,洗去未结合的荧光抗体,将待检标本在荧光显微镜下观察,有荧光的部位即有相应抗原存在,此法可用于病毒感染细胞、带某种特异抗原的细胞(如T细胞和B细胞)或病原菌的检查,也可用于组织中沉着的免疫复合物的检查。本法的缺点是检查多种抗原,就需分别制备相应的多种标记抗体。
(2)间接荧光法 可克服直接法需制备多种荧光抗体的复杂操作。将组织或细胞上的抗原直接与相应抗体(不标记荧光)结合,此为第一抗体,再把能与第一抗体特异结合的荧光标记的抗免疫球蛋白抗体加入,此为荧光标记的第二抗体,结果观察与直接法相同。间接法比直接法敏感性高,如果用于检测抗原的第一抗体是人或动物的只需制备一种抗人或动物的免疫球蛋白荧光抗体。
免疫荧光技术在传染病诊断上有广泛的用途,如在细菌、病毒、螺旋体等感染性疾病的检测,如查出IgM抗体,可作为近期接触抗原的标志。除微生物学方面的应用外,还可利用单克隆抗体鉴定淋巴细胞的亚类。使用流式细胞仪(fluorescene-activated cell sorting,FACS),能自动检测细胞的大小、荧光强度。针对细胞表面不同抗原,可以使用两种不同的荧光染料,对同一细胞进行双标记染色,这对淋巴细胞亚类鉴定起着巨大推动作用。间接荧光法也用于自身免疫病的抗核抗体检查。
3.放射免疫测定法(radioimmunoassay,RIA)应用竞争性结合的原理,用放射性核素标记抗原(或抗体),与相应抗体(或抗原)结合,通过测定抗原抗体结合物的放射活性判断结果,包括液相法和固相法两种检测方法,具有敏感性高、重复性好、准确性高等优点,因此常用于激素药物等微量物质的检测。但放射性核素对人有一定的危害性,且易污染环境,因此其应用受到一定限制。常用的放射性核素有125 I、131 I、3 H、14 C、32 P等。
第二节 免疫细胞的测定
检测各群体淋巴细胞的数量与功能是观察机体免疫状态的重要手段。外周血是病人主要的检测标本。实验动物还可取胸腺、脾、淋巴结等作为标本进行检查。
一、淋巴细胞的分离与类型鉴定
体外检测淋巴细胞,首先需制备外周血单核细胞(peripheral blood mononuclear cell, PBMC),常用的方法是葡聚糖-泛影葡胺(又称淋巴细胞分离液)密度梯度离心法。用该法去除红细胞、粒细胞等成分后,即为PBMG,分离纯度可达95%。若需纯化的淋巴细胞,可将PBMC堆于培养皿上,由于单核细胞易吸附玻璃或塑料而贴附于平皿上,收集未贴附的细胞即为富含淋巴细胞的悬液。若要分离T细胞,可用多种方法。如尼龙毛分离,可利用B细胞、单核细胞等能吸附尼龙毛的特性,将PBMC通过尼龙毛柱时B细胞吸附于柱上,T细胞被洗脱分离;应用抗CD3单克隆抗体的贴附法及应用T细胞表面的CD2能结合绵羊红细胞(SRBC),使其形成花结(E花结试验),比重增大,用密度梯度离心法将其与其他细胞分离。以下方法通过检测淋巴细胞的某些表面标志,可确定细胞的不同类型的比例。
1.免疫荧光法 常用直接或间接免疫荧光法检查淋巴细胞的表面标志,鉴定细胞的群、亚群。如CD4+和CD8+细胞亚群,表达m IgD、m IgM的B细胞等。
2.磁珠分离法 将已知抗细胞表面标记的抗体交联于称为微珠(平均直径小于1.5μm)的磁性颗粒,与细胞悬液反应后,磁珠借抗体结合于相应细胞群或亚群表面。再将细胞悬液加于一试管内并置磁场中,因磁珠被磁场吸引,将磁珠结合的细胞与未结合磁珠的细胞分开。例如,用抗CD4交联的磁珠可将T细胞中的CD4+ T细胞与CD8+ T细胞分开,从而获得高纯度的CD4+ T细胞。
3.淘选法 将已知抗细胞表面标记的抗体包被培养皿,加入淋巴细胞悬液,表达相应表面标记的细胞即与相应抗体结合,而贴附于固相上,与悬液中的其他细胞分开。例如,用抗CD4抗体包被培养皿,可将CD4+ T细胞与其他T细胞分开。采用间接法时,则将二抗包被聚苯乙烯培养皿,加入已与一抗结合的细胞,获得同样分离效果,而且在实际工作中更常用。
4.流式细胞术(flow cytometry) 是借助荧光激活细胞分选器(fluorescence activated cell sorter,FACS)对免疫细胞及其他细胞进行快速准确鉴定和分类的技术。流式细胞仪集光学、流体力学、电子学和计算机技术一体,对细胞作多参数定量测定和综合分析,包括细胞大小、核型、表面分子种类等。将样品制备成单细胞悬液,经一种或多种荧光素标记的抗体染色,在压力作用下细胞排成单列经喷嘴喷出,形成细胞液柱。液柱与高速聚焦激光束相交,相交点称为测量区,细胞经过该区时产生散射光并散发荧光,被光电检测器接收后将光信号转换成电信号,经加工处理存储于计算机中,再用分析软件对数据作图像显示、统计处理,可快速准确获取结果。该法可检测T细胞、B细胞、NK细胞、单核-巨噬细胞、树突状细胞等及其比例,CD4/CD8T细胞比值,以及白血病、淋巴瘤的免疫学分型。此外,可借助光电效应,微滴通过电场时出现不同偏向,因此可分类收集所需的细胞群或亚群。该技术能以每秒约5000~10 000个细胞的速度无菌收集细胞,分选纯度在95%以上,而且可保持细胞活性,供进一步研究使用。
5.抗原肽-MHC分子四聚体技术 四聚体(tetramer)技术的原理是用生物素化的抗原肽-MHC分子复合物与荧光标记的亲合素结合,由于1个荧光素标记的亲合素可结合4个生物素分子,能使4个MHC/抗原肽复合物形成一个复合体,将该复合体标记荧光素后,即成抗原特异性四聚体。抗原特异性四聚体能与样品中的特异性T细胞的TCR结合,由于四聚体能同时结合一个T细胞表面的4个TCR,亲和力大大提高。用流式细胞术即可确定待检标本中抗原特异性CTL细胞的频率。MHC分子可为Ⅰ类或Ⅱ类分子,与抗原肽形成四聚体复合物,可分别鉴定表达特异性TCR的CD8+ T细胞及CD4+ T细胞的频率。
二、免疫细胞功能测定
细胞免疫涉及多种免疫细胞的相互作用和多种细胞因子的参与,功能测定的指标体系复杂,方法不易标准化。
(一)T细胞功能测定
1.T细胞增殖试验 植物血凝素(PHA)、刀豆蛋白(Con A)等丝裂原以及抗CD3单克隆抗体等能非特异地活化培养的T细胞,并使其增殖。在增殖过程中细胞DNA、RNA、蛋白质的合成增加,细胞形态改变,最终细胞分裂。
(1)3 H-TdR掺入法 在PBMC中加入PHA共同培养,终止培养前8~15 h加入氚标记的胸腺嘧啶核苷(3 H-TdR),由于3 H-TdR能掺入细胞合成的DNA中,细胞增殖水平越高,掺入的放射性核素越多。培养结束后收集细胞,用液体闪烁仪测定样品的放射活性,反映细胞的增殖状况。该法灵敏可靠,应用广泛,但需特殊仪器,易有放射性污染。
(2)MTT法 MTT是一种噻唑盐,化学名3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化噻唑。在细胞培养终止前数小时加入的MTT,作为细胞内线粒体琥珀酸脱氢酶的底物参与反应,形成紫蓝色的甲 颗粒并沉积于细胞内或细胞周围。甲 可被随后加入的盐酸异丙醇或二甲基亚砜完全溶解,可用酶标测定仪测定细胞培养物的OD值。因甲
的生成量与细胞增殖水平正相关,故OD值反映细胞增殖水平的高低。该法也用于某些细胞因子活性的测定(细胞因子依赖的细胞株增殖法)。MTT法敏感性虽不及3 HTdR掺入法,但操作简便,无放射性污染。
T细胞增殖试验也可检测特异抗原致敏的T细胞,在培养细胞中加入特异性抗原,则只有该抗原特异的T细胞发生增殖反应,从而反映机体特异的细胞免疫功能。
2.细胞毒试验 CTL、NK细胞对靶细胞有直接杀伤作用,可根据待检效应细胞的性质,选用相应的靶细胞,如肿瘤细胞、移植供体细胞等。该试验用于肿瘤免疫、移植排斥反应、病毒感染等方面的研究。
(1)51 Cr释放法 用 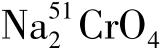 标记靶细胞,若待检效应细胞能杀伤靶细胞,则51 Cr从靶细胞内释出。以γ计数仪测定释出的51 Cr放射活性,靶细胞溶解破坏越多,51 Cr释放越多,上清液的放射活性越高。应用公式可计算出待检细胞的杀伤活性。
标记靶细胞,若待检效应细胞能杀伤靶细胞,则51 Cr从靶细胞内释出。以γ计数仪测定释出的51 Cr放射活性,靶细胞溶解破坏越多,51 Cr释放越多,上清液的放射活性越高。应用公式可计算出待检细胞的杀伤活性。
(2)乳酸脱氢酶释放法 将效应细胞与靶细胞按比例混合,靶细胞被杀伤后细胞膜受损,释放出乳酸脱氢酶,用光度计测定溶液中该酶的含量,反映效应细胞的杀伤活性。
(3)凋亡细胞检查法 靶细胞被细胞毒性细胞杀伤后,可发生细胞凋亡,DNA广泛断裂,检查靶细胞凋亡有多种方法。①琼脂糖电泳法:因凋亡细胞DNA被核酸酶在核小体单位之间随机切断,产生180~200 bp(核小体单位长度)及其倍数的寡核苷酸片断,在琼脂糖电泳中呈现阶梯状DNA区带图谱,借此可反映细胞凋亡。②TUNEL法:在细胞培养物中加入末端脱氧核苷酸转移酶(terminal deoxyribonucleotidyl transferase,TdT)和生物素标记的核苷酸,TdT能在游离的DNA3端缺口连接上标记的核苷酸,利用亲和素-生物素-酶放大系统,在DNA断裂处显色,从而指示凋亡细胞。正常细胞无DNA断裂,则不显色。将待检细胞和靶细胞按比例混合,培养一定时间后取培养物涂片,加入TdT和其他试剂,光镜下检查计数凋亡细胞,反映待检细胞的杀伤活性。该法所用标记核苷酸多为dUTP,故称TUNEL法(TdTmediated dUTP-biotin nick end labeling)。③流式细胞术:凋亡细胞因核断裂,呈亚二倍体,用FACS分析亚二倍体数目,指示细胞凋亡程度;因凋亡细胞的细胞膜受损,膜磷脂成分暴露,可与荧光标记的膜联合蛋白(annexing V)结合,用FACS分析,可检测悬浮细胞中凋亡细胞的频率。
3.细胞因子检测 细胞因子的检测有助于了解其在免疫调节中的作用,鉴定分离的淋巴细胞,监测某些疾病状态的细胞免疫功能。例如,根据培养的CD4+细胞分泌的细胞因子确定细胞亚群,产生IL-12、IFN-γ者为Th1,产生IL-4、IL-10者为Th2;艾滋病患者IL-2水平明显降低,而类风湿性关节炎、多发性硬化、移植排斥反应等患者则升高。细胞因子的检测方法可分以下三种。
(1)免疫学检测法 如用细胞因子单隆抗体包被固相的双抗体夹心法或ELISPOT测定法。亦可用荧光素标记细胞因子抗体,对细胞内细胞因子作染色,直接用FACS分析法测定产生该细胞因子的细胞比例。
(2)生物活性测定法 可根据细胞因子的生物学活性,选用相应的实验系统,包括细胞增殖法、直接杀伤法、保护细胞免受病毒致病变法等。如选用细胞因子依赖的细胞株,其增殖反应水平与细胞因子的含量成正相关,根据细胞株的增殖水平可确定样品中细胞因子的含量。如IL-1、IL-2、IL-4、IL-6的检测。
(3)聚合酶链反应(PCR)根据编码细胞因子的核酸序列,设计特定细胞因子cDNA的引物,利用逆转录PCR测定待检细胞中特异的mRNA。该法可用于多种细胞因子的测定。
4.皮肤试验 正常机体建立了对某种抗原的细胞免疫后,用相同抗原作皮肤试验时即出现以局部红肿为特征的迟发型超敏反应。细胞免疫正常者出现阳性反应,而细胞免疫低下者则呈阴性反应。皮肤试验方法简便,可帮助诊断某些病原微生物感染(结核杆菌、麻风杆菌)、免疫缺陷病等,以及疫功接种后的免疫效果(如卡介苗)。皮肤试验常用的生物性抗原常从病原体中提取,如结核菌素、麻风菌素、链激酶一链道酶、念珠菌素、腮腺炎病毒等。
(二)B细胞功能测定
B细胞介导体液免疫,检查B细胞的数量与功能是确定体液免疫正常与否的重要手段之一。原发性体液免疫缺陷可由B细胞缺失、B细胞分化障碍以及T细胞缺陷所致。在诊断原发性体液免疫缺陷时除检查血清Ig外,B细胞的检查可确定缺陷的原因。
1.B细胞增殖试验 B细胞受丝裂原刺激后,进行分裂增殖,温育一定时间后检查抗体形成细胞的数目。小鼠B细胞可用细菌脂多糖为刺激物,人则用含有金黄色葡萄球菌蛋白A(SPA)的金黄色葡萄球菌菌体及抗IgM抗体刺激。
2.抗体形成细胞测定常用溶血空斑试验(hemolytic plaque assay),即测定对SRBC上的抗原产生的抗体形成细胞数目。其基本原理是抗体形成细胞分泌的Ig与SRBC上的抗原结合,在补体参与下出现溶血反应。方法是将SRBC或吸附有已知抗原的SRBC、待检的B细胞、补体及适量琼脂糖液混合,倾注平皿,温育1~3 h后,肉眼可见有分散的溶血空斑出现,每一空斑中央含一个抗体形成细胞,空斑的数量即为抗体形成细胞数。此外,也可用ELISPOT法检查特异抗体形成细胞。
(三)吞噬细胞功能测定
吞噬细胞包括中性粒细胞和巨噬细胞,人吞噬细胞功能试验常用中性粒细胞。用外周血单个核细胞分离的方法,收集红细胞上层即为中性粒细胞。
1.趋化功能测定 中性粒细胞在趋化因子(如补体产物、趋化性细胞因子等)作用下可定向运动,通过观察中性粒细胞的运动情况可判定结果。
(1)Boyden小室法 由上下两室组成,室间隔以8μm的微孔滤膜,将检测细胞置于上室,趋化因子置于下室。细胞沉降至滤膜上,如受趋化因子吸引,细胞则可通过微孔爬行于滤膜趋化因子侧的面上,将滤膜取下,染色、细胞计数,即可知细胞趋化的情况。本法除用于吞噬细胞趋化外,还可用于淋巴细胞和其他细胞的趋化功能测定。
(2)琼脂糖凝胶法 制备琼脂糖凝胶板,用打孔器打3个孔,中央孔加粒细胞悬液,两侧孔分别加趋化因子和生理盐水对照,经数小时温育后用戊二醛固定,移去琼脂糖,对黏附在玻片上的细胞染色,观察被检细胞的趋化程度。
(3)过氧化物酶测定法 采用滤膜渗透法。当中性粒细胞向含趋化因子的培养小室运动后终止培养,因中性粒细胞内含有过氧化物酶,溶解细胞后,加入该酶的底物二甲氧基苯胺,405 nm波长比色,测定培养小室中的过氧化物酶含量,以反映中性粒细胞的趋化活性。
2.吞噬功能测定
(1)硝基蓝四氮唑试验 在抗凝全血或白细胞悬液中加入硝基蓝四氮唑(nitroblue tetrazoli-um NBT)溶液,由于中性粒细胞在杀菌过程中产生反应性氧中间物(ROI),其中超氧阴离子 能使被吞噬进细胞内的NBT还原成不溶解的暗蓝色甲 ,沉积于细胞浆中,称NBT阳性细胞。光镜下计数NBT阳性细胞,其百分率可反映中性粒细胞的杀伤功能。
能使被吞噬进细胞内的NBT还原成不溶解的暗蓝色甲 ,沉积于细胞浆中,称NBT阳性细胞。光镜下计数NBT阳性细胞,其百分率可反映中性粒细胞的杀伤功能。
(2)荧光标记物试验 将荧光素标记的生物颗粒(如大肠杆菌、白色念珠菌等)与白细胞悬液混合,温育一定时间后加入台盼蓝并洗涤,以去除被吞噬的荧光颗粒,离心收集细胞,重悬后用荧光分光光度计定量分析。
(靳 静)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















