第三节 M HC分子结构、分布与功能
一、M HC分子的结构与分布
(一)M HC-Ⅰ类分子的结构与分布
M HC-Ⅰ类分子属糖蛋白,由一条重链(跨膜成分,44kD 367个aa)和一条轻链(非跨膜成分,12kD 99个aa)以非共价键连接而成,其结构示意图如图7-5所示。具多态性的重链也称为α链,包括α1、α2与α3结构域,其中α1、α2结构域共同构成抗原(肽)结合槽;轻链即β-2微球蛋白(microglobulin,β2m),乃由位于第15号染色体的非M HC基因所编码,与重链的α3同属免疫球蛋白超家族。β2m无多态性,其以非共价键与α链胞外段相互作用,有助于维持Ⅰ类分子天然构型的稳定性。
Ⅰ类分子分四个区:
(1)肽结合区:位于N端,有α1、α2两个功能区。含有与Ag结合的部位,是同种异型Ag决定簇存在的部位。
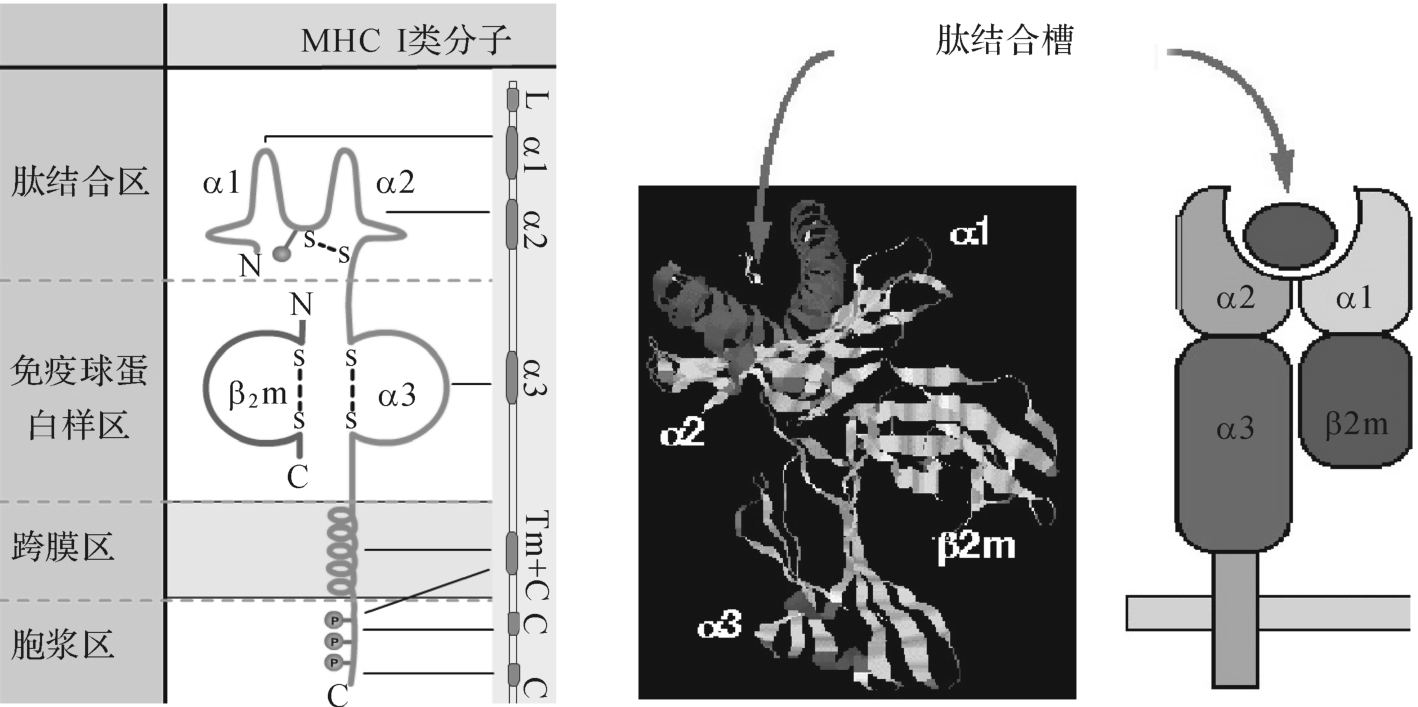
图7-5 M HC-Ⅰ类分子结构示意图
(2)Ig样区:重链α3、β2 的微球蛋白,α3有90个aa与CD8结合,起黏附作用。
(3)跨膜区:25个氨基酸形成α-螺旋,使Ⅰ类分子固定在细胞膜上。
(4)胞浆区:30个氨基酸,含较多苏氨酸、酪氨酸、丝氨酸,发生磷酸化。
借助X光衍射技术分析Ⅰ类分子空间结构,发现其重链胞外段存在一底部由8条反向平行β片层、边缘由2个α螺旋构成的抗原结合槽,可容纳含8~10个氨基酸残基(或稍长)的多肽片段。抗原结合槽中关键位点的氨基酸残基不同,导致抗原结合槽精细结构、电荷分布各异,从而形成M HC的多态性,以及I类分子与抗原肽结合的相对专一选择性和亲和力。
M HC-Ⅰ类分子主要分布于机体所有有核细胞表面(包括血小板和网织红细胞),以淋巴细胞表面Ⅰ类分子的密度最大,其次为肾、肝及心脏,密度最低的为肌肉和神经组织。此外,血清、初乳及尿液中还存在可溶性的Ⅰ类分子。
(二)M HC-Ⅱ类分子的结构与分布
M HC-Ⅱ类分子属糖蛋白,乃由α(32-34kD)和β(29-32 kD)两条肽链以非共价键连接而成,如图7-6所示。如同Ⅰ类分子,Ⅱ类分子也属免疫球蛋白超家族,但其两条链均为跨膜成分。Ⅱ类分子的抗原结合槽为开端结构,故可结合较长(约13~17个氨基酸残基)肽段。Ⅱ类分子分为四个区:
(1)肽结合区(α1,β1):两条螺旋末端开放,可结合14-18个氨基酸,最长可达30个氨基酸。
(2)Ig样区(α2,β2):与CD4结合。
(3)跨膜区:25个疏水性氨基酸。
(4)胞浆区:10-15个氨基酸。
M HC-Ⅱ类分子仅表达于专职抗原递呈细胞(B细胞、巨噬细胞、树突状细胞、朗格汉斯细胞)以及活化的T细胞和胸腺上皮细胞等表面。
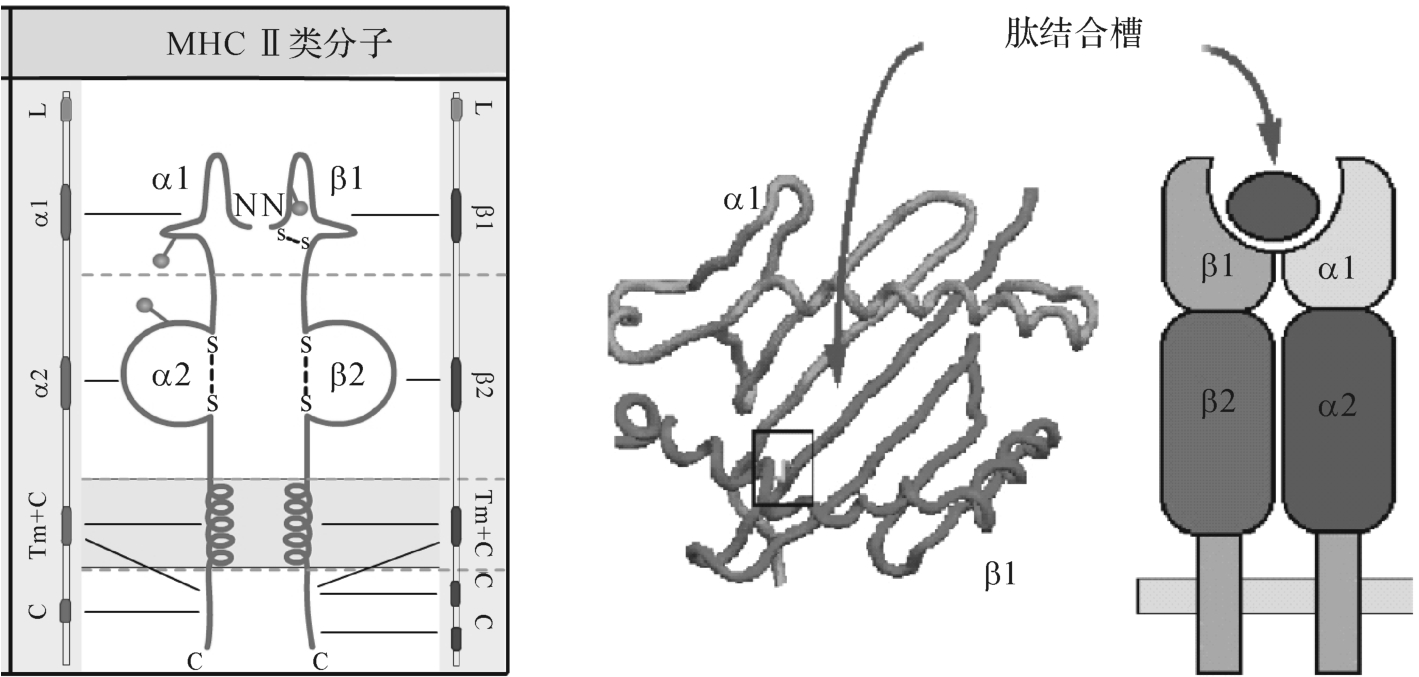
图7-6 M HC-Ⅱ类分子结构示意图
二、M HC分子的功能
(一)参与加工与递呈抗原
M HC-Ⅰ类分子和Ⅱ类分子分别参与对内源性和外源性抗原的加工和递呈,如图7-7所示。内源性或外源性抗原被加工成为肽段,嵌入M HC-Ⅰ(或Ⅱ)类分子抗原结合槽中,形成抗原肽/M HC-Ⅰ(或Ⅱ)类分子复合物,进而表达于抗原递呈细胞表面供CD8+T或CD4+T细胞的TCR识别。
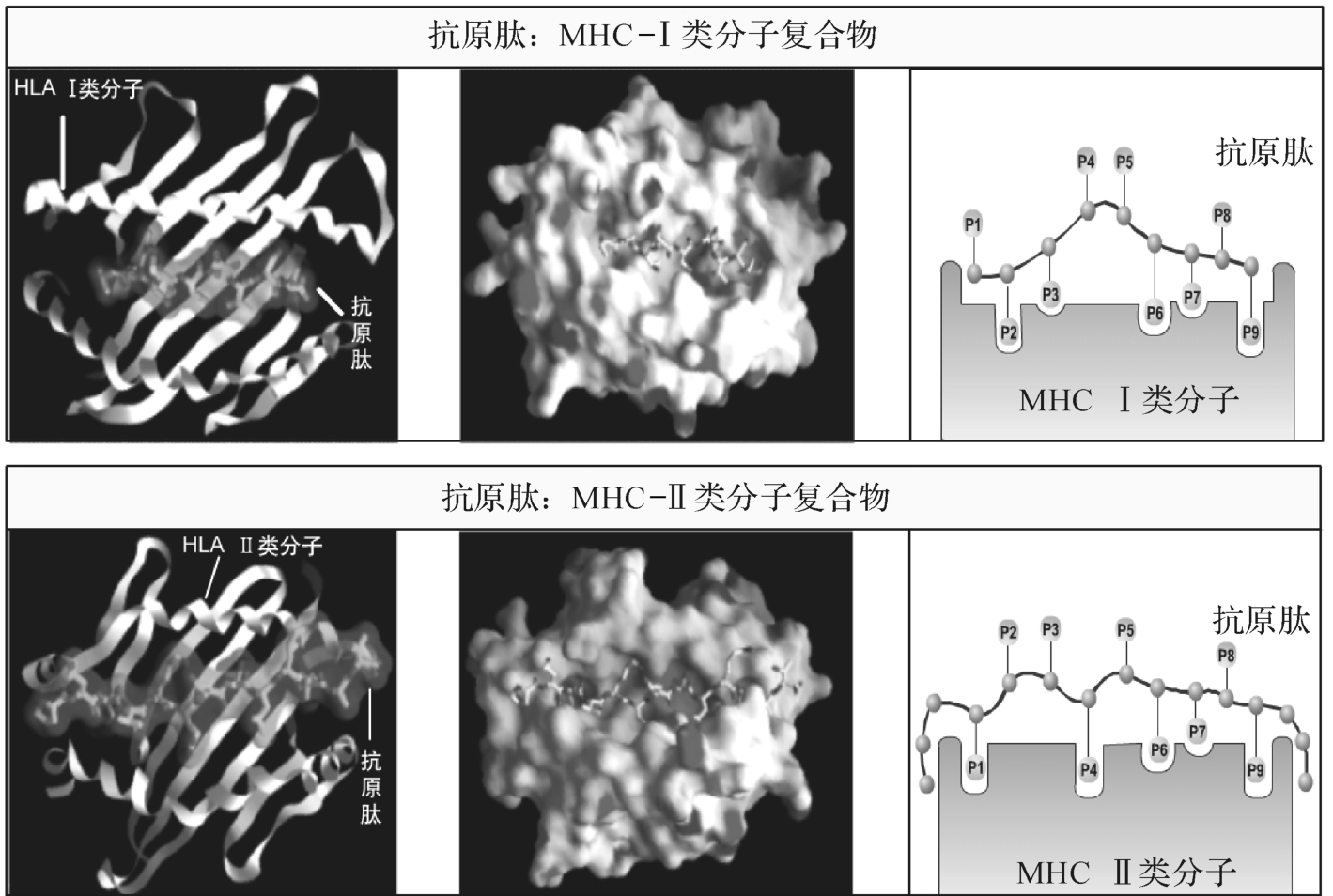
图7-7 抗原肽与M HC-I、II类分子结合示意图
在抗原肽-M HC分子复合物中,抗原肽的两个或两个以上专司与M HC分子结合的氨基酸残基称为锚着残基(anchor residue),M HC分子抗原结合槽与抗原肽锚着残基相对应的氨基酸残基称为锚着位(pocket)。
(二)参与T细胞限制性识别
TCR在识别抗原肽的同时,还须识别与抗原肽结合的同基因型M HC分子,此即M HC限制性(M HC restriction)(图7-8)。CD8+T细胞在识别抗原肽的同时,须识别M HC-Ⅰ类分子,此为M HC-Ⅰ类限制性;CD4+T细胞在识别抗原肽的同时,须识别M HC-Ⅱ类分子,此即M HC-Ⅱ类限制性。
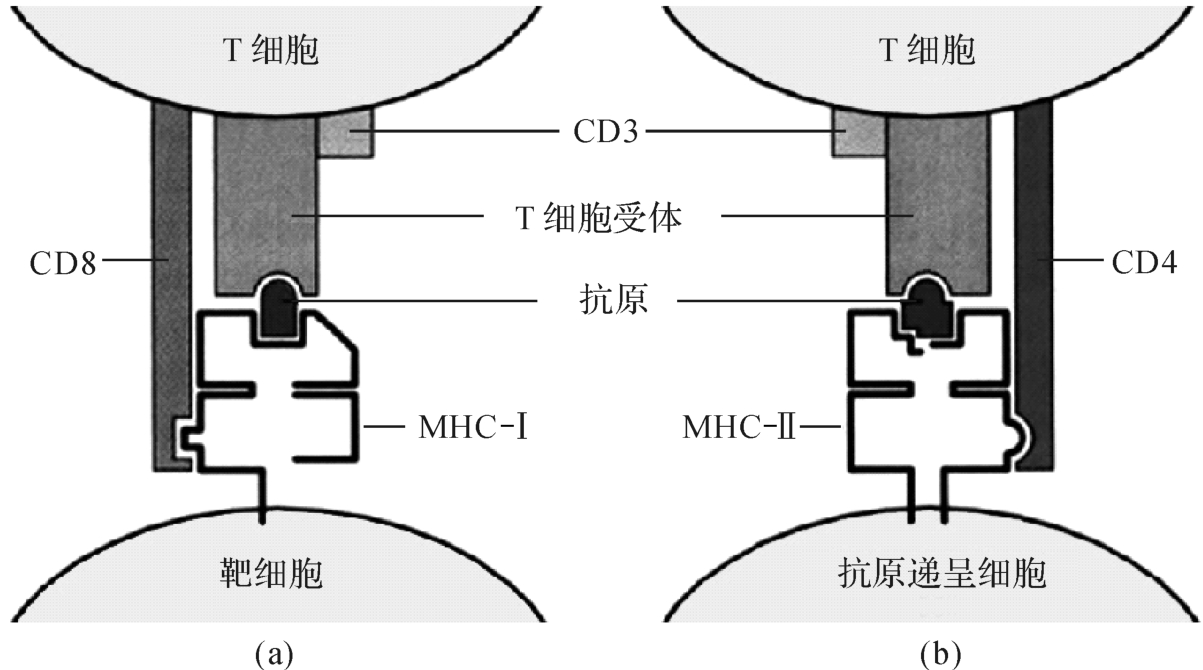
图7-8 M HC限制性
(三)参与T细胞在胸腺的发育
T细胞在胸腺中的发育涉及复杂的选择过程,无论是阳性选择或阴性选择,均有赖于M HC-Ⅰ类和Ⅱ类分子参与。
(四)诱导同种移植排斥反应
同种异型M HC分子是介导移植排斥反应的关键分子,供、受者间M HC不匹配可导致移植排斥反应。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















