第二章 超速离心机
试图用沉降和扩散的数据来算出胶体颗粒的重量,可追溯到二十世纪初的头十年(佩林,1908;米利肯,1910;斯维德伯格和埃斯特鲁普,1911)。稍后,采用了沉降平衡法(韦斯特格伦,1913)。这里用的都是大而稠密的全胶颗粒,在地球引力场里,溶胶颗粒下降速率在几天后才可测出。比较小的蛋白质和核酸颗粒,要求强得多的引力场。虽然在二十世纪的二十年代里,用普通的台式离心机得到了比较小的颗粒,但由于出现了对流,沉降蛋白质和核酸颗粒的努力归于失败。总之,对一般的蛋白质来说,这些引力场太弱了,直到1924年斯维德伯格造出了第一台“超速离心机”并成功地用它测定了蛋白质的分子量,后来又测得了核酸的分子量(见表2.1)。起先他致力于卵清蛋白,根据它的含硫量假定其相对分子质量为34000。得到的结果很难解释。后来选定血红蛋白,由于它的相对分子质量据认为只有16000,所以开始时他把它排除在外,以后听从了罗宾·法劳乌斯的意见,斯维德伯格才决定一试。他告诉蒂西利厄斯和克拉森,他在半夜里被法劳乌斯打来的电话吵醒,法劳乌斯守候着离心机运转并大声喊叫:“喂,斯维德伯格,我看到苗头了!”斯维德伯格急忙赶到研究所,他看到离心管的顶部确实有颜色在发亮,血红蛋白在沉降下来(蒂西利厄斯和克拉森,1965,4)。
因为它产生一个非常明显的界面(用吸收光学系统),这不同于人造的全胶非均匀系统,所以斯维德伯格和法劳乌斯推断他们所处理的是一种均匀的分子——单分散系统。当他们完成了平衡流动时,这个推断得到了有力的支持。在平衡流动情况下,沉降趋势同扩散趋势达到平衡,结果就不形成界面。在离开旋转轴不同距离上用光学方法测出试管里的血红蛋白浓度,并算出这些距离上的溶质的分子量。斯维德伯格和法劳乌斯论证说,如果他们处理的是一种多分散系统,他们测得的分子量就应有一种系统误差,可是他们没有碰到这种情况(见表2.2)。血红蛋白的精确的相对分子质量约为最小相对分子质量16700的4倍,看来是很少有疑问的。他们又研究了另外一些蛋白质,其中蜗牛的血清蛋白测得的值为5000000,然而根据它的含铜量来看,认为它的相对分子质量在15000~17000之间。
表2.1 蛋白质的分子量
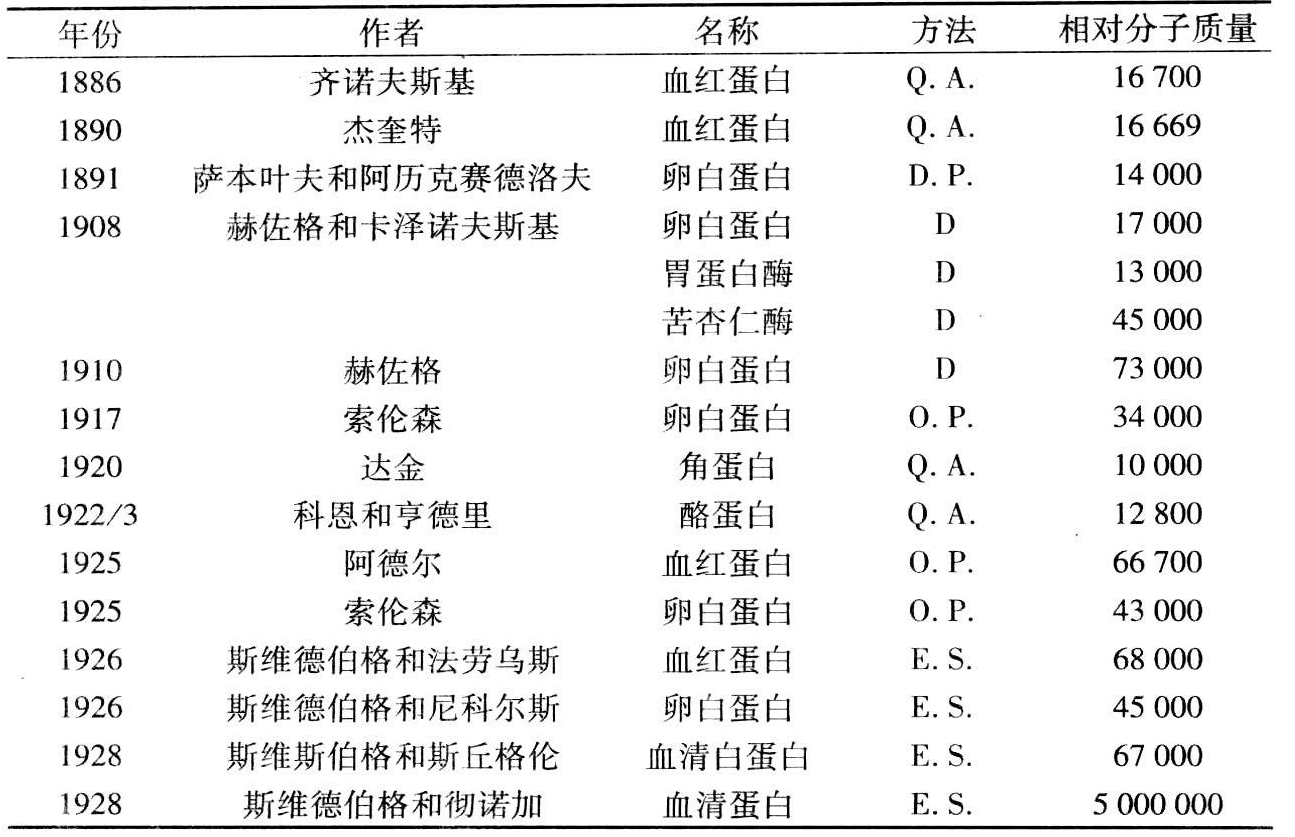
(D=扩散;D.P.=冰点下降;E.S.=平衡沉降;O.P.=渗透压;Q.A.=定量分析)。
表2.2 沉降平均测得的一氧化碳-血红蛋白的分子量

(引自斯维德伯格和法劳乌斯,1926,表1)。
斯维德伯格的倍数律
三十年代中,确信蛋白质是一种真正的分子的信念日益加强,以致皇家学会于1938年认识到召开一天会议讨论“蛋白质分子”是合适的。斯维德伯格在开幕词中指出,如在几年前提议召开这样一次会议“将被认为是荒唐的”。他接着说,可是现在,
我们有理由相信:蛋白质溶液和蛋白质晶体里的颗粒是按照一种计划构成的,根据这种计划,每一个原子对于结构的完成都是必不可少的。哪怕只是去掉一个原子,也就会失去个体性……因此,蛋白质反应必定服从量子力学定律的基本作用。
(斯维德伯格,1939,40~41)
不幸的是,斯维德伯格对于他自己的超速离心数据的意义过于自负了,在解释这些数据时有点过头了。早在1929年,他发现他能把蛋白质的分子量按大小排成一个次序,因为他得到的沉降数据是卵白蛋白分子量(34500)的不同倍数。这一发现使他十分兴奋。从两年前在瑞典访问他的情况看,即使在那时他显然还是从蛋白质是按照一种通用的计划来构造的思路进行思考的(参阅佩德森,1940,406)。英国结晶学家W.T.阿斯特伯里很快接受了这个观点,并试图赋予n,2n,3n和6n(这里n=35000)等斯维德伯格的类别以结晶学的意义(阿斯特伯里和伍兹,1931)。一位在英国工作的南美数学家多萝西·林奇,提出了相当于斯维德伯格的基本单位的“笼状”结构或“圆圈状”结构。但出现了更糟糕的情况!伯克曼和尼曼试图使斯维德伯格的由288个氨基酸组成的单位,以及这个单位中每一种氨基酸的数目符合2m×3n的乘积这一数学定律,在这里,m和n可以是零或是正整数(见第七章)。希望发现蛋白质结构等级的愿望是如此强烈,以致走了想象中的捷径和奋力排除各种阻难。
纽伯格和贝尔纳在1938年皇家学会召开的蛋白质会议上发表了反对意见。后者于1939年在皇家学院讲演时,重复了他对“圆圈”理论的批评。当时主要的抨击来自《科学》杂志上发表文章的波林和尼曼(此时他已到加州理工学院,并且抛弃伯克曼的频率假说)。他们在文章结尾处,提到了斯维德伯格的由288个氨基酸残基构成的单位。他们不认为“这个数目是精确的。可以预料肽链末端的结构会有某种变化”。他们认为:
存在这些蛋白质的分子量(或残基数目),不大可能是由于这些分子的热力学稳定性大于较大较小的相似分子的缘故,因为这里没有那种已知的原子间的力可使某种大小的分子出现这种更大的稳定性。这种现象也许要给予生物学的而不是化学的解释——我们认为蛋白质分子量之所以有等级,是由于在物种长期进化过程中,保留了这种蛋白质属性。
(波林和尼曼,1939,1867)
溶液中大分子的形状
当斯托丁格用黏度作为分子大小的一个指标时,他是反对了胶体科学家们所持的传统观点,即溶液的黏度和浓度之间没有线性关系的观点。关于分子量同黏度之间关系的爱因斯坦-斯姆罗乔末斯基公式只适用于球状分子。胶体颗粒的形状不是球状,其他方面又不同于牛顿液体,所以这个公式是不适用的。在这些情况下,黏度不可能同分子量有关。
斯托丁格采取“以其人之道反治其人之身”的方法,来抨击反对意见。如果普通的低分子量化合物同高分子量化合物的区别,被看作是造成它们在溶液中的黏度的原因,那么它们都服从爱因斯坦定律吗?如他所预料的,低分子的线状链化合物并不遵循这个定律。反之,在黏度和链的长度之间呈比例关系。1929年和1930年,他的学生R.诺楚和E.奥巧阿报告了他们关于石蜡溶液和肥皂溶液的实验,以支持这种关系。为了确定这种关系,斯托丁格目前所需要的是一种估计分子量的独立的方法。最明显的选择是斯维德伯格的超速离心机。赛纳刚从访问斯德哥尔摩和曼彻斯特回来。在斯德哥尔摩,他熟悉了超速离心机的使用。但是,德国科学临时协会拒绝了斯托丁格申请拨款购买这种仪器。玛格达·斯托丁格能够回忆起1929年秋,在舍恩伯格附近偕同她丈夫的一次美好的周末散步。斯托丁格刚刚知道当局的决定。当局显然认为用这种尖端而昂贵的新仪器去研究多聚物的大小,是在浪费时间。他十分愤怒。在散步时,他们的谈话转到了黏度,末端基团分析和渗透压测定。当他们在傍晚六时左右折返回家后,斯托丁格“坐在桌旁开始写作和思考。凌晨二时许,在他面前的桌上放着黏度公式”(M.斯托丁格,1969)。这就是表示分子量同特殊黏度ηsp之间关系的有关的斯托丁格定律。ηsp代表液体由于加入每单位浓度的溶质分子后黏度的相对增加。
流动双折射
了解大分子的形状,对黏度测定和超速离心都极其重要。用后一种技术时,如果已知长度与阔度之比,则沉降速率只能用来计算分子量(这不是指平衡沉降而言)。因此,斯托丁格的同事鲁道夫·西格纳根据流动双折射,设计了一种非常简便的技术。弗洛恩德利希已证明,用超显微镜观察时,V2O5溶胶中的五氧化二钒颗粒呈针状,且表现出正流动双折射。这就是说,当用光照溶液时,透过溶液的光线偏振成相互垂直的两个平面,非寻常光的折射指数大于寻常光(弗洛恩德利希,1916)。威纳已预料轴线全是平行的杆棒系统,浸入折射指数不同的介质中会出现这种情况(威纳,1912)图2.1表明两种排列。他预料,一个叠一个的碟状结构是负的双折射,因为仪器太简陋,所以弗洛恩德利希在纤维素的衍生物中看不到双折射,这种衍生物是真正的分子,比五氧化二钒胶体颗粒要小得多。赛纳设计的仪器克服了这一缺点。在两个紧贴的同轴圆筒之间,可以产生非常高的流动变化率。
可能是在1936年,瑞典的细胞化学家卡斯帕森从斯德哥尔摩到伯恩,用西格纳的仪器去研究在卡洛琳斯卡研究所提取的高度聚合的胸腺核酸(DNA)。他早已知道在1927年,鲁恩斯特罗姆已粗放地验证了胸腺核酸的流动双折射。现在他可以同西格纳一起测定长阔之比。比值为300∶1。根据胸腺核酸的黏度,他们估计相对分子质量在50万~100万之间。他们也注意到双折射是负的,因此提示它是像威纳提出的一种叠碟状结构。他们的结论是,分子“必定包含着按一定型式排列的具有强烈双折射的组成成分。嘌呤环和嘧啶环显然处在垂直于分子纵轴的平面中”(西格纳、卡斯帕森和哈默斯坦,1938)。这个经验对西格纳是有影响的。在看了1946年实验生物学学会在剑桥召开的核酸讨论会会议记录后,他着手改进提取DNA的程序,最后写成了1950年施万达尔和他在伦敦分发的著名论文(见第十九章)。

图2.1 杆棒(a)和碟(b)的复合系统。虚线表明纤丝轴的方向(引自奥斯特,1955,446)。
另外,根据流动双折射取得了病毒颗粒并非都是球状的第一个证据。高桥和罗林斯运用毛细流动技术,根据烟草花叶病毒颗粒在受感染树汁中是正双折射(1932;1933)以及根据抽提的核蛋白颗粒(1937),证明这种病毒颗粒呈棒状。接着用黏度进行的研究得出了长阔之比,根据这个数据,可用已知的沉降速率得出可靠的分子量(劳弗和斯坦利,1938)。最后,我们可能注意到,威尔金斯根据双折射的研究得出了有关DNA的分子内结构的一些最初的想法(见第十九章)。
经典化学和大分子化学的结合
可以看出在二十世纪二十年代中,有机化学家对大分子化学是怎样地不屑一顾。斯托丁格作出了极大努力,而他的友人却劝他不要从事这方面的研究。“我的同事对从低分子化合物向高分子化合物的这种转变十分怀疑,那些知道我在低分子化学领域里发表过不少著作的人问我,为什么我对这个令人感兴趣的领域置之不顾,而去研究非常讨厌的和没有确定的化合物,如橡胶和合成多聚物。”(1970,77)
关于大分子的这些争论中,始终贯串着一个问题:这类大分子怎么会只有单一的分子量?它们肯定是大小不等的分子的混合物。不能说恒定的渗透压、黏度、甚至是沉降常数给出了分子量,只能说它们给出了一个平均值。因此,迈耶和马克认为平均链长这个术语是可以接受的,而分子量的说法是不能接受的(迈耶和马克,1930,83)。这个观点对于胶原这类物质是正确的,但不适用于血红蛋白。阿德尔认为,如此洋洋自得地相信大分子最后可分解成容易处理的亚基,这些亚基又都是真正的均匀分子,这种想法“只是希望而已”(阿德尔,1968)。
对大分子的了解日益增进,受到许多生物学家的欢迎。因此,弗利-怀斯林高兴地把长链分子包括在他对细胞超结构的研究之中。同他一样,尼科利·科尔佐夫把对这些物质所作的X射线研究,看作是证明了内格里提出的生物物质的结晶性质的说法。过去的胶束理论成了现在的大分子理论,这个理论从根本上反对钱伯斯所鼓吹的“纯原生质”的谬误概念(科尔佐夫,1928,362)。1927年,科尔佐夫在一次著名的演说中阐述了大分子化学的遗传学意义。阿德尔·利恩和科南特发现的如此高的分子量,使分子的量度同显微镜的量度彼此靠近了。染色体也许是单个分子,也可能是几个分子的束。如果人类染色体的蛋白质是长为10微米的多肽链,它可能有的异构体将是10600!他说,如果每年抄写50000卷书,每卷书有100页纸,那么用来抄写氨基酸组合的异构体就可从太古时代一直抄到本书付印之时(科尔佐夫,1928,362)。
此时,亚历山大和布里奇斯在美国仍认为基因的蛋白质分子是比较小的,最长只有5纳米而基因的长度为20~70纳米。这里留下了一个很大的空档,他们用0.5~10纳米的“分子团”(即分子聚集体)和2~20纳米的“初级胶体颗粒”来弥补(亚历山大和布里奇斯,1929,508)。1927年,维也纳动物学家亨斯·帕切布拉姆早就否定了必须有这种介于基因和分子之间的单位;1929年,他告知爱丁堡皇家学会,最近算出的蛋白质的分子量,表明单个蛋白质可能伸展达一条染色体的全长(10纳米)(帕切布拉姆,1929,227)。人种的特征可归之于“染色体分子里的原子的置换”(帕切布拉姆,1929,226)。迈耶和马克仍不相信有这么长的蛋白质分子,他们对帕切布拉姆的说法表示怀疑(迈耶和马克,1930,238)。
直到1936年,穆勒才把基因的大小描述成同蛋白质分子的大小相等,相对分子质量为“几百万”(穆勒,1936,213)。十年前,穆勒说基因的直径“处在‘胶体’颗粒大小的范围内,但它仍可能包含几百个典型的蛋白质分子”(穆勒,1926,189)。
理查德·戈穗施米德非常高兴地把大分子应用于基因概念。对他来说,这同他反对基因的颗粒概念是吻合的。
认为基团是一种分子或分子的一种小基团的作者们,自然对证明基因的大小相当于蛋白质分子感兴趣。这种计算现在不是那么重要了,因为已知现有的链状分子长达800~1000Å或更长些……
(戈德施米德,1938,283)
如果认为大分子是链长度固定的一种化合物,那就要用质的改变来解释遗传的多样性。另一方面,如果根据遗传物质的量的不同来解释遗传多样性,那就要有链的长度不等的大分子。因此,一位著名遗传学家把突变描写为聚合作用(鲍尔,1924),而从1917年起就主张基因作用的数量理论的戈德施米德写道:
有机化学的最新进展提示了关于复等位性的不同关系,这也是一种数量型的关系,但可因增加了单个量子——在分子链两端的长度变化——而产生不同的复等位性。
(戈德施米德,1932;引自戈德施米德,1938,301)
生物学家中间对大分子的这种兴趣,同有机化学家的反对意见适成对照。甚至连W.H.卡罗瑟斯在杜邦实验室研究聚合作用取得的成就,对有机化学家也不起什么作用。马克回忆起当时的情况:
1920年到1940年间的发展,没有给经典有机化学家和经典物理化学家产生深刻印象。几位开明的知名人士——哈伯、霍沃思、里迪尔、斯维德伯格、蒂西利厄斯、威尔斯坦特——当然认识到这一化学新学科的重要性,但许多有名的很有影响的有机化学家仍无动于衷,不准备承认多聚物化学是一门真正的科学学科,值得促进其发展使之加入现代科学的主流。
(马克,1965,18)
大分子的生物学意义
我已试图表明聚集体理论成为把生理学现象还原为化学的一个障碍。原生质胶体理论则为走出这个已证明是陷阱和幻想的绝境,指明了一条道路。从1926年开始对大分子的辩论以来,斯托丁格必定已经认识到他的工作的生物学意义,因为他在那年的杜塞尔多夫会议上说过:
迄今为止,有机化学家主要是研究在相对高温(100~200℃)下稳定的物质。这同直至现在还在应用的分离和鉴定的步骤有关。只存在于低温下的有机结构是极其众多和复杂的。由于它们的敏感性增高,造成了研究上的困难。尽管我们今天已经知道了大量有机物质,但我们还只是站在真正有机化合物化学的门前张望,还谈不上得出一个结论。
(斯托丁格,1926,3042)
他指出,经典化学家的技术如此不适用于生物分子绝不是偶然的,因为这些大的“真胶体”物质只能存在于正常的生命温度下。
这类真胶体分子可能存在于蛋白质化合物、酶之中,也就是存在于对生命过程来说是十分重要的物质之中。我认为,生命过程同这些分子密切有关。即使温度稍稍增高,这些结构就会遭到破坏,这样,就丧失了生命的可能性——生命本身是依赖于极不稳定的结构的排列组合。
(斯托丁格,1926,3042~3043)
后来,斯托丁格意识到大分子对于哈伯兰特等植物生理学家提出的一些模糊观点很重要,这些观点是1927年他同他未来的妻子玛格达·伏依特相遇时,由她告诉他的。由于对生物学问题日益感兴趣,斯托丁格希望在弗赖堡的研究所着手研究蛋白质的结构,可是1944年盟军轰炸弗赖堡时研究所被毁,这意味着要从零开始,那时要做到这一点对于年迈的斯托丁格来说是勇气过人的。他认识到这一大胆行动要用到他所没有的特殊仪器设备,但他已经预见到,揭露蛋白质的结构将比揭露同聚物的结构容易些。他认为,由于氨基酸化学性质的不同,一定有可能比较容易地确定氨基酸在分子里的位置。但他不知道怎样去确定氨基酸的位置。据报道他曾说过:“这是愿望,但我们还没有方法。”(M.斯托丁格,1969)从他撰写的1943年出版的关于大分子化学和生物学的书中,我们发现他认识到蛋白质结构稍有差别就会产生不同的生物学性质。因而,他描述了林德斯特罗姆-兰在哥本哈根最早为测定氨基酸序列所作的努力。此外,斯托丁格阅读并赞赏薛定谔的名著《生命是什么?》。但最重要的是,他注意到核酸的潜在多样性,虽然那时还只有4种残基;他说:“就潜在的结构多样性来说,不能排除每一种生命类型各有自己的核酸的可能性。”(斯托丁格,1943,48~49)
斯维德伯格和斯托丁格
斯托丁格是研究橡胶的合成及其性质从而研究多聚物的,而斯维德伯格则是由于对胶体颗粒感兴趣而注意多聚物的。1904年,斯维德伯格进乌普萨拉大学念化学,课余时间里他读了内恩斯特的名著《从阿弗加德罗定律和热力学观点看理论化学》(1894)。那时的胶体化学使斯维德伯格着了迷,他认为晶体同胶体之间的转换,对是否存在分子的争论有重大意义。1953年,七十二岁的斯托丁格赴瑞典接受诺贝尔化学奖时两人第一次会面,这说明他们的研究工作有各自的由来。三十年前,他的对手卡勒由于研究多糖的聚集体结构而获马塞尔·贝诺瓦奖;1946年,由于对维生素所作的研究而获得诺贝尔化学奖。斯维德伯格在斯托丁格获奖前二十七年,获得诺贝尔奖。我们认为原因在于斯维德伯格研究的是物理学,他的技术所依据的沉降理论扎实地以物理学理论为基础。斯托丁格的黏度测量没有这么坚实的理论依据,他的研究工作归属于诺贝尔化学委员会而不是物理学委员会。
在实际应用上,斯托丁格的黏度测量快速、实用和省钱;超速离心机则费钱、复杂和耗时。工业,特别是纤维素工业迅速采用的是黏度测量,而不是超速离心机。1940年,斯维德伯格和佩德森可以列举出安装了斯维德伯格设计的超速离心机的单位:利斯特研究所、牛津大学生物化学系、威斯康星大学化学系。此时,美国已有了气动超速离心机,在洛克菲勒研究所用于研究蛋白质、病毒和细胞(鲍尔和皮克尔斯,1936)。
在弗雷德加心目中,对斯托丁格的成就无疑是迟迟才认识到的,他在斯德哥尔摩写信给斯托丁格:
长期以来,许多同行拒绝你的观点,有些人嘲笑这些观点,这不是什么秘密。这也许是可以理解的。在高聚物领域里,几乎每一件事都是前所未有和未经检验的。长期以来已经确立的概念必须加以修改,新的概念必须创立。大分子科学的发展,并没有带来一幅静谧的田园生活的图景。
(弗雷德加,1953,395)
大分子概念的胜利和聚集体理论的让位,为托马斯·科恩所说的范例的论战提供一个很好的例证。但如果说聚集体理论或胶体科学已变成多余的,那是不正确的。如果说生物物理细胞学家早先强调膜和电解质已经过时,那就更没有道理了。从实验细胞学发展出组织培养。艾伯特·克劳德在洛克菲勒研究所,在研究细胞器的重要工作中使用了这一技术,介于分子水平和显微镜水平之间被忽视的内容,不仅可被模糊不清的胶体系统,而且可被大分子和细胞器所填朴;其中有一些细胞器,很久以前就已在显微镜下的染色切片中看到了。但只是在本章谈到的测定分子量、链长和长阔之比的技术得到发展以后,以及这些技术成功地应用于蛋白质以后,才认识到核酸的大分子特性,才改进了抽提步骤,才得到不会进一步降解从而产生出很好的X射线图型的物质。1953年发表的最精细美好的DNA的X射线图像,是用斯托丁格从前的学生和同事——鲁道夫·西格纳供给的材料拍摄得到的,这绝不是偶然的。
二十世纪四十年代时,胸腺核酸已经是完全不同于切格蒙蒂所著教科书《胶体化学》中想象的核素的某种东西。那本书只告诉读者如何很好地证明胶体接触水后膨胀的性质(切格蒙蒂,1920,115~116)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















