实验项目十二 血清酶活力测定
学习目标
【知识目标】
(1)能用自己的语言描述血清酶活力测定的原理。
(2)能够迅速而准确地陈述血清酶活力测定实验操作要点。
(3)能够准确鉴别血清酶活力检测结果,并能说明其临床意义。
【能力目标】
(1)能够正确完成血清酶活力测定各项操作内容,做到步骤正确、动作连贯协调、内容全面无遗漏。
(2)能够正确分析血清中相关酶活性升高所代表的意义。
案例引导
患者,男,42岁,一周前食用海鲜后,出现低热、全身疲乏无力、食欲减退,并伴有恶心、呕吐、厌油腻、肝区不适及尿黄等症状,休息后不见好转。肝功能化验结果显示血清丙氨酸氨基转移酶浓度为751.28U/L,总胆汁酸浓度为101.35μmol/L,胆碱酯酶浓度为368.52U/L。请结合症状及检验结果给出初步诊断。
(提示:急性肝炎)
一、血清丙氨酸氨基转移酶(ALT)活性测定
【实验原理】
![]()
上述偶联反应中,NADH的氧化速率与标本中酶的活性呈正比,在340nm处NADH呈特征性吸收峰,而NAD+没有。根据340nm处吸光度下降速率(ΔA/min)计算ALT的活性单位。
【实验器材】
试管,分光光度计或半自动生化分析仪,微量加样器,恒温水浴箱。
【药品及试剂】
(1)新鲜血清。
(2)商品试剂盒主要成分及浓度。
试剂R1:α-酮戊二酸(15mmol/L)、NADH(0.18mmol/L)、乳酸脱氢酶LDH(不低于5000U/L)。
试剂R2:Tris缓冲液pH值为7.3(100mmol/L)、L-丙氨酸(500mmol/L)。
【试剂配制】
取一定量R2(参看R1瓶签)复溶1瓶R1,溶解后即为工作液。
操作流程

【操作步骤】
1.工作液配制
工作液按照相应试剂盒说明进行配制。
2.设置反应体系
取试管2支,分别标记,按表3-26血清丙氨酸氨基转移酶活性测定反应操作步骤向各管加入相应试剂。
表3-26 血清丙氨酸氨基转移酶活性测定反应操作步骤(单位:mL)

分别混匀,置于37℃恒温水浴箱中,保温1min(避免阳光直射)。
3.比色测定
设置半自动生化分析仪(或分光光度计)波长为340nm,以空白管调零,进行测定。
【实验数据处理及结果分析】
![]()
【实验意义】
正常值参考范围:37℃时,男性ALT为不高于40U/L,女性ALT为不高于31 U/L。
ALT在人体体内以肝脏含量最为丰富,其他组织(如心肌等组织)中此酶含量也不少。所以在肝炎急性期,药物中毒性肝细胞坏死时ALT明显升高,肝癌、肝硬化、慢性肝炎、心肌梗死时ALT中度升高,阻塞性黄疸、胆管炎时ALT可轻度升高。
二、血清乳酸脱氢酶活性测定
【实验原理】
乳酸脱氢酶(lactate dehydrogenase,简称LDH,又称为L-乳酸:NAD+氧化还原酶)广泛存在于生物细胞体内,是糖代谢酵解途径的关键酶之一,可催化下列可逆反应。
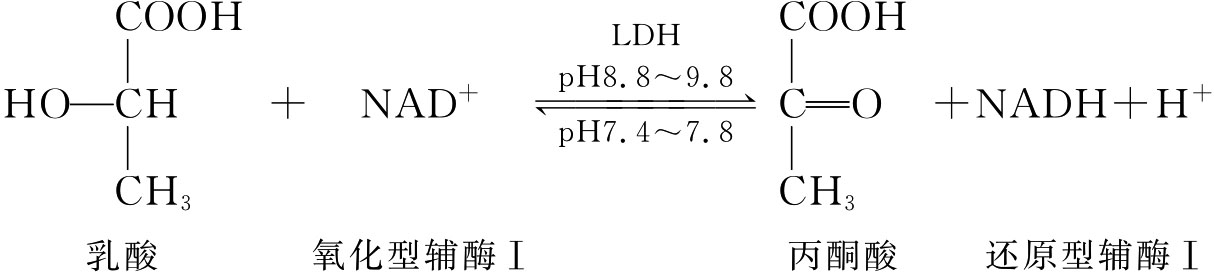
LDH可溶于水或稀盐溶液。组织中测定LDH含量的方法很多,其中,紫外分光光度法更为简单、快速。鉴于NADH、NAD+在340nm处及260nm处有各自的最大吸收峰,因此以NAD+为辅酶的各种脱氢酶类都可通过340nm光吸收值得到改变,定量测定酶的含量。本实验测定LDH活力,其基质液中含丙酮酸及NADH,在一定条件下加入一定量酶液,并观察NADH在反应过程中340nm处光的吸收减少值,减少越多,则LDH活力越高。其活力单位定义如下:在25℃、pH值为7.5条件下A340nm每分钟下降1.0的酶量为1个单位。可定量测定每克湿重组织中LDH单位。定量测定蛋白质含量即可计算比活力(单位:U/mg)。
利用上述原理,改变不同底物则可测定相应脱氢酶反应过程中A340nm的变化,定量测定酶活力,如苹果酸脱氢酶、醇脱氢酶、醛脱氢酶等,适用范围很广。
【实验器材】
组织捣碎机,紫外分光光度计,恒温水浴箱,移液管(5mL、0.1mL),微量注射器(10μL)。
【药品及试剂】
磷酸氢二钾、磷酸二氢钾。
【试剂配制】
50mmol/L、pH=6.5的磷酸氢二钾-磷酸二氢钾缓冲液母液。
溶液A 50mmol/L K2HPO4:称取K2HPO41.74g加入蒸馏水溶解后定容至200mL。
溶液B 50mmol/L KH2PO4:称取KH2PO43.40g加入蒸馏水溶解后定容至500mL。
取溶液A 31.5mL与溶液B 68.5mL,调节混合pH值至6.5。置于4℃冰箱内备用。
10mmol/L、pH=6.5的磷酸氢二钾-磷酸二氢钾缓冲液可用上述母液稀释得到。现用现配。
0.1mol/L、pH=7.5的磷酸盐缓冲液可用上述母液稀释得到。现用现配。
NADH溶液:称取3.5mg纯NADH置于试管中,加入0.1mol/L、pH=7.5的磷酸缓冲液1mL摇匀。现用现配。
丙酮酸溶液:称取2.5mg丙酮酸钠,加入0.1mol/L、pH=7.5的磷酸缓冲液29 mL,使其完全溶解。试剂现用现配。
操作流程
【操作步骤】
1.制备肌肉匀浆
称取20g兔肉,按重量体积比=1∶4加入4℃预冷的10mmol/L、pH值为6.5的磷酸氢二钾-磷酸二氢钾缓冲液中,用组织捣碎机捣碎,每次10s,连续操作3次。将匀浆液倒入烧杯中,置于4℃冰箱中提取过夜,过滤后得到组织提取液。
2.测定LDH活力
实验时预先将丙酮酸溶液及NADH溶液放在25℃水浴箱中预热。取两只石英比色杯,在一只比色杯中加入0.1mmol/L、pH值为7.5的磷酸氢二钾-磷酸二氢钾缓冲液3mL,置于紫外分光光度计中,在340nm处将光吸收调节至零;另一只比色杯用于测定LDH活力,依次加入丙酮酸钠溶液2.9mL、NADH溶液0.1mL,加盖摇匀后,测定340nm处吸光度值A。取出比色杯加入经稀释的酶液10μL,立即计时,摇匀后,每隔0.5min测一次A340nm,连续测定3min,以A对时间t作图,取反应最初线性部分,计算A340nm/min减少值。加入酶液的稀释度(或加入量)时应控制A340nm/min下降值在0.1~0.2之间。
【实验数据处理及结果分析】
计算每毫升组织提取液中LDH活力单位。
LDH活力单位(U)=(A340/min×稀释倍数)/酶液加入量(10μL)×10-1
提取液中LDH总活力单位=LDH活力(U)×总体积
【注意事项】
(1)实验材料应尽量新鲜,如取材后不立即使用,则应储存在-20℃冰箱内。
(2)酶液的稀释度及加入量应控制A340nm/min下降值在0.1~0.2之间,以减少实验误差。
(3)NADH溶液应在临用前配制。
【实验意义】
乳酸脱氢酶是在体内能量代谢过程中的一个重要的酶。此酶几乎存在于所有组织中,以肝、肾、心肌、骨骼肌、胰腺和肺中为最多。这些组织中的LDH的活力比血清中高得多。所以当少量组织坏死时,该酶即释放入血而使其血液中的酶的活力升高。测定此酶常用于对心肌梗死、肝病和某些恶性肿瘤的辅助诊断。
能力检测
一、单项选择题
1.ALT在下列哪个组织中含量最高?( )
A.肝脏 B.肾脏 C.胰腺 D.大脑 E.胃
2.LDH是由两种亚基组成的四聚体,共形成几种同工酶?( )
A.2种 B.3种 C.4种 D.5种 E.6种
3.心肌梗死时,下列哪项的活性升高?( )
A.LDH1 B.LDH2 C.LDH3 D.LDH4E.LDH5
4.琼脂糖电泳时,从阳极至阴极LDH同工酶区带依次为( )。
A.LDH2,LDH1,LDH3,LDH4,LDH5 B.LDH5,LDH1,LDH2,LDH3,LDH4
C.LDH3,LDH1,LDH2,LDH4,LDH5 D.LDH1,LDH2,LDH3,LDH4,LDH5
E.LDH4,LDH1,LDH2,LDH3,LDH5
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















