1.检验目的
规范钠(Na)检测试验,确保检测结果准确性和重复性。
2.检验原理
测定方法:间接电位测定法
E=常数+(斜率)[对数(Na+)]
使用两个玻璃钠电极(一个作参考电极)测定钠离子浓度。钠电极是用锂钠铝硅酸盐玻璃制成的。将此玻璃电极的外层充分水合是非常重要的。当样品缓冲混合液接触电极时,样品中的钠离子与电极水合层内的钠离子发生离子交换。在离子交换过程中,电极电势发生变化。这些电势变化是以参考电极为参比基准的。“参照电势”符合能斯特方程,由此可以计算出样品中的钠浓度。
3.设备性能参数
各种生化分析仪性能指标见相应生化分析仪说明书。
4.标本
详见生化组标本的采集与处理程序。
5.设备和试剂
5.1 设备 Beckman公司生产UniCel® DxC800、LX-20生化分析仪。
5.2 试剂
5.2.1 来源:Beckman系统配套试剂
5.2.2 储存条件及稳定性:
5.2.2.1 未开瓶、室温储存的ISE电解质参照试剂可在试剂瓶标签上印刷的失效日期之前保持稳定。开瓶后,本试剂可在其有效期内室温保持稳定30 d。
5.2.2.2 关于冷冻运输的任何电解质试剂,要完全恢复至室温并轻轻颠倒试剂瓶至少20次以保证试剂充分混匀,使盐重新溶解到溶液中。
5.2.3 准备:无需配制。
6.容器及试剂添加剂
血液标本采集的容器:不抗凝或者肝素锂抗凝的真空采血管。
添加剂:肝素锂或不含任何添加剂。
7.校准
7.1 校准物
7.1.1 来源:Beckman系统AQUA校正剂1、2、3 。
7.1.2 储存及稳定性:
7.1.2.1 未开瓶的校正剂2~8℃储存,至试剂瓶上印刷的失效日期。
7.1.2.2 开瓶后,可在其有效期内2~8℃稳定30 d。
7.1.3 准备:无需配制,校准剂从冰箱中取出后恢复至室温后才能进行校准。
7.2 量值溯源:见UniCel® DxC800、LX-20生化分析仪操作说明书。
7.3 校准周期:24 h
8.操作步骤
8.1 标本接收及编号
8.1.1 标本接收
有条码标本:打开检验信息管理系统→标本接收系统(条码)→接收标本→存入。
无条码标本:整理标本,审核合格后,对检验申请单或标本进行编号(具体操作详见《标本接收工作程序》。
8.1.2 标本编号 编号总原则如下。
肝功全套检测:1-300号;
肾功、生化、葡萄糖检测:301-500号;
急诊检测:501-600号;
夜班或节假日、周末下午检测:601-700号;
尿液标本检测:701-800号;
体检样本:1001-2000号。
8.2 标本登记或录入
8.2.1 有条码标本排样:打开检验信息管理系统→标本排样系统(条码)→选择仪器→输入样本号→扫描条码号→将样本号标记于试管上→存入。
8.2.2 无条码标本排样:打开检验信息管理系统→资料录入→选择仪器→输入样本编号→录入患者相关信息(如患者ID号,已缴费的输入患者ID号的可调取病人信息,无ID号的则手工录入病人姓名、性别、年龄、诊室等)→录入采样时间及收到标本时间→存入。
8.3 上机操作 UniCel® DxC800生化分析仪24h待机,简要操作如下。
8.3.1 工作前检查:检查仪器、水、电、试剂等;
8.3.2 对需要校准的项目进行校准;
8.3.3 检测Beckman原装高、中、低三水平质控。
8.3.4 对已排样无条码样本进行编程
进入Samples屏幕→输入架号﹑杯号及样本号→选择标本类别→选择项目→点击F10保存。
8.3.5 样本装载
8.3.5.1将分离完成并已编程结束的样本按程序分配顺序插入样本检测架。
8.3.5.2 将分离完成已排样有条码的样本可随机插入样本检测架。
8.3.6 运行:将已完成装载的检测架放入样本检测轨道并按RUN键,仪器开始运行。急诊条码仪器自动识别,或者急诊样本手工编程时选中“stat”,及时进样。
8.4 检验结果的录入
8.4.1 仪器一般自动将检验结果传入检验信息管理系统。
8.4.2 部分意外不能传入检验信息系统者,可在进入主屏后,点击Results,输入样本号/架号,点击Enter,点击Host即可。
8.4.3 部分在其他仪器检测结果需录入者:进入检验信息管理系统→资料录入→录审结果→选择需录入的项目名称→录入结果→存入。
8.4.4 部分检测项目复查后需修改结果者:进入检验信息管理系统→资料录入→录审结果→选择需修改的项目名称→录入结果→填写修改原因→存入。
注:检验信息管理系统详细操作见《检验信息管理系统操作程序》。
8.5 检验报告的审核 实验室主管核对项目、分析检验结果,根据复检程序,提出复检要求,确认无误后网络审核发送、打印检验报告,授权签字人签字盖章即可发出报告。
注:仪器详细操作程序、校准程序见《Beckman DxC 800操作规程》、《Beckman LX-20操作规程》和《Beckman DxC 800系统校准方法》、《Beckman LX-20系统校准方法》。
9.质量控制
9.1 质控品:厂家提供的Beckman原装高、中、低三水平质控物,不需复溶,直接使用。
9.2 控制参数:Na
9.3 周期:24 h
9.4 质控物准备 从2~8℃冰箱取出质控物,将已混匀的质控物加入反应杯中,恢复室温15 min。
9.5 质控物的检测
9.5.1 每天早上将Beckman原装高、中、低三水平质控物按《各仪器标准操作程序》常规操作方法对仪器进行室内质量监控,质控结果在允许范围内可进行样本分析。
9.5.2 在每次进行新的校正时,以及按适用的系统手册中的规定进行特别保养或故障排除后,都要进行质控监测,质控结果在允许范围内可投入使用。
9.5.3 每使用新批号试剂时,需监测质控情况,并用前一批号试剂测试过的标本随机选择5个标本上机检测,将两次结果对比分析,偏差需小于该参数1/3CLIA’88要求。
9.5.4 将每日质控情况记录于《仪器使用登记表》。
9.6 质控规则、结果分析及失控处理见《室内质量控制程序》。
9.7 室间质控 每年参加重庆市、卫生部临床检验中心及CAP室间质控。
10.干扰因素及变异的潜在来源
10.1 锂、苯扎氯铵、甲苄索氯铵对结果有一定影响。
10.2 标本、反应液中的颗粒微粒、微小团块可影响结果分析。
11.结果计算及不确定度
11.1 计算公式结果=U×C/S
U:测定管光密度,C:标准管浓度(单位:mmol/L),S:标准管光密度之后仪器自动计算结果。
11.2 计量单位:mmol/L。
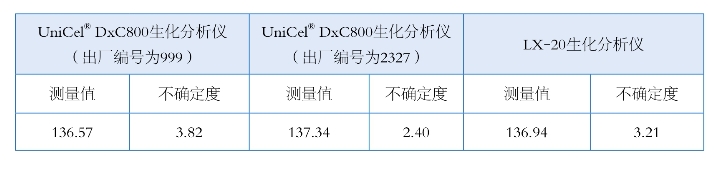
11.3 测量不确定度(表11-12)
表11-12 测量不确定度
12.生物参考区间
血清或血浆:136.0~145.0 mmol/L。
13.患者检验结果的可报告区间
血清或血浆:100~200 mmol/L。
14.警告/危急值
14.1 血钠≤120 mmol/L或≥158 mmol/L,立即联系临床医师并作好记录。
14.2 脑外科:血钠﹤125 mmol/L,立即联系临床医师并作好记录。
15.实验室解释
钠测定数据用于诊断和治疗醛固酮过多症、尿崩症、肾上腺性高血压、艾迪生病、脱水、抗利尿激素分泌异常或其他与电解质失衡有关的疾病。
15.1 血钠升高
15.1.1 水缺乏性高钠血症:水摄取不足如昏迷、吞咽困难、渴感觉中枢障碍;失水如严重呕吐、腹泻、胃肠造瘘、尿崩症、非酮症性高渗性糖尿病昏迷、过度出汗或高温下不显性出汗增加等,是高渗性失水的病理生理基础和诊断依据。
15.1.2 钠过多性高钠血症:盐皮质激素或糖皮质激素分泌过多,如皮质酮增多症、皮质醇增多症、原发性醛固酮增多症、长期皮质激素治疗,氯化钠摄取或静脉输注过多等。
15.1.3 特发型高钠血症:由于下丘脑病变引起渗透压调节障碍,渗透压感受器定位在高水平,口渴阈值升高,高钠而无口渴,补水不能纠正。
15.2 血钠降低
15.2.1 细胞外液减少性低钠血症:见于长期钠摄取极度减少或钠丢失增加。
15.2.1.1 肾脏丢失,如肾上腺皮质功能减退症、垂体功能减退症、失钠性肾炎、利尿药使用、酮症酸中毒。
15.2.1.2 消化管丢失,如呕吐、腹泻、胃肠减压或造口。
15.2.1.3 皮肤丢失,如过度出汗或不显性出汗增多。
15.2.1.4 血浆转移,如急性胰腺炎或急性腹膜炎腹水。低血浆容量单纯或补糖液,是低渗透性失水的病理生理基础和诊断仪据。
15.2.2 细胞外液正常性低钠血症:如急性水中毒、ADH不适当分泌综合征(SIADH)、甲状腺功能减退症、无症状性低钠血症等。
15.2.3 细胞外液增加性低钠血症:各种水肿性疾病如肝硬化、心力衰竭、肾病综合征、慢性肾炎、尿毒症,为稀释性低钠血症。
15.3 尿钠排出增多:见于严重肾盂肾炎、肾小管严重损害、肾上腺皮质功能不全、糖尿病、应用利尿激素治疗等。
16.安全防护措施
16.1 标本的运输必须保证运送过程的生物安全,防止溢出。标本溢出后,应该立即对污染的环境和设备进行消毒处理。
16.2 对标明有传染性疾病的血液标本应特别防护,以不污染环境和保护工作安全为前提。
16.3 在进行检测分析过程中的一切操作活动中,必须遵守相关安全规则。执行必要的防范措施,比如佩戴防护性手套、口罩等。
16.4 血液标本在离心过程中,应将所有标本加盖。离心后,开启试管盖时应防止气雾胶污染环境。
16.5 与标本接触的一切器皿、仪器组件/拆卸组合零件都应视为污染物,因此操作人员不小心接触了这种污染源时,应立即用清水冲洗被污染区域并采取必要医疗措施。
16.6 如果操作人员的皮肤或衣物上沾到了标本或废液,应立即用清水冲洗并进行消毒处理。如果眼睛中溅入标本或废液,用大量的清水冲洗并采取必要的医疗措施。
16.7 在测试样本时,仪器盖子需盖好。
16.8 所有检查过的样本及有关的废弃物,都会给您带来潜在的危险或生物污染。所有废弃样本及废弃物的处理方法同标本的处理程序。
17.注意事项
17.1 对于浓度超过分析范围上限的样品,通常用去离子水稀释2倍后重新分析,并将结果乘以稀释倍数,以稀释后检测结果落在线性范围内为最终稀释倍数,稀释倍数可在样品编程时将其输入检测系统。
17.2 检测结果的复检,详见《生化组相关复检程序》。
18.参考文献
[1] 叶应妩,王毓三,申子瑜.全国临床检验操作规程.3版.南京:东南大学
出版社,2007.
[2] 《Beckman DxC800操作说明书》.[3] 《Beckman LX-20操作说明书》.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















