实验二十 RT-PCR方法分析基因的表达
【实验目的】
1.学习和掌握RT-PCR的原理。
2.学会利用RT-PCR方法设计实验并分析目的基因在植物组织中的表达。
【实验原理】
RT-PCR(reverse transcriptase PCR)是将RNA的反转录(RT)和cDNA的聚合酶链式扩增(PCR)相结合的技术。首先在反转录酶的作用下,从RNA合成cDNA,再以cDNA为模板,扩增合成目的片段(图2-3)。RT-PCR技术灵敏而且用途广泛,可用于检测细胞中基因的表达水平、细胞中RNA病毒的含量和直接克隆特定基因的cDNA序列。作为模板的RNA可以是总RNA、mRNA或体外转录的RNA产物。RT-PCR技术的关键是确保RNA模板中无RNA酶和基因组DNA的污染。

图2-3 RT-PCR的基本原理
【实验材料】
拟南芥突变体和野生型4~5周龄植株。
【实验器材】
【药品试剂】
Taq酶; dNTP; oligo(dT)(0.05μg/μl);逆转录酶(AMV reverse transcriptase); RNasin; DEPC;植物RNA提取试剂盒(TIANGEN公司)、基因特异性引物等。
【实验方法】
操作参照《拟南芥实验手册》(Weigel and Glazebrook,2004)。
一、RNA的提取
【注意事项】
在这里介绍的是试剂公司提供的一种利用试剂盒提取RNA的操作方法。需要注明的是各个公司由于在制备试剂盒的时候采用的是不同的试剂组合,所以在操作方法上各有不同,在操作时一定要参照公司试剂盒上的详细说明。
1.取材和匀浆: 50~100mg植物叶片在液氮中迅速研磨成粉末,加入450μl裂解液RL,振荡混匀。
2.将所有溶液转移至过滤柱CS上(将过滤柱放在收集管中),12000r/min离心5分钟,小心吸取收集管中的上清液至RNAasefree的离心管中,吸头尽量避免接触收集管中的细胞碎片沉淀。
3.缓慢加入0.5倍上清液体积的无水乙醇,混匀后将混合液转入吸附柱CR3中,12000r/min离心1分钟,倒掉收集管中的废液,将吸附柱CR3放回收集管中。
4.向吸附柱中加入350μl去蛋白液RW1,12000r/min离心1分钟,倒掉收集管中的废液,将吸附柱放回收集管中。
5.向吸附柱中加入80μl DNase I工作液,室温放置15分钟。
6.向吸附柱中加入350μl去蛋白液RW1,12000r/min离心1分钟,倒掉收集管中的废液,将吸附柱放回收集管中。
7.向吸附柱中加入500μl漂洗液RW(使用前加入乙醇),室温静置2分钟,12000r/min离心1分钟,倒掉收集管中的废液,将吸附柱放回收集管中。
8.重复上述步骤7。
9.12000r/min离心2分钟,倒掉废液。将吸附柱置于室温放置数分钟,以彻底晾干吸附柱中残余的漂洗液。
10.将吸附柱放入一个新的RNase-free离心管中,向吸附柱中加入30~100μl无RNase污染的ddH2O(DEPC-H2O),室温放置2分钟,12000r/min离心2分钟,得到RNA溶液。样品保持在-70℃。
二、cDNA的合成
1.oligo(dT) 500 ng,RNA 1μg,加入DEPC-H2 O,使得终体积为10μl。
2.将上述混合物在70℃加热5分钟。
3.室温缓慢冷却混合物,大约30分钟,然后将混合物置于冰上。
4.按照下列次序在上述混合物中加入表2-5所示试剂。
表2-5 cDNA合成的反应体系

混合均匀后,在42℃保温1小时。
5.反应后将反应物置于冰上终止反应。然后,在70℃保温10分钟,灭活逆转录酶活性。样品保存在-20℃。
【注意事项】
1.RT-PCR所遇到的一个潜在的困难是RNA中沾染的基因组DNA。使用较好的RNA分离方法,如Trizol Reagent,会减少RNA制备物中沾染的基因组DNA。为了避免产生基因组DNA的产物,可以在逆转录之前使用扩增级的DNaseⅠ对RNA进行处理以除去沾染的DNA。将样品在2.0mmol/L EDTA中65℃保温10分钟以终止DNaseⅠ消化。EDTA可以螯合镁离子,防止高温时所发生的依赖于镁离子的RNA水解。
2.为了将扩增的cDNA同沾染的基因组DNA扩增产物分开,可以设计来自不同外显子的引物。来源于cDNA的PCR产物会比来源于沾染了基因组DNA的产物短。另外,对每个RNA模板进行一个无逆转录的对照实验,以确定一个目标片段是来自基因组DNA还是cDNA。在无逆转录时所得到的PCR产物来源于基因组。
三、PCR扩增
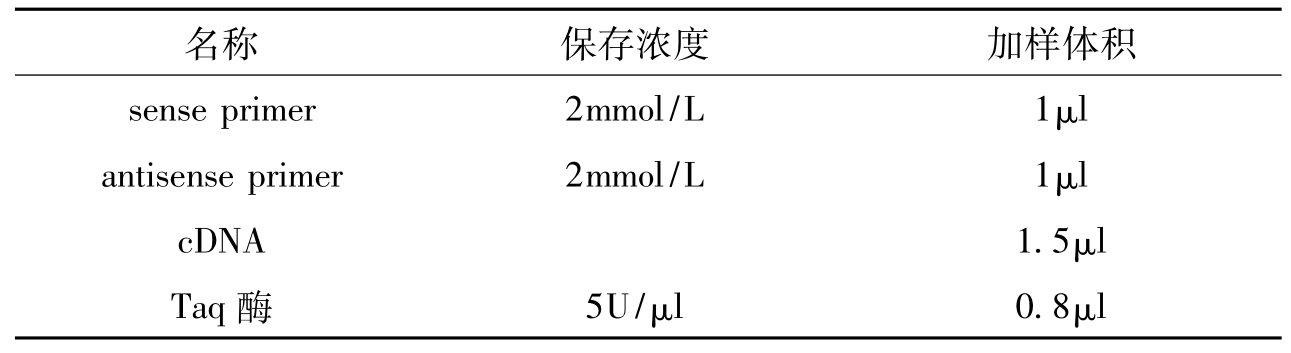
1.50μl PCR体系的组成(表2-6)。
表2-6 RT-PCR反应中的PCR扩增体系

续表
PCR反应条件:
Step1: 94℃5分钟
Step2: 94℃1分钟
Step3:退火温度40秒
Step4 72℃50秒
29个循环
72℃10分钟
2.RT-PCR中的对照:在RT-PCR中经常使用在不同组织以及不同发育时间段中表达稳定并且均一的基因作为对照。经常使用的有UBQ10。
检测UBQ10的表达使用的引物序列如下:
UBQ1: GATCTTTGCCGGAAAACAATTGGAGGATGGT
UBQ2: CGACTTGTCATTAGAAAGAAAGAGATAACAGG
【注意事项】
上述引物是根据拟南芥Columbia生态型设计的,扩增后的基因片段大小为483bp。在Landsberg生态型的拟南芥中可能会扩增出2~3条带。如果扩增产物大于483bp,说明在cDNA中混有基因组DNA,需要在PCR反应之前用Dnase I处理。
四、电泳检测
将PCR产物取5μl混合DNA上样缓冲液后,置于琼脂糖凝胶上并电泳。通过亮度的比较分析基因表达量的差异。
【注意事项】
上样时注意每种样品的上样量是一致的。同时,在准备含有EB的DNA琼脂糖凝胶的过程中注意凝胶要均匀,EB在凝胶中的分布也要均匀,以便减小误差。
【思考题】
1.简述RT-PCR的原理。
2.RT-PCR过程中有哪些注意事项?
3.简述如何增加RT-PCR过程中的特异性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















