(一)核小体重塑对基因组表达的影响
第二种影响基因组表达的染色体修饰类型是核小体重塑(nucleosome remodeling)。这一术语指在基因组一个较短区域中核小体的修饰和重新定位,以便于DNA结合蛋白能够接近它们的结合位点。当然这并不是对所有基因转录都是必要的,至少在少数情况下,某些蛋白质启动基因表达是通过结合到核小体表面或者结合接头DNA(即组蛋白八聚体之间的DNA)实现的,并没有影响核小体的定位。在某些情况下,核小体重新定位被明确地证明是基因激活的前提。比如在黑腹果蝇中,有热刺激的情况下,GAGA蛋白激活帮助其他蛋白折叠的hsp70基因的转录。激活过程中,伴随着在hsp70基因上游DNA酶Ⅰ高敏位点的形成,清楚地说明在这个区域内核小体被移除了,有一段裸露的DNA暴露出来(图2-15)。

图2-15 hsp70基因的激活伴随着DNA酶Ⅰ高敏位点的形成
如图2-16显示核小体,在基因起始的上游,在基因活化的时候,核小体重新定位了。
核小体重塑不像乙酰化和前面章节所描述的化学修饰,它并不涉及组蛋白分子的共价修饰。取而代之的是,重塑由能量依赖的过程引发,以减弱核小体和与其结合的DNA之间的联系。此过程中主要发生三种明显的改变(图2-16)。

图2-16 核小体重塑,滑动及移动
1.重塑(remodeling) 从严格意义上讲,涉及核小体结构的改变,但不改变它的位置。目前不清楚其结构改变的特性,但在体外诱导时,核小体体积变为两倍,结合的DNA对DNA酶敏感性提高。
2.滑动(sliding,或称顺式取代) 即核小体沿DNA作物理移动。
3.转移(transfer,或称反式取代) 导致核小体转移到第二个DNA分子或相同分子的非相邻区域。
负责核小体重塑的蛋白质与HATs一起形成一个大的复合体共同发挥作用。Swi/Snf家族是复合体中的一种成员,该家族在许多真核细胞生物中包含至少11种蛋白质组分。目前,对有关Swi/Snf家族及其他核小体重构复合体成分在基因组中行使其功能的途径还知之甚少。Swi/Snf家族中任一组成成分看来都没有DNA结合能力,所以复合体必须通过其他的蛋白募集到它的靶位点。已证实Swi/Snf和HATs之间存在相互作用,提示核小体重塑可能与组蛋白乙酰化相偶联。这是一个诱人的假说,原因在于它将目前认为是基因组活化中的两个核心反应联系了起来。但这个假说仍存在问题,因为Swi/Snf对整个基因组并无全局效应,只在有限数量的部位影响基因表达;在酵母中,只有不超过基因组6%的基因受其影响。这提示,Swi/Snf家族主要不是与在整个基因组中起作用的HATs有相互作用,而是和其他有限定的靶基因的蛋白之间存在更重要的相互作用。最有可能的候选者是转录激活因子,其中每一个转录激活因子针对有限的一套特异基因,并且其中一些在体外与Swi/Snf存在相互作用。
(二)DNA甲基化引发的基因组沉默
通过改变DNA本身的化学特性,也可以实现基因组活性的重要改变。这些改变伴随着基因组局部或者整个染色体的半永久性沉默,通常这种修饰状态是在细胞分裂时从亲代继承下来的。这种修饰方式就是DNA甲基化(DNA methylation)。
在真核生物中,染色体DNA中的胞嘧啶有时可由DNA甲基转移酶(DNA methyltransferase),加入一个甲基而转变成5-甲基胞嘧啶。胞嘧啶甲基化现象在低等真核生物中较少见,但在脊椎动物基因组中,高达10%的胞嘧啶都被甲基化,在植物中可高达30%。甲基化的模式并不是随机的,而是仅限于含有5′-CG-3′序列的一些拷贝中的胞嘧啶,植物中限于5′-CNG-3′序列中的胞嘧啶。目前已知两种类型的甲基化活性(图2-17):第一类是维持性甲基化(maintenance methylation),在基因复制之后负责向新合成的DNA链上对应于亲本链甲基化位点的位置添加甲基,维持性甲基化可确保两个子代DNA分子保持与亲本分子相同的甲基化模式,即甲基化模式在细胞分裂之后被继承了下来;第二类是从头甲基化(de novo methylation),可在新的位置添加甲基,从而可以改变基因组局部区域的甲基化模式。
1.DNA甲基转移酶和基因组活性的抑制 DNA甲基转移酶一直被广泛研究,在各种生物中都是相似的,从细菌(使DNA甲基化,避免被自身限制性内切酶降解,并使这些酶作用于入侵的噬菌体DNA)到如人等哺乳动物。尽管针对这些酶开展了很多研究,但是多年以来,似乎在哺乳动物细胞只存在一种DNA甲基转移酶,这很让人疑惑。这个酶现在称为DNA甲基转移酶1(Dnmt1),负责维持甲基化,而与从头甲基化无关。因为Dnmt1基因敲除的小鼠仍然能够进行从头甲基化,当反转录病毒感染时,细胞仍然能够将甲基加到病毒基因组DNA上。在20世纪90年代后期,人和小鼠基因组的大多数基因都可以通过表达序列标签的方式查到。通过查询相关数据库,发现了Dnmt1的同源基因Dnmt3a和Dnmt3b。现在知道,它们编码了DNA从头甲基化酶。这些基因敲除的小鼠无法完成发育过程,Dnmt3b基因失活的小鼠在出生后几天内死亡,Dnmt3a缺失的小鼠也只能多活一到两周。在死亡前,分析胚胎的DNA甲基化水平,结果显示基因敲除的小鼠只有正常小鼠DNA甲基化水平的一半(图2-18),这说明Dnmt1介导的维持甲基化仍起着作用,但从头甲基化则已经丧失了,因此在这些小鼠中没有随时间增加DNA甲基化的整体水平。
维持性甲基化和从头甲基化都会导致基因活性的抑制。实验显示,通过克隆把甲基化或未甲基化的基因引入细胞,检测它们的表达水平,实验结果表明DNA甲基化的基因不表达。当检测染色体DNA的甲基化模式时,发现与基因表达的联系也很明显,即具有活性的基因位于非甲基化区域。例如,人类有40%~50%的基因位于靠近CpG岛的位置,CpG岛的甲基化状态反映了相邻基因的表达模式。那些在各种组织都有表达的管家基因含有未甲基化的CpG岛,而组织特异的基因仅在其表达的组织中才是去甲基化的。值得注意的是,由于甲基化模式在细胞分裂后可被保留,因此确定哪些基因可以表达的信息也遗传到子代细胞中,这样确保了即使组织中细胞被新细胞替换和(或)增加了新细胞,也能保持适当的基因表达模式。
人类疾病的研究更加强调了DNA甲基化的重要性。ICF综合征(免疫缺陷、着丝粒不稳定及面部畸形)正如其名称所显示的,具有广泛的表型效应,与不同基因组区域的甲基化不足相关,并且是由Dnmt3b基因突变引起的。相反地,在某些特定类型的癌症中,改变了表达模式的基因的CpG岛经常出现过度甲基化,尽管在这些病例中不正常的甲基化可能是这些疾病状态的结果而可能不是原因。
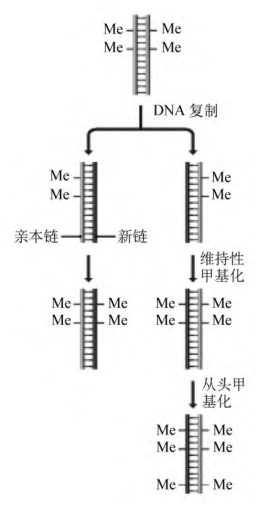
图2-17 维持性甲基化和从头甲基化

图2-18 DNA甲基化酶Dnmt3a和Dnmt3b是从头甲基化酶的实验依据
显示的是正常(野生型)小鼠胚胎和Dnmt3b基因敲除小鼠的整体DNA甲基化水平。在正常胚胎,由于Dnmt3a和Dnmt3b促进从头DNA甲基化,DNA甲基化水平不断上升,而在基因敲除小鼠胚胎,DNA甲基化停留在原来水平
甲基化如何影响基因表达许多年来一直是一个谜。现在已知甲基化CpG结合蛋白(methyl-CpG-binding proteins,MeCP)是Sin3和NuRD组蛋白去乙酰化酶复合体的组分。这个发现引出一个模型,即甲基化的CpG岛是HDAC复合物结合的靶位点,此复合物修饰周围的染色质以使相邻基因沉默(图2-19)。

图2-19 DNA甲基化和基因组表达之间联系的模型
基因上游CpG岛的甲基化提供了一个组蛋白去乙酰化酶复合体(HDAC)中甲基-CpG-结合蛋白(MeCP)组分的识别信号。HDAC修饰染色体CpG岛区域并因此使基因失活。注:CpG岛的相关位点和大小以及基因没有按比例绘制
2.甲基化参与基因组印记和X染色体失活 有关DNA甲基化和基因组沉默之间的联系,如果需要的话,两个有趣的被称为基因组印记和X失活的现象可以提供更多的证据。
(1)基因组印记:是一种哺乳动物基因组中相对不很普遍但非常重要的特征:二倍体细胞核中同源染色体上的一对基因中只有一个可以被表达,另一个因甲基化而沉默。这种现象也见于某些昆虫(尽管在黑腹果蝇没有)。成对基因中总是同一个基因被印记并因此失活;对一些基因来说来源于母本,对另一些基因来说来源于父本。在人类和小鼠中已有60多个基因显示有印记现象,既包括蛋白编码基因,也包括功能RNA的基因。印记基因在基因组散布,但倾向于成簇分布。比如,人第15号染色体有约2.2Mb的区段,包含有至少10个印记基因,第11号染色体1Mb的区段有8个印记基因。
人的一个印记基因的例子是Igf2,它编码一种生长因子,该蛋白参与细胞间信号通讯。只有父本基因是活化的(图2-20),在来源于母本的染色体上,Igf2区域的不同DNA片段是甲基化的,阻止该基因拷贝的表达。距离Igf2约90kb的另外一个印记基因H19,则以不同的方式印记:H19的母本是活化的,而父本是沉默的。基因印记是由印记控制元件(imprint control elements)控制的,印记控制元件是在印记基因簇几千碱基内所发现的DNA序列,控制了印记区域的甲基化。但其具体机制还没有详细描述过,印记的功能也尚不清楚。一个可能性是在发育中起作用,因为人工培育的单性生殖小鼠,具有两个拷贝的母本基因组,不能正常发育。基于一个种属雄性和雌性之间的进化冲突,也有人提出了更多精细的解释。Igf2在从母本遗传的染色体被印记,H19在父本染色体上被印记。此图未按比例绘制:两个基因间大约相距90kb。
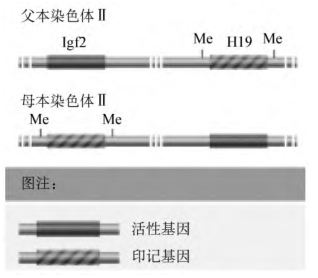
图2-20 人类第11号染色体的一对印记基因
(2)X染色体失活:这是印记的一种特殊形式,它导致雌性哺乳动物细胞的一条X染色体完全失活(图2-21)。这种现象的发生是因为雌性有两条X染色体,而雄性只有一条。如果雌性的两条X染色体都有活性,那么雌性中由X染色体上的基因编码的蛋白的合成速率可能是雄性的两倍。为了避免这种不利事件的发生,雌性的一条X染色体处于失活状态,在核中呈现出一种致密的结构,被称为巴氏小体(Barr body),完全由异染色质组成。在失活的染色体上,大多数基因是表达沉默的,但是因为某些未知的原因,其中有20%“逃避”了这个过程而成为有功能的基因。
失活发生在胚胎发育早期,并由弥散存在于每条X染色体上的X失活中心(Xic)控制。在每个发生X染色体失活的细胞中,由一条X染色体上的失活中心启动异染色质的形成。异染色质的形成从成核中心开始延伸,直至整个染色体受到影响,只有几个包括小基因簇的短片段仍保持活性。这一过程需几天时间完成,其精确的机制还不清楚,但与一个叫做Xist的基因有关,尽管不完全依赖于它。Xist处于失活中心,转录出一个25kb的非编码RNA,当异染色质形成时,这段非编码RNA覆盖了染色体,同时,还会发生各种组蛋白修饰。组蛋白H3第 9位赖氨酸被甲基化(这种修饰与基因组失活相关),组蛋白H4被去乙酰化(和异染色质中一样),组蛋白H2A被一个特定的组蛋白macroH2A1取代。某些DNA序列被DNA甲基转移酶Dnmt3a催化而高甲基化,尽管这一般发生在失活状态已经形成以后。X染色体失活是可遗传的,最初发生失活的细胞的所有后代都有同样的现象。
在一个正常的雌性二倍体,一个X染色体失活,另外一个保持活性。值得注意的是,即使在性染色体组成不正常的雌性二倍体,也只会有单个X染色体保持活性。比如在有些罕见的例子中,只有一个X染色体,则没有失活过程的发生;再比如,有的个体有3个X染色体,则其中两个会失活(图2-21A)。这意味着在核内应该存在X染色体计数和适当数目X染色体失活的机制。实际上,这个机制不仅仅计数X染色体,它也计数常染色体,并且将两个数目加以比较。因为如果细胞是二倍体而有4个X染色体,那么3个X染色体将会失活;但如果是4倍体(即有4个X染色体,每个常染色体也各有4个拷贝),则会有两个X染色体失活(图2-21B)。细胞如何计数染色体已经困扰细胞遗传学家多年,而且还一直困扰着我们,但是最新的研究表明,在X失活中心,有两个叫做Tsix和Xite的基因控制这个过程,因为这两个基因任何一个缺失或者过表达都会造成错误数目的染色体失活。
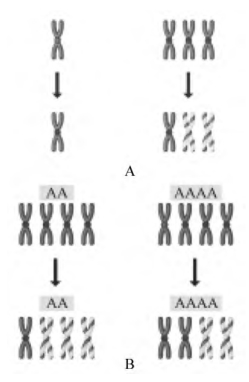
图2-21 X染色体失活
A.若只有单个X染色体,则不发生失活;若有3个X染色体,则两个失活;B.有两个常染色体(AA)和4个X染色体的二倍体细胞中,3个X染色体失活;而在四倍体细胞(AAAA),仅仅两个染色体失活
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















