复杂而有序的化学世界
到了1830年,已知元素的数目已猛增至50多个。显然,组成宇宙的不再是那少数“几种简单元素”,化学中到处充满混乱。
首先,人们不是用同样的符号表示同样的事情。许多奇怪和神秘的符号仍然留存,那是很久以前炼金术士从占星术那里借用来的。金的符号是一个圆圈,中间一个点;银的符号是月牙;硫的符号是向上的三角形;锑是小王冠。这些符号不具有实际意义。道尔顿提出一种系统,是用不同的圆来表示每一种元素,但是这仍然不便于记忆。1826年,贝采里乌斯想到一个简单的方法,就是用各个元素名字的第一个字母作为它的符号。O表示oxygen(氧),N表示nitrogen(氮), S表示sulfur(硫),如此等等。当第一个字母相同时,加上第二个字母以示区别。于是钙(calcium)是Ca,氯(chlorine)是Cl。这一系统至今仍在运用。不过在语言之间仍然存在某些混乱:德国化学家称氮为Stickstoff,而法国人称之为azote,英国人称之为nitrogen。因此,贝采里乌斯以拉丁化的名字作为依据,这样的符号就能在国际上通用。母语是英语的人们很幸运,大多数元素从其拉丁化的名字可以认得,只有少数例外,诸如金(Au)的英文字是gold,而拉丁文是aurum;银(Ag)的英文字是silver,而拉丁文是argentum;钠(Na)的英文字是sodium,而拉丁文是natrium。
凯库勒(FriedrichKekulévonstradonitz,1829—1896)也提出一种设想,这就是用结构图来表示分子中原子的排列。例如在凯库勒的系统中,水(H2O)变成了H—O—H。同样的,氨(NH3)的三个氢原子围绕一个氮原子组成一个三角形。不久凯库勒的结构图开始流行。
但是即使对于最普通的化合物,它的分子式也颇有争议。各种不同元素的原子量无法取得一致,用分子式表示时,分子里的原子非常混乱。像醋酸这样平常的化合物,不同派别的化学家竟采用不同的表达式,数目竟多至19种。

氨分子的结构
卡尔斯鲁厄会议
该是采取行动的时候了。处于运动中心的是凯库勒,他发起了第一届国际化学会议,试图澄清化学中的混乱。第一届国际化学会议,于1860年在德国一个小城卡尔斯鲁厄举行,它位于莱茵河边,对岸就是法国。共有140位代表参加,包括当时大多数杰出的化学家。
但是他们却是一群固执己见、互不让步的科学家,会议一开始就争议不休,没有得出任何结论,对原子量也没有共识。这时,坎尼扎罗(StanislaoCannizzaro,1826—1910)登上了讲台。
坎尼扎罗是一个热情奔放、好争善辩的人。1848年他从家乡意大利的西西里岛逃到法国,是为了躲避那不勒斯政府的迫害,因为他参加反对那不勒斯反动统治的起义,但是起义失败了。在法国,他对化学的混乱局面有过相当深入的思考。1858年,他发表一篇论文重提阿伏伽德罗假说,这个假说已被人们忘记几乎50年了。它说的是,(在同样温度下)同样体积的不同气体一定含有相同数目的粒子。他参加卡尔斯鲁厄会议就是为了给原子量、阿伏伽德罗假说和原子与分子的分界给予有力的辩护。他说,可用阿伏伽德罗假说确定气体的分子量,运用盖-吕萨克的化合体积定律,再用贝采里乌斯的原子量,三者相结合就可以解决许多问题。他还采用小册子的形式来散发自己的演讲稿,说服了许多与会者,会后不久又说服了更多的人。特别是,其中有一位回到俄罗斯后,对这个问题做了大量思考。
门捷列夫的单人牌
门捷列夫,具有一头飘逸的长发,还有一把灰色的胡须,威武挺拔的姿势,看起来更像是一名布道师,他曾经独自操纵一个篮子,挂在巨型气球下升空。这是1887年的一天,他希望从最靠近、最有利的位置拍摄日食情景,这就意味着要有一个单人飞行气球。面临难得的日食,他可不想放弃,于是毅然一个人起飞,照过相后着陆,然而当时他连最起码的操纵方法都不知道。他行为夸张,但富有原则和勇气,不怕怀疑和反对,不怕政治压力,也不怕驾驶飞行器。作为一个西伯利亚土著人,他就像一个巫术师那样,把化学家于18年前开始陆续发现的元素整理得井然有序。1955年,在他死后近 50年,他对化学和物理学的特殊贡献获得了完美的奖赏:一种新发现的元素被命名为钔,作为对他的纪念。
门捷列夫的母系也许有蒙古人的血统。他出生于一个大家庭,他是家中最小的一个孩子,他的祖父是西伯利亚第一份报纸的出版者,父亲是当地中学校长,机灵的母亲经营一家玻璃工厂。门捷列夫童年时曾从一位流放到西伯利亚的政治犯那儿学习科学。不幸的是,门捷列夫的父亲在他十几岁时就去世了,不久之后,母亲的玻璃厂也毁于火灾。于是,当大多数孩子都长大后,1849年,母亲带着这个最小的孩子来到俄罗斯的大城市,以便让他进入大学。在圣彼得堡,在父亲生前的一位朋友的帮助下,门捷列夫被大学录取。
大学毕业后,门捷列夫于1859年去法国和德国读化学研究生。在那里,他和本生(Robert Wilhelm Bunsen,1811—1899)一起工作,并在卡尔斯鲁厄参加了第一届国际化学会议,坎尼扎罗(Stanislao Cannizzaro, 1826—1910)关于原子量的雄辩使他着迷。1861年他开始在圣彼得堡大学任教,1866年被任命为技术化学教授。

古怪的俄国科学家门捷列夫发展了一种概念,叫做“周期表”,它帮助化学家认识元素之间的系统性关系。
有些科学家猜测,原子量的接近也许与元素间的相似性有关。例如,钴和镍的原子量如此接近,以至于大多数化学家当时都无法区分它们,而且它们的特性又如此相似。但是这一假说也存在问题。以氯和硫为例,原子量分别大约为35. 5和32,但一个是黄绿色气体,一个却是黄色固体——惊人的不同!于是,化学家开始寻找另外的关系。一些化学家根据元素之间在特性上的相似性,多年来一直在琢磨一个“三和弦”的设想,或者把某些看来是一“族”的元素归在一个类里。早在1817年,德贝赖纳(Johann Wolfgang Döbereiner,1780—1849)就已经注意到,某些相似元素组成的类里,原子量之间有某种相关性——处于中间位置那个元素的原子量等于其他两个元素原子量的平均值。例如,在钙、锶和钡这一“三和弦”中,锶的原子量(当时测定的是88),大体上是钙(40)和钡(137)的平均值。同样地,锶的熔点(800℃)也在钙(851℃)和钡(710℃)之间。钙在化学反应中相当活跃,钡更活跃,而锶则介乎其间!据此还可列出元素的其他特性,表明锶确实位于钙和钡的“中间”。这种“三和弦”关系很是迷人,其他科学家也参加了进来。
1864年,伦敦的工业化学家纽朗兹(John Alexander Reina Newlands, 1837—1898)第一个注意到,按原子量排序的元素表显示出这样一种模式:“从指定的元素开始,第八个元素是第一个的某种重复,就像音乐里八度音阶中的八分音符。”他称这一发现为“八度音阶定律”,但是,当他在化学家的会议上宣布这一思想时却遭到了嘲笑。有一位物理学教授福斯特(George Carey Foster, 1835—1919)嘲笑说,为什么不按字母排列,看看你会得到什么模式?纽朗兹的元素表固然有些错误,但事实上他看出了一种有用的模式。而福斯特,尽管是一位能干的物理学家,却因为发出嘲弄而使 自己受到嘲弄——这个例子表明,一个今天看来似乎难以行得通的科学思想,也许可以引导出明天的新见解 ,考虑欠周的嘲弄回过头来却是对嘲弄者本人的嘲弄。20多年后,皇家学会颁给纽朗兹戴维奖章,以奖励他的工作。
但是,针对元素排序的思想,门捷列夫的工作却是最具创造性,并且得出了逻辑性最强的结论。门捷列夫喜爱一种单人纸牌游戏。于是,他把所有已知元素、它们的符号、原子量和特性标注在卡片上。然后 ,他把它们分组排列。结果发现,如果把它们按原子量的增加来排序,类似的特性就会周期性地出现。例如,他发现氢(原子量为1,在他的表上是第一位)、氟(表上第9位)和氯(第17位)相隔都是八位,跟纽朗兹的“八度音阶”相似,具有相似的特性。他尝试把所有具有相似特点的类放在同一个竖栏中,这样他就得到了一个表,其中原子量从左上到右下逐渐增加。
但是门捷列夫的巨大胆量在于,当元素不适合表中的位置时,就像玩单人纸牌游戏一样,他意识到,也许没有把所有的牌拿在手中——有些牌可能仍然在牌盒里。所以,如果有一个空缺需要具有某种特性的元素来填充(但无人知道有这样的元素),他就在元素表中留一个空缺——它们还在纸牌盒里有待发现呢。他甚至还给其中一些起了名字:准硼、准铝和准硅。准铝位于铝下面,准硅位于硅下面。他还预言了它们的特性。这一工作发表于1869年,立刻被翻译成了德文(在这方面他远比以前的其他俄国科学家来得幸运,因为俄国人的工作没有及时得到翻译,往往许多年后才被别人知道)。但是在欧洲,人们都认为他是疯子,甚至有人轻蔑地把他当成俄国巫师。
元素留下的指印
正当门捷列夫从事周期表的研究时,一件神奇的新工具分光计问世了。事实证明,它不仅对化学家很有用处,而且对于天文学家和物理学家也很有用,今天依然如此。
这个想法最早出现于19世纪初一位年轻的光学技师夫琅和费(Joseph von Fraunhofer, 1787—1826)的身上。他是釉工的儿子,11岁时成了孤儿,给一位光学技师当学徒。在一个悲惨的日子里,他居住的楼整个倒塌,他是唯一的幸存者。但幸运的是,巴伐利亚的选帝侯马克西米利安一世(Maximilian I. Joseph, 1756—1825)得知这一悲惨事件后,给予他足够的钱,让他自己开业。
由于在工作中精益求精,夫琅和费为自己赢得了国际声誉,有好几位著名天文学家用上了他的棱镜和光学仪器。1814年,当他测试自己制作的透镜时,用到了一只棱镜——一个多世纪以前牛顿正是运用棱镜,把太阳的白光分解成光谱中的各种颜色。当夫琅和费这样做时,他注意到有一些奇怪的黑线,似乎打断了太阳光谱——实际上他至少看到了600条黑线,有的宽些,有的窄些,把整个光谱分成了好几部分。而当时牛顿用的棱镜质量比较差,由于玻璃的缺陷,造成图像模糊,因此没有看到这些黑线。
夫琅和费知道,光谱中的每一种颜色都对应于一种独特的波长。越接近光谱紫端,波长越短,而更长的光波处于红端。夫琅和费注意到,光谱中显著的黑线总是处于同样的位置。这些奇怪的黑线就好像是某种标志,它们肯定具有某些含义。他试着采用不同的光源——从太阳直接发出的光和经过月亮和行星反射的光,甚至星光。他发现,不同的星体似乎留下了不同的密码,不同的指印。但是没有人能够破译这些密码,夫琅和费在1826年死于肺结核,享年只有39岁,他没有能够找到这些黑线的含义。为了纪念他,人们把那些光谱线称做“夫琅和费线”。
半个世纪之后,海德堡大学物理学家基尔霍夫(Gustav Kirchhoff, 1824—1887)和本生(Robert Wilhelm Bunsen, 1811—1899)发明了一种他们叫做分光计的仪器——光线通过一条狭缝后再穿过棱镜,狭缝控制光源,结果不同的波长位于不同的位置,然后与标准刻度比较,就更易于区分和解释。
基尔霍夫和本生用本生设计的特殊燃灯(这种灯本身光线微弱),把各种不同的化合物加热到发光状态。他们注意到,每种化合物发出的光都具有独特的颜色标志。例如,如果把钠蒸气加热到发光状态,就会产生一条双黄线,这就是它的指印。一旦所有元素的指印都弄清,任何矿物或化合物——实际上就是任何物质——经过加热其成分都可以用这个方法来分析。更重要的是,分光计还可以鉴别特别微量的元素。
1859年 10月 27日,基尔霍夫和本生第一次公布他们的发明,分光计不可避免地开始一个接着一个地发现新元素。1860年 5月 10日发现铯,因为它发射清晰的蓝光而得名。第二年发现铷,红色谱线道出了它的存在。新一轮元素开始涌现。
1875年,一位名叫布瓦博德朗(Paul Emile Lecoq de Boisbaudran, 1838—1912)的法国化学家,在研究来自比利牛斯山脉的一大块锌矿石时,发现一条他从来没有见过的光谱线。他是在1859年首批进入这一激动人心的新领域中的研究者之一,在用分光计经过长达16年的搜寻之后,终于有了结果。他称之为镓(gallium),取自法兰西的拉丁文“gallus”(也可能是取自他自己的名字,因为Lecoq在法文中的意思是“公鸡”,拉丁文正好是gallus)。当门捷列夫读到新元素的描述时,欣喜若狂。镓的特性和他预言的准铝几乎完全一样!新元素很容易就放进周期表中属于它的位置。突然之间,每一个人都开始认真对待门捷列夫了。光谱学这一有力武器取得了胜利。
1879年发现另一种元素钪 (scandium,因斯堪的纳维亚半岛命名),它的特性几乎完全适合门捷列夫给准硼留下的位置。1886年发现的元素锗(germanium,因德意志命名),填补了准硅的空缺。至此,门捷列夫周期表得到了普遍承认。他以一个优秀科学家的工作方式,在似乎混乱无章的地方认出了自然的秩序。
但是没有人知道为什么存在这样的秩序,以及这种周期性。这需要知道原子核和它的结构,但19世纪科学家还没有准备放弃原子不可分的思想。随着元素的数目在不断增加,化学家似乎离他们最初所要发现的自然界的少数基本单元越来越远了。元素的数目很快超过了90。 (20世纪和21世纪这个数目还会增加,许多新元素是核化学家发现的。)
在 19世纪最后的5年中,著名英国物理学家斯特拉特(John William Strutt, 1842— 1919,更为人知的名字是瑞利勋爵)和他的助手,苏格兰化学家拉姆塞(William Ramsay,1852—1916,后来被封爵士)重复了100年前卡文迪什做的实验,这一次是用分光计。结果他们发现了氩。拉姆塞第二年又发现了氦,并且和特拉佛斯(Morris Travers,1872—1961)一起,发现了惰性(完全不起化学反应)气体氖、氪和氙。可是门捷列夫周期表没有给这些元素留下空缺。这样一来,周期表是否不再有效?不,回答很简单:这位伟大的纸牌游戏者在周期表的右侧遗漏了一整条竖栏,这些元素正好放在这一栏里。
有机化学的诞生
就在道尔顿、戴维及门捷列夫成功改造无机化学的同时,另一个更为混乱的领域也在经历重大变革。1807年,贝采里乌斯把来源于生物体的一类化合物称为有机物,而把不是来源于生物体的另一类化合物称为无机物。他认为,有机物的功能与无机物相比,受完全不同的规律控制,在许多方面差别极大。许多科学家,包括贝采里乌斯,假设这一差别来自某种“活力”的存在,这种活力仅与有机物相关,但只有生命体或曾经的生命体中才能找到或产生这种有机物。从未有人曾从无机物中创造过有机物。按照贝采里乌斯的说法,以后也不会有。
随后在 1828年的一天,贝采里乌斯的学生维勒(Friedrich Wöhler, 1800—1882)正在实验室里对氰化物作研究,他给氰酸氨加热。结果使他大吃一惊:他得到的化合物酷似尿素,但这在当时看来是不可能的事情,因为尿素作为尿液的一个组成部分,是哺乳动物的含氮排泄物,无疑是有机物。维勒有些难以置信,于是,他再测试他所制备的物质,证明确是尿素。1828年2月22日,他正式通知贝采里乌斯,他已从无机化合物中合成一种有机化合物。
贝采里乌斯是一个相当固执的人,他认为氰酸氨本身可能就是有机物,而不是无机物。这样一来,维勒的发现也许不那么确定。但是别的化学家却被他的成就激励,纷纷以其他无机化合物作为实验对象,结果发现有机化合物的确可以由无机材料合成得到。1845年,科尔比(Adolph Wilhelm Hermann Kolbe, 1818—1884)第一次成功地从化学元素直接合成了有机化合物(醋酸)。这说明也许根本就不存在什么“活力”。
但是,如果真的不存在活力,为什么比奥(Jean-Baptiste Biot, 1774—1862)在1815年发现,他在实验室里产生的酒石酸不能使光发生偏振(光波的横向振动偏向于某一方向),而葡萄产生的酒石酸却能使光偏振?这两批酒石酸具有同样的成分,同样的比例和同样的化学式。19世纪20年代,李比希(Justus von Liebig, 1803—1873)和维勒发现了更多这样的配对物。1830年,伟大的命名者,贝采里乌斯给具有同样化学式却有不同行为的成对化合物起了一个名字,叫做异构体。关于这一复杂性,维勒在1835年给贝采里乌斯的信中写道:“在我看来,有机化学就像是热带的原始森林,充满了令人惊异的东西。”
巴斯德对比奥发现的酒石酸异构体这一奇怪的化学现象首次进行了认真的研究。他把实验室合成的异构体分离成单个晶体,并证明它实际上还是会使光发生偏振的。只是有些沿一个方向偏振,另一些沿相反的方向。1848年,他有了答案。在实验室制成的物质中,两种晶体相互抵消,因此整个物质不使光发生偏振。
与此同时,凯库勒的结构式有助于解释这些复杂的有机化合物的内部构造,它们中的某些具有双键和三键构造,凯库勒就用两重破折号和三重破折号表示。异构体具有同样的原子和同样的比例,但联结方式不同。例如,普通乙醇可以用图1表示,而具有相同数目氢、碳和氧原子的二甲醚则可以用图 2表示。
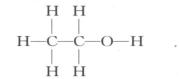
图1 普通乙醇的结构

图2 二甲醚的结构
1858年凯库勒指出,碳原子相互间可以直接连接(不像大多数其他原子),形成复杂的长链。他解释说,因为碳原子是四价的,它正好可以与四个其他原子化合。他还搞清楚,通过研究反应产物,可以确定一个有机分子的分子结构。
1861年,凯库勒出版了《有机化学》教科书的第一卷。在书中,他用简单明了的做法终止了长期以来纠缠不清的争论。他定义有机分子为含碳分子,无机分子为不含碳分子,根本不涉及它是否有生命或曾经有生命。这对有机分子含有某种莫名的、不可定义的“活力”论观念是一种沉重打击,并为审视有机化学领域提供了有用的新方法。
抓住环状
有机化学还有一个问题没有解决。没有人能够解释苯(C6 H6)的结构,这是1825年法拉第发现的煤焦油产物。当然,即使不知道苯的结构,珀金(william Perkin,1838—1907)和其他致力于染料合成的研究者仍然作出了进展。但是,没有人能够解释这些原子为什么能够互相结合在一起,正像普通分子的结合方式一样。
1865年的一天,凯库勒梦见了环的结构,他后来这样写道:
“我正坐着,在写我的教科书,但工作没有进展,我理不出个头绪。我转过椅子朝向炉火,开始打起瞌睡。原子又一次在我的眼前跳跃。这一次背景上 出现的是大量更小的组合。我那心灵的眼睛由于反复观看这类东西,现在可以分辨更大、更复杂的结构:长长地排成一列,有时挤在一起,缠绕和扭曲成蛇形运动。看!那是什么?有一条蛇咬住了自己的尾巴,在我眼前快速旋转。仿佛是被一阵灵感惊醒,就在这个晚上,我形成了这一假说。”
炸药、染料、香术和塑料:给工业的有机礼品
19世纪,从煤、水和空气这些原料,居然制出了好几种有利可图的化学合成物:炸药、染料、香水和塑料。
1846年,舍恩拜因(Christian Schonbein, 1799—1868)发现第一种合成炸药—— 化纤维素,这完全是出于偶然。有一天他在实验室里工作,用妻子的围裙擦掉溢出的化合物——也许是硫酸和硝酸。没有想到,围裙中含有的纤维素与酸结合,突然发生爆炸。硝化纤维素也叫做火棉,在早期的应用中由于意想不到的爆炸引起许多人死亡。
化纤维素,这完全是出于偶然。有一天他在实验室里工作,用妻子的围裙擦掉溢出的化合物——也许是硫酸和硝酸。没有想到,围裙中含有的纤维素与酸结合,突然发生爆炸。硝化纤维素也叫做火棉,在早期的应用中由于意想不到的爆炸引起许多人死亡。
1846年,还发现了硝化纤维素的一个衍生物,叫做硝化甘油。这两种物质常用于挖隧道和爆破,但它们实在是太活泼太不稳定了,有时还会带来灾难性后果。后来找到 了办法使这两种材料变得更温和,这才可以安全使用,这就是无烟火药和黄色炸药的问世。这些现代炸药的应用改变了大型工程的建设,它们包括公路、桥梁、隧道、水坝以及矿山。
1856年,有一位名叫珀金(William Henry Perkin, 1838—1907)的英国化学家,他从苯胺中偶然发现了一种紫红色染料, 因而开创了另一种化学工业。原本他是想合成人工奎宁(用于治疗疟疾),但是紫红色染料很快使他富有。珀金发现,苯胺在市场上买不到,于是他就从苯制造苯胺,而苯的结构不久被凯库勒破译。德国化学家霍夫曼(August Wilhelm von Hofmann, 1818—1892)第二年发现如何制作洋红色染料,于是德国很快就成为利润丰厚的人工合成染料工业中心。1868年,格雷贝(Karl Graebe, 1841—1927)在德国合成了一种名叫茜素的橙色结晶体,接着,拜尔(Adolf von Baeyer, 1835—1917)在1880年合成了靛蓝染料。(科学往往会产生附带效益,生物学家很快发现有些植物,特别是动物的细胞,如果用这些染料着色,在显微镜下可以更容易看见。)通过把凯库勒的苯环概念延伸至茶结构,格雷贝对认识有机分子的结构作出了贡献,拜尔在1883年发现了靛蓝的结构式。
1868年,珀金再次最先得到合成香水的成分香豆素,从这一发现中又生长出了另一个庞大的工业。
与此同时,随着赛璐路的合成,塑料制造业也在19世纪开始。1855年,英国化学家帕克斯(Alexander Parkes, 1813—1890)第一个把爆炸性的硝化纤维改变为不爆炸的(仍然是可燃的)物质。不久以后,美国发明家怀特(John wesley Hyatt,1837—1920)试图做出更好的台球以替代当时的象牙台球,为此他改进了帕克斯的赛璐路。在20世纪和21世纪里,不同类型的塑料层出不穷,从人造纤维、尼龙、聚酯之类的纺织品到可模压的、固体的塑料——有的柔软、有的坚固——运用于日常生活的方方面面,从水管到牙刷,从饮料吸管到淋浴窗帘。
凯库勒发现的正是我们今天所谓的苯环,一种由碳和氢组成的分子结构,它不是敞开的链条,而是封闭的六角形,单键和双键交替快速转换。
荷兰化学家范托夫(Jacobus Van’t Hoff, 1852—1911),把凯库勒的许多结构性想法转变成三维模型,从而可以澄清许多有机化学概念,其中包括比奥和巴斯德研究的异构体之谜。凯库勒的结构见解使有机化学走出世纪之初那种难以置信的混乱,尽管从那以后,又有许多理论上的改进,但是他的思想仍然指引着化学家的合成研究,并且提供一个模型,使有机分子更为形象化,从而对化学反应作出预言。
对于化学来说,19世纪是丰产的年代。有两个重要的新工具——电学和光谱学,使化学家获得了新方法来处理和观察物质,从而使这门学科大大改观,其情形就如同望远镜用在天文学和显微镜用在生物学一样。已知的元素数目几乎翻了一番。门捷列夫的周期表使这些元素各归其类,并且为未来在19世纪和20世纪之交以及20世纪初化学和物理学的大突破提供必要的基础。有机化学的诞生给应用化学打开了巨大工业潜力,其中包括新染料和新材料的发明。
最重要的是,原子论的诞生(或者宁可说是再生),使得道尔顿、阿伏伽德罗以及他们的追随者不仅认识到气体的特性,还开始把握了化学的规律——物质是怎样进行化学反应,又是怎样相互结合的。
当然,在道尔顿提出原子论之前,或者甚至到19世纪之末,并不是每个人都能认同原子论。具有高度影响的物理学家马赫(Ernst Mach, 1838—1916)直到去世时还在反对原子论。他说,观察到两份氢气跟一份氧气结合形成了水蒸气是一回事;假设两个看不见的氢原子跟一个看不见的氧原子结合形成一个也看不见的水分子,则完全是另一回事。但是大多数科学家还是承认,原子论至少提供了一个极好的模型,通过以符号代表原子和它们之间的相互作用,可以使讨论变得更清晰。
原子论还打开了通向这个世纪一个伟大的关键性发现的道路:对热的本质和热力学的理解——几个世纪以来这个领域一直笼罩在神秘的乌云下面。

凯库勒的苯环
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















