(一)骨折治疗技术的发展促进骨折愈合理论的探讨与反思
骨折创伤伴随整个人类历史。在这个过程中,骨折治疗技术的发展和骨折愈合理论的研究是不平衡的,人类探索骨折治疗技术要远远先行于探索骨折愈合机制。到目前为止,骨折的治疗技术日趋完善,但骨折愈合机制仍有许多问题有待阐明。
骨折因固定方式不同可以有不同的形态学表现,比如无明显骨痂形成的一期愈合方式,传统的骨痂愈合方式,牵引状态下的骨延长愈合方式等,这些不同的形态学表现并不代表骨折愈合的机制也是不同的。所谓BO,生物学接骨术,也基本属于治疗技术范畴,并未在骨折愈合机制上提出新鲜的生物学内容[1]。Ilizarov发现的牵拉成骨技术(distraction osteogenesis,DO)挽救了无数患者的肢体,是20世纪骨折治疗领域最为高耸的丰碑。在骨折愈合理论领域,任何理论家在这样的事实面前,都要重新反思以往的理论信念。
(二)骨折愈合的细胞机制与骨改建的细胞机制密切相关
骨折愈合机制主要指骨折愈合过程的细胞学机制,包括骨折愈合的启动过程,骨折愈合的参与细胞,骨折愈合的延续与终止原理等,也包括参与这一过程的多种细胞因子作用机制。骨折愈合机制应该对骨折愈合过程中的诸多临床现象从因果关系上给出合理的解释。
人体骨骼即使没有发生骨折,也每时每刻都在发生骨修复现象,即骨改建过程。骨改建是指骨骼内部结构的改造和重建,是由有时间和空间顺序的多种细胞共同完成的,完成骨改建的多种细胞被称为基本多细胞单位(basic multicellular unit,BMU)。大致分为3个阶段,第一阶段是激活阶段,这一阶段的细胞机制尚不清楚,结果是血液中的某种单核细胞被招募穿出血管,进入骨骼的血管周围间隙,被活化成为破骨细胞。然后进入第二阶段,即骨吸收阶段,由破骨细胞进行骨吸收,扩大空间。在这个空间内毛细血管纡曲增生,提供空间支架。骨吸收阶段持续1周以上。然后进入第三阶段,即成骨阶段。破骨细胞骨吸收后连接成骨细胞形成新骨,被称为破骨-成骨偶联。整个骨改建过程持续2周以上。结局是几乎在原来的位置形成新的骨单位。这种新骨形成方式又称为原位成骨(appositional bone formation)。骨松质的改建也由基本多细胞单位完成。
基本多细胞单位理论的提出得到了较为广泛的认可[2,3]。一个十分重要的理论问题是骨折愈合的细胞机制与骨改建的细胞机制是否相同或相似。骨骼因多种原因可以发生内部的微损伤,产生微小的裂隙。骨改建的重要功能之一就是修复这些微损伤,参与骨改建的细胞与参与骨折愈合的细胞也基本相同,最终结局也完全一样。因此,骨折愈合完全可能借用了骨改建的细胞机制,这个理论被称为骨修复一元论[4]。人类基因组计划已经证明人类的基因资源十分有限,骨修复一元论学说指出,即使人一生从未发生骨折,骨折愈合的细胞机制也并非沉睡的机制,而是每时每刻都在人体内发挥着重要作用。大量研究已经证实,参与骨折愈合的多种细胞因子,比如BMP超家族,OPG-RANKL-RANK系统等具有更为广泛的修复与免疫方面的生理功能,而不是在骨折后才发挥作用[5,6]。
(三)骨损伤的感受与骨修复的启动,血管内皮细胞发挥重要作用
骨折间隙的细胞学形态纷繁复杂,而骨单位的骨改建在形态学上简单明了,为研究骨折愈合的细胞机制提供了天然的理想模型。为说明问题,首先来复习一下骨单位的基本形态(图4-13)。骨单位的中央是血管通路,即哈弗管,仅占很小的横截面积。周围是4~6层呈同心圆排列的骨细胞,骨细胞具有大量发丝样的长长的管状细胞突起,呈放射样排列。骨改建只能从骨单位的中央区开始发生,表现为中央区扩大(图4-14)。
毫无疑问,骨折创伤本身是启动骨折愈合机制的基本原因。微损伤也被认为是启动骨改建的基本原因。问题是何种细胞可以作为创伤感受器来启动骨修复。骨组织简而言之只有两种细胞,即骨细胞(osteocyte)和血管内皮细胞。血管内皮细胞将骨组织与血液细胞隔离起来,确凿的证据表明,破骨细胞和成骨细胞均来源于血液中的干细胞[2,7]。从数量分布上看,也只有骨细胞和血管内皮细胞分布最广,可以候选作为骨损伤的感受器。骨细胞如果作为创伤感受器将有很大的局限,其一,骨细胞必须经过血管内皮来传递信息,其二,如果骨细胞决定骨改建的启动,必然是范围极其广泛,而事实并非如此。其三,在低应力非创伤条件下,骨改建同样活跃[8],这更难用骨细胞的作用来解释。
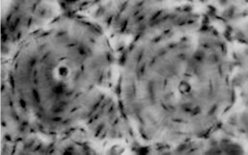
骨磨片,显示相邻的2个骨单位横断面

14 HE染色,黑色为血管内灌注的墨汁
事实表明,血管内皮细胞最适合作为骨创伤的感受器,并且血管内皮细胞可能是肌体创伤修复的共同感受器。其一,血管组织分布广泛,在骨骼位于骨单位的中央区,被周围的骨组织保护起来,这就决定了它对一般的应力刺激并不敏感,而只对损伤性刺激产生反应。其二,血管组织构成血液与骨组织的界面,是骨组织的门户,各种细胞进入骨组织没有其他的通路。其三,血管内皮细胞分泌多种细胞因子可以调节干细胞以及成骨细胞和破骨细胞的活动。比如血管内皮细胞可以分泌SDF-1(stromal cell-derived factor-1),是招募和吸引干细胞的重要细胞因子[7],血管内皮细胞分泌血管内皮素1(ET-1)通过旁分泌作用可以被成骨细胞和破骨细胞摄取[9],血管内皮细胞可以表达RANKL[6],通过与前破骨细胞表面标志RANK结合,可以活化破骨细胞。创伤引起的以血管为核心的炎症反应是创伤修复的基本前提。血小板及血小板相关因子参与其中,这方面的内容不在此讨论。
如果血管内皮细胞可以作为启动骨修复的感受器,那么就可以推论,除了应力和创伤因素之外,血流动力学异常同样可以启动骨改建和骨修复。这一推论也得到了广泛的实验支持。以幼狗为实验对象,动静脉瘘远端的胫骨明显增粗,重量增加,外骨膜有明显新骨生成[10]。兔子的胫骨短暂缺血也可以诱发骨膜增生反应[11]。Takato等设计了兔子胫骨带腘血管的岛状瓣,离断膝关节的所有韧带,形成不负重的悬挂胫骨,结果2周后可以发现胫骨的外骨膜有大量新骨形成[12]。以兔子为实验对象同样证明,每天对骨折部位以充气止血带加压1h,连续4周可以明显地促进骨折愈合[13]。因此,除了应力因素之外,充沛的血流是维持骨骼强度的重要因素。失重和截瘫都不会导致人体骨骼被完全吸收。
(四)骨修复需要一种特异性的识别机制,破骨细胞可能发挥至关重要的作用
目前基本明确骨折愈合的成骨细胞来源于骨髓或血液中的干细胞[7,14]。多能干细胞向成骨细胞转化需要一种扳机或引路机制。前面提到的血管内皮组织感受损伤是所有组织损伤后的共同反应,可以称为非特异性炎症反应阶段,抑制炎症反应的药物,比如吲哚美辛[15]、皮质类固醇激素等将通过这个途径影响骨折愈合。但新骨形成具有高度的组织特异性,具有多向分化潜能的血液干细胞为什么在骨损伤部位只分化为骨细胞而不是其他组织细胞?或者不在其他组织内分化为骨组织?显然是骨组织局部提供了特异性的组织分化信号。
骨修复一元论学说[4]为阐明骨折愈合的细胞学机制提供了十分宝贵的借鉴。因为参与骨改建的基本多细胞单位的时空顺序是基本明确的。其中最重要的就是破骨细胞骨吸收后衔接新骨形成的偶联过程,有人提出应该存在某种细胞因子来介导这一过程,并称之为偶联因子[16]。破骨细胞来源于血液的单核巨噬细胞系统[2]。这类细胞都有一个共同的特点,就是具有吞噬作用。巨噬细胞可以通过吞噬作用来识别外来物的特异性抗原,是最主要的抗原递呈细胞(antigen-presenting cell,APC)类别之一,具有重要的免疫学功能。破骨细胞的骨吸收作用很可能也是骨组织特异性修复的关键因素,或者说破骨细胞提供了干细胞向成骨细胞转化的扳机。
已经有证据表明,破骨细胞活化后可以表达并分泌多种骨形成蛋白,包括BMP-2,BMP-4,BMP-6,BMP-7等[16,17],而BMP已经被证实,可以直接通过BMP受体和Smads蛋白通路诱导干细胞向成骨细胞分化[16,17,18]。这为破骨细胞介导骨特异性修复提供了直接的证据。据此也可以推论,破骨细胞活动是骨折愈合的关键环节,调节破骨细胞的功能将影响骨折愈合。这个推论也得到了有力的实验支持。比如集落刺激因子可以改善破骨细胞的功能,增加破骨细胞的数量,可以明显促进骨折愈合[19]。降钙素可以抑制破骨细胞的功能,也可以明显抑制骨折愈合[20]。甚至有人提出局部注射破骨细胞来促进骨折愈合[21]。
虽然骨折愈合的细胞、分子机制极其复杂,现有的证据已经可以理出一个简单清晰的脉络。即骨折愈合可以分为非特异性炎症反应和特异性骨修复两个阶段,在非特异性炎症反应阶段,血管内皮细胞是识别损伤的感受器,可以分泌多种细胞因子,招募、吸附干细胞到局部组织。破骨细胞在局部的活化是特异性骨修复阶段的开始,很可能主要通过分泌BMP来促使干细胞向成骨细胞分化[16,17]。血管内皮细胞可能是肌体所有组织损伤的共同感受器,巨噬细胞也可能在其他组织的特异性修复过程中发挥关键的作用。
(五)骨折愈合机制的宏观表现
骨折愈合机制的细胞和分子事件属于微观层次的规律,这些微观事件具有一定的宏观表现,比如骨痂形成的时间和效率等。了解骨折愈合的宏观表现规律对解释各种临床现象和指导临床治疗至关重要。
1.初始骨痂反应的概念与骨修复事件的基本周期 首先面临的最基本问题是,骨修复究竟需要多长的时间周期。这个周期是由破骨细胞的活化以及干细胞转化为成骨细胞的时间决定的。最有价值的实验是McKibbin于1978年描述的老鼠截肢实验[22]。老鼠截肢后的骨残端也发生修复性骨痂反应,但由于缺乏远端的应力刺激,2周后这种骨痂反应即停止生长而发生退化。他把这种短时的一次性的骨痂反应称为初始骨痂反应(Primary callus response,PCR)。这个实验之所以重要,是因为截肢实验描述了隔离的一次性的骨修复事件。
初始骨痂反应概念的提出是骨折愈合理论研究的里程碑之一,提出了骨折愈合的最基本事件。这个实验直接提示,骨折愈合基本事件的时间周期大约为2周。这个时间周期被以后的多个实验所证实,Takato等在带血管的游离胫骨模型中观察到,最大量的新骨形成只发生在术后2周[12],实验性异位骨化以及老鼠跟腱损伤后的微孔弥散室培养等实验都提示2周这个关键的时间周期[23,24]。其中Rooney等的实验还间接地说明,骨修复的识别过程至少需要1周的时间[24]。这个时间周期与人体初次免疫应答时间惊人地吻合,并且启动过程都是巨噬细胞的特异性识别作用。破骨细胞与免疫细胞通过多种细胞因子可以相互影响,破骨细胞缺乏常伴有免疫缺欠,这种密切的联系开辟了一个新的领域,称为骨免疫学(Osteoimmunology)[25]。毫无疑问,人体的骨折愈合和创伤愈合都是免疫学过程。
2.骨折愈合的漫长过程是初始骨痂反应不断重复和积累的过程 初始骨痂反应(PCR)远远不能解释临床骨折愈合所需要的漫长时间,因此有人推论,骨折愈合需要一个长期的依赖于骨折远端存在的继发动力。很显然,骨折远端并不能提供新的物质。最合理的解释是,骨折近远端的相互作用只不过是复制了损伤反应,进而反复地重复了PCR。人体的所有细胞机制都是不断重复的过程,重复与复制是生命现象最基本的规律。
Hulth指出,反复的微损伤或骨痂骨折可产生丰富的成骨信号,进而促进骨折愈合过程,并以此解释骨延长机制[26]。假设每一次微损伤产生一次修复性PCR,那么,整个骨折愈合过程就是无数次PCR的积累。在这个前提下,PCR应具备如下特点[4]。
(1)饱和性:在一定范围内,PCR随损伤强度而增强,但存在饱和极限(图4-15)。这与局部的细胞及分子浓度有关。
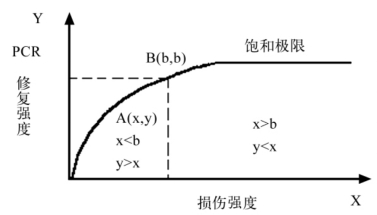
图4-15 PCR的饱和曲线:B(b,b)为平衡点。一次PCR不能修复一次,>b的损伤,但对于<b的损伤则可以产生过修复
(2)平衡点:指刚好能被PCR所修复的损伤强度。大于该强度的损伤都是破坏性的,而小于该强度的损伤则产生过修复(surplus repair)。过修复的积累是临床骨折愈合的源泉(图4-15)。骨折愈合需要一个最佳的应力范围已被实验证实和人们接受。
(3)不应期:在一次微损伤之后,即刻的再次损伤将不产生或只产生微弱的PCR。因为血管内皮细胞感受损伤刺激并表达趋化细胞因子需要一定的时间间隔。不应期可以解释骨折断端明显的异常活动可致骨不连。
3.在合适的条件下,初始骨痂反应具有放大的骨生成效应
在微损伤前提下,骨修复具有放大的成骨作用,即修复量大于损伤量,否则宏观骨折将无法修复。骨修复具有放大作用已被大量实验和临床现象证实。猪尺骨切除实验是最著名的实验之一。猪的尺骨切除后,桡骨的应力会成倍地增加,其外骨膜区会形成放射样骨痂,到了3个月,桡骨就会增粗到尺骨和桡骨加起来那样粗,其内部应力也降低到从前的水平[27]。异位骨化现象是在没有骨头的地方长出骨头,是骨修复具有放大成骨作用的天然佐证[28]。Ilizarov发现的骨延长愈合现象是骨折愈合理论研究的另一个重要里程碑,1mm的骨折间隙可以被延长100倍以上,可见骨骼的再生能力十分强大。骨延长愈合现象蕴涵着骨折愈合理论灵魂性的内容,即骨折愈合是初始骨痂反应不断重复的过程,初始骨痂反应具有放大的成骨作用[4,29]。
4.骨折愈合一元论学说及其对临床现象的解释 根据骨折愈合的形态学表现,可以将骨折愈合大致分为炎症反应期,骨痂形成期,初步愈合期和骨改建期[30]。但骨折愈合绝非一次性的漫长的单程旅行,而是骨修复基本事件不断重复的过程。每一次微损伤不但重复了骨痂形成反应,也重复了以血管为核心的非特异性炎症反应[29]。骨折愈合是间断事件的连续组合,根据局部的受力环境变化,具有不规则的脉冲样节律。初始骨痂反应是骨折愈合的基本事件,具有放大的成骨效应。骨折愈合的病理过程与生理性骨改建具有相同的细胞分子机制。这个理论称为骨折愈合一元论学说[4]。
骨折愈合一元论学说很好地解释了骨折愈合领域的诸多理论问题。指出骨折固定后应力遮挡效应的实质是妨碍了骨痂形成反应[29,31],一期愈合现象是应力遮挡效应的具体体现[29]。而骨延长愈合现象是充分利用了骨痂反应的放大成骨效应,在理论上解释了骨折愈合的效率原理[4,29]。指出骨不连并非骨折愈合已经完全停止,为不植骨可以治疗骨不连提供了理论基础,丰富了骨不连的定义内涵[32]。顺理成章地解释了骨折愈合的延续和终止机制。当骨折间隙达到一定的强度,不足以产生初始骨痂反应时,骨折愈合就自动终止了[4,29]。当然,当骨折断端完全脱离了接触,骨折愈合也将终止。
骨折愈合一元论学说也对取钢板后的再骨折问题给出了很好的解释。在钢板偏心固定的条件下,骨折愈合强度可能存在梯度差异,钢板对侧强度最佳,钢板下最弱,骨愈合强度可能达不到正常骨骼的强度,称为骨折的非坚固愈合状态。非坚固愈合状态不随延长固定时间而明显改善,是取钢板后再骨折的主要原因[33]。见图4-16。
骨骼如何长粗是骨病理生理学的一个基本问题。骨骼在受力过程中,外骨膜区域是天然的高应力区,内骨膜区域是天然的低应力区,由高应力激发的骨改建具有放大的新骨生成作用,从而导致外骨膜区域新骨生成增厚,而外骨膜区域的增厚反过来又进一步保护和降低了内骨膜区域的应力,从而导致该部位的吸收,髓腔扩大(图4-17)。猪的尺骨切除实验[27]很好地佐证了这个观点。而破骨细胞功能异常导致的骨硬化症则表现为骨骼增粗异常,长骨骨骼呈纺锤状[34]。

股骨骨折术后22个月的瑕疵愈合
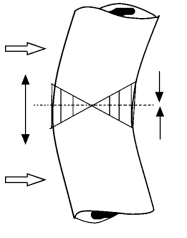
图4-17 骨骼在剪力作用下一侧外骨膜承受最大张力,对侧承受最大压力,内骨膜承受最小应力
综上所述,骨折愈合机制从细胞事件到宏观表现的规律已经显现出初步的轮廓,各种临床现象也由此从因果关系上得到了合理的解释[4,28,31,32,33]。但在骨病理生理学中仍然存在着许多重要的理论矛盾有待解释,其中最为核心的是破骨细胞的功能定位问题。以往把破骨细胞功能定位于单纯的骨吸收,并认为是破骨细胞的直接吸收作用导致了骨质疏松。遗憾的是这种观点在形态学上缺乏足够证据支持[35],因为到目前为止,骨质疏松症还是一个临床诊断而非病理诊断[36]。
骨骼的骨质疏松是均匀发生的,还是不均匀发生的?或者说是所有的骨单位都疏松,还是个别的骨单位疏松?如果是所有的骨单位都发生骨吸收,形态学上或将表现如图4-18,或图4-19,遗憾的是这两种特征性的形态都不存在,也就是说不能通过病理活检来确诊骨质疏松症。

18 破骨细胞深入骨骼陆地区的形态假设
尽管越来越多的证据支持破骨细胞是一种成骨辅助细胞,但破骨细胞通过OPG-RANKL-RANK通路影响骨骼密度已经是铁的事实,而且抑制破骨细胞功能导致骨硬化症,刺激破骨细胞功能导致骨质疏松[6]。既然病理学证据不支持破骨细胞的直接骨吸收作用导致了骨质疏松,就存在另一种可能,破骨细胞通过内分泌间接作用来影响骨骼密度,其调控对象很可能是骨骼最大的细胞群体,骨细胞(osteocytes)。把占骨骼90%以上的骨细胞排除在骨质疏松的发病机制之外,这在形态学上是不可思议的,而且在形态学上骨细胞最适合执行钙盐代谢功能[35]。

骨单位中央区骨吸收造成骨质疏松的形态假设
已经有证据表明,破骨细胞可以通过某种内分泌途径影响成骨细胞表达一种叫osteomodulin(OMD)的蛋白质[37]。血液循环中存在大量定向的破骨细胞与成骨细胞前体细胞[2,7],这种中间环节的生理意义尚不十分明确。如果破骨细胞或成骨细胞具有内分泌或免疫方面的调节功能,由血液中的循环细胞来完成就显得更为合理。破骨细胞与成骨细胞包括骨细胞的细胞间通讯机制目前尚不十分清楚。此外,细胞凋亡机制在骨骼的病理生理学中也发挥着十分重要的作用。对骨损伤的识别导致新骨形成,而对生理性凋亡的识别也许导致的是毫无痕迹的骨吸收[38]。
[1] 刘振东,马梦然 .从坚强内固定到生物学固定,历史的回归 .中华创伤骨科杂志,2004,6(8):910.
[2]Parfitt AM.Osteoclast precursors as leukocytes:importance of the area code.Bone,1998,23(6):491.
[3]Martin RB.Is all cortical bone remodeling initiated by microdamage?Bone,2002,30(1):8.
[4] 刘振东,马梦然,张志诚 .从骨折愈合论理论医学的萌芽 .中华创伤骨科杂志,2004,6(12):1393.
[5]Blitz IL,Cho KW.Finding partners:how BMPs select their targets.Dev Dyn,2009,238(6):1321.
[6]Rogers A,Eastell R.Circulating osteoprotegerin and receptor activator for nuclear factor kappaB ligand:clinical utility in metabolic bone disease assessment.J Clin Endocrinol Metab,2005,90(11):6323.
[7]Otsuru S,Tamai K,Yamazaki T,et al.Circulating bone marrow derived osteoblast progenitor cells are recruited to the bone-forming site by the CXCR4/stromal cell-derived factor-l pathway.Stem Cells,2008,26(1):223.
[8]Benfu Cai,Xiulin Zhu,Lianfang Yang.Effect of cast immobilization on bone turnover,a tetracycline double labelling investigation.Chinese Medical Journal,1980,93(5):316.
[9]Sasaki T and Hong M-H:Endothelin-1localization in bone cells and vascular endothelial cells in rat bone marrow.Anat Rec,1993,237:332.
[10]Vanderhoeft PJ,Kelly PJ,Janes JM and Peterson LFA.Growth and structure of bone distal to an arteriovenous fistula:Quantitative analysis of tetracycline-induced transverse growth patterns.J Bone Joint Surg,1963,45B:582.
[11]Svindland AD,Nordsletten L,Reikeras O,et al.Periosteal response to transient ischemia,histological studies on the rat tibia.Acta Orthop Scand,1995,66(5):468.
[12]Takato T,Harii K,Nakatsuka T,et al.Experimental study of vascularized bone:quantitative analysis of bone scintigraphy and histology.J Reconstr Microsurg,1988,4(5):391.
[13]Park SH,Silva M.Effect of intermittent pneumatic soft-tissue compression on fracture-healing in an animal model.J Bone Joint Surg Am,2003,85-A(8):1446.
[14]Kwong FN,Harris MB.Recent developments in the biology of fracture repair.J Am Acad Orthop Surg,2008,16(11):619.
[15]Dimmen S,Nordsletten L,Madsen JE.Parecoxib and indomethacin delay early fracture healing:a study in rats.Clin Orthop Relat Res,2009,467(8):1992.
[16]Garimella R,Tague SE,Zhang J,et al.Expression and synthesis of bone morphogenetic proteins by osteoclasts:apossible path to anabolic bone remodeling.J Histochem Cytochem,2008,56(6):569.
[17]Spector JA,Luchs JS,Mehrara BJ,et al.Expression of bone morphogenetic proteins during membranous bone healing.Plast Reconstr Surg,2001,107(1):124.
[18]Khanal A,Yoshioka I,Tominaga K,et al.The BMP signaling and its Smads in mandibular distraction osteogenesis.Oral Dis,2008,14(4):347.
[19]Sarahrudi K,Mousavi M,Grossschmidt K,et al.The impact of colonystimulating factor-1on fracture healing:an experimental study.J Orthop Res,2009,27(1):36.
[20]Almeide JD,Arisawa EA,da Rocha RF,et al.Effect of calcitonin on bone regeneration in male rats:a histomorphometric analysis.Int J O-ral Maxillofac Surg,2007,36(5):435.
[21]Cao X,Ren F,Zhang P,et al.Osteoclast injection:apromising approach of cell therapy to obtain higher bone union ratio.Med Hypotheses,2009,73(2):161.
[22]McKibbin B.The biology of fracture healing in long bones.J Bone Joint Surg,1978,60B:150.
[23]Aho HJ,Aro H,Juntunen S,et al.Bone formation in experimental myositis ossificans.Light and electron microscopy study.APMIS,1988,96(10):933.
[24]Rooney P,Walker D,McClure J.Cartilage and bone formation in repairing Achilles tendons within diffusion chambers:evidence for tendon-cartilage and cartilage-bone conversion in vivo.J Pathol,1993,169:375.
[25]Villa A,Vezzoni P,Frattini A.Osteopetroses and immunodeficiencies in humans.Curr Opin Allergy Clin Immunol,2006,6(6):421.
[26]Hulth A,Current concept of fracture healing.Clin Orthop,1989,249:265.
[27]Buckwelter JA,et al.Bone Biology.J Bone Joint Surg,1995,77A(8):1276.
[28]刘振东,刘景坤.肘部假瘤样骨化性肌炎1例及相关文献复习.中国矫形外科杂志,2009,17(7):555.
[29]刘振东,范清宇.骨折愈合的基本概念.中国矫形外科杂志,1998,5(5):459.
[30]Yamagiwa H,Endo N.Bone fracture and the healing mechanisms.Histological aspect of fracture healing.Primary and secondary healing.Clin Calcium,2009,19(5):627.
[31]刘振东,范清宇.应力遮挡效应——寻找丢失的钥匙.中华创伤骨科杂志,2002,4(1):62.
[32]刘振东,马梦然,田冠玉 .骨不连的界定与分类治疗 .中国矫形外科杂志,2007,15(20):1598.
[33]刘振东,马梦然,田冠玉,等对长骨干骨折钢板固定后非坚固愈合状态的探讨.中国矫形外科杂志,2008,16(8):639
[34]Shapiro F.Osteopetrosis:current clinical considerations.Clin Orthop,1993,294:34.
[35]刘振东,范清宇.Osteoporosis:do osteoclasts really play a role in the pathogenesis?Chinese Medical Jounal,1997,110(11):895.
[36]Lorenc RS,Misiorowski W,Karczmarewicz E.Critical points in strategies for the diagnosis and treatment of osteoporosis.Endokrynol Pol,2009,60(2):124.
[37]Ninomiya K,Miyamoto T,Imai J,et al Osteoclastic activity induces osteomodulin expression in osteoblasts.Biochem Biophys Res Commun,2007,19;362(2):460.
[38]Jilka RL,Weinstein RS,Parfitt AM,et al.Quantifying osteoblast and osteocyte apoptosis:challenges and rewards.J Bone Miner Res,2007,22(10):1492.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。













