目前在北虫草栽培中,均采用液体栽培种进行生产,其优点是:①生产周期短;②菌龄短且相对一致;③便于大规模工业化生产。
由于液体菌种接种后,所有菌丝都与培养基接触,扩大了发菌面积,菌丝生长迅速,一般7~10天即可发满。另外,液体菌种生产周期短,菌龄就短,生活力强。而且接种后生长恢复快,污染率低。液体菌种便于实行机械化操作,有利于提高工作效率。
但液体菌种也有不足之处:①不便贮藏,液体种存放时间长了表面易形成菌皮,使菌种老化,活力降低;②技术高,难度大,液体菌种的制作技术要求比固体菌种高,如对营养液配制、接种、动态培养过程及接种浓度等方面的技术要求都很严格。
另外,制作液体菌种需要相应的设备,如摇床、发酵罐等。
一、液体菌种的制作方式
液体菌种有静态培养和动态培养两种形式,静态培养是指在菌丝的整个培养期间基本处于静止状态,菌种表面为一层厚厚的白色菌膜,下面是棕黄色的澄清液体。(图4-13)动态培养是指接种后的整个培养阶段都处于振荡状态,制好的液体菌种呈混浊液,有悬浮的菌球。(图4-14)动态培养又分为摇床培养法和深层发酵法。

图4-13 静态培养的液体菌种
摇床培养法是运用摇床、电磁液体菌种机或叫振荡培养机来培养菌种;而深层发酵法是借助于液体菌种培养器(发酵罐)来完成。都是通过振荡来补充溶液中氧气的培养方式。近年来,我国的许多科研单位和大型企业都在对北虫草液体深层发酵技术进行研究,在发酵罐的改进、液体菌种制作和菌丝体培养及提取等方面都取得了很多成果,极大地促进了北虫草产业的发展。

图4-14 动态培养的液体菌种
二、静态培养法
静态培养的液体菌种称为悬浮液菌种。悬浮液菌种和下面介绍的动态培养液体菌种都可以直接用于北虫草栽培。由于悬浮液菌种在静止状态下培养,营养液表面长了一层很厚的菌膜,使菌液内菌丝量减少及活性减弱,所以在相同用量情况下,悬浮液菌种感染培养基的效果不及动态培养中的液体菌种。但制作悬浮液菌种设备比较简单,投资较少,技术容易掌握,对于经验不足的栽培者,可作为首选的制种方式,只是用种量要大一些,以增加侵染机会,提高成功率。下面介绍悬浮液菌种的制作技术。
1.培养基配方
①葡萄糖20克,黄豆粉10克,磷酸二氢钾3克,硫酸镁0.4克,味精0.1克,食盐0.3克,维生素B15片,水1000毫升。
②葡萄糖20克,玉米粉10克,黄豆饼10克,酵母粉2克,磷酸二氢钾1克,硫酸镁1克,维生素B14片,水1000毫升。
③蔗糖(白糖)10克,玉米粉50克,磷酸二氢钾3克,硫酸镁1.5克,维生素B12片,水1000毫升。
④葡萄糖30克,蛋白胨20克,磷酸二氢钾0.5克,食盐2.5克,水1000毫升。
⑤马铃薯200克,蛋白胨3克,葡萄糖20克,磷酸二氢钾1克,磷酸氢二钾1克,硫酸镁3克,维生素B11片,维生素B21片。
2.配制方法
按配方称好各种原料,如果配方中有马铃薯、玉米粉、黄豆饼粉等材料,要先用一定比例的水煮沸10分钟。马铃薯需要去皮,切成丝或小块。煮熟后进行过滤,滤液与其他配料混合,并补足水分。沉淀15分钟后,取清液分装于罐头瓶或广口瓶中,500毫升的罐头瓶装入150毫升,瓶中最好再装入几粒小玻璃珠。然后瓶口用聚丙烯薄膜封口并扎紧,进行灭菌。灭菌条件为:高压灭菌压力达到0.15兆帕持续40分钟;常压灭菌温度上升至100℃,持续8小时。
3.接种
接种要求严格按无菌操作规程进行。首先将灭菌后的培养基及母种和接种工具放在超净工作台上或接种箱内,然后对接种室、超净工作台或接种箱进行消毒。接种室和超净工作台开启紫外线灯,照射30分钟;接种箱按每立方米空间用10毫升甲醛加5克高锰酸钾的量进行熏蒸,或用气雾消毒盒、克霉灵等消毒药品进行消毒,熏蒸时间为30~40分钟。接种时,按无菌操作将母种接入液体培养基中,一支母种可以接4~5瓶。
4.培养
在培养期间有两种处理方法:一种是完全静止培养;另一种是间歇地摇动菌瓶。后者是在接种后静止培养2~3天,让菌丝恢复生长,当菌丝充分向四周伸展蔓延时开始摇晃瓶体,每天人工摇晃1~2次,使菌丝和分生孢子分散在营养液中,增加繁殖点数,摇晃3~5天即可,这种做法只适宜作少量菌种或实验室应用。停止摇晃后,随着菌丝继续生长发育,表面便形成白色菌膜,逐渐增厚,呈悬浮状态。两种处理方式的菌种表面形态是一样的,可能是处于完全静止状态培养的菌种,菌液中的菌丝量要少些(笔者没进行详细的数据分析)。
培养期间保持温度在18℃~24℃,空气相对湿度60%~70%,避光和通风条件良好。
接种时悬浮液菌种需在无菌条件下,将表面的菌膜打碎,与菌液的混合物一同接入培养基上。
三、摇床培养法
在动态培养液体菌种的方法中,相对来说,采用此法设备简单、成本低,是中小规模生产中常用的制种方法。用摇床培养的液体菌种可直接用于栽培生产。近年来,这种制种方式更为普遍。
摇床生产液体菌种的工艺流程:培养基配制→分装→灭菌→冷却→接种→上摇床培养→检查→一级液体种→二级液体种→应用。
1.培养基配方
液体培养基的配方与母种基本相似,只是没有起固化作用的琼脂。
①马铃薯200克,红糖20克,磷酸二氢钾3克,硫酸镁1.5克,VB14片,VB62片,水1000毫升。
②马铃薯100克,麸皮200克,玉米渣100克,葡萄糖20克,硫酸镁1克,磷酸二氢钾2克,水1000毫升。
③马铃薯200克,麸皮200克,红糖20克,磷酸二氢钾2克,硫酸镁1克,VB14片,VB62片,水1000毫升。
④马铃薯100克,麸皮100克,磷酸二氢钾1克,硫酸镁0.5克,蛋白胨5克,蔗糖20克,水1000毫升。
⑤蛋白胨2克,玉米渣50克,葡萄糖5克,黄豆饼粉1克,蚕蛹粉5克,磷酸二氢钾1克,硫酸镁0.5克,水1000毫升。
⑥玉米粉30克,黄豆饼粉20克,酵母粉10克,磷酸二氢钾1克,硫酸镁0.5克,蛋白胨1克,水1000毫升。
⑦马铃薯200克,葡萄糖20克,黄豆10克,蛋白胨20克,牛肉膏3克,VB120毫克,VB210毫克,水1000毫升。
2.配制
液体培养基配制同母种,只是盛装容器不同。摇床培养的容器常采用三角瓶、滴流瓶。瓶子不宜太大,以500毫升或250毫升为宜。配制时如果配方中有马铃薯、黄豆饼粉、麸皮、玉米渣等材料,要先用一定比例的水煮沸10分钟。马铃薯要去皮,切成丝或小块。煮后进行过滤,滤液与其他配料混合,并补足水分。将制备好的培养基趁热分装,装瓶量不能过多,一般500毫升的三角瓶装量不超过300毫升,250毫升三角瓶装量不超过150毫升,分装后塞上棉塞,棉塞上面用牛皮纸包好。(图4-15)也可将培养基装入较大的容器中进行灭菌,灭菌后在无菌条件下分装在培养瓶中。(图4-16、4-17)注意分装时不要使培养基粘在瓶口上,以免引起污染。

图4-15 液体菌种培养基分装三角瓶

图4-16 液体菌种培养基
图4-17 液体菌种培养基高压灭菌
3.灭菌
液体培养基一般都采用高压灭菌,灭菌条件为0.11~0.12兆帕(121℃~126℃),持续40分钟。自然降压后,取出培养基移入接种室(箱)中,冷却后接种。
4.接种
斜面菌种要求菌龄短、活力强,对于保存的菌种在使用前要进行纯化复壮,以充分保持其纯度和较强的活力。
接种前,要将接种室、无菌箱或超净工作台以及接种工具进行彻底消毒,紫外线灯照射和药物熏蒸时间要达到30分钟,接种工具要在火上灼烧,点燃酒精灯进行操作。
在无菌条件下,按照无菌操作规程将斜面菌种接入灭菌过的三角瓶或试剂瓶培养基中,接种量要比其他菌类的接种量多一些。例如:对于装有250毫升培养基的三角瓶,一支较大的试管可以接两瓶,试管小或菌种量少的只能接一瓶。接种时,要将斜面前缘干缩部分去掉,最好挑取菌丝生长旺盛的中间部分(3~4厘米),并用接种针将母种菌块捣碎,接于液体培养基中。或者将母种菌块接入液体培养基之后,再用已消毒的小型电动装置(如微型木雕电钻)将菌种块打碎,转动时间为3~5分钟,打至1~2毫米大小的颗粒。之后将棉塞在酒精灯火焰上烘烤一下塞入瓶口,上面再包上一层牛皮纸扎紧。
5.培养发菌
接种后在(22±1)℃条件下,静止培养24小时,以利菌丝恢复生长。之后摆在摇床上,固定好,开始振荡培养。(图4-18)保持频率120~160转/分钟,室内温度20℃~24℃。2~3天后停下来,进行检查挑选,挑出有杂色或太混浊、有异样的菌瓶,其他的继续振荡培养。再经过3~4天即结束培养。(图4-19)振荡时间过久,会造成瓶内缺氧,菌丝窒息死亡。制好的菌种为一级液体种,可直接用于生产。

图4-18 机械摇床培养

图4-19 不同配方的摇瓶菌种
培养了一级液体菌种之后,根据生产对液体种的需求量,确定是否生产二级液体种。二级液体种的培养基配方同一级种,培养容器要大些,可采用1000毫升三角瓶,每瓶装培养基的量不超过600毫升,高压灭菌压力为0.11~0.12兆帕(121℃~126℃),持续40分钟,冷却后接种。按5%~10%的比例接入。同样静止24小时后上摇床培养,但转速要慢些。经一定时间的振荡培养,就可得到菌丝球分布均匀、发酵液清澈透明的液体菌种。
做液体菌种时,要求菌球不宜过大,因为大颗粒的菌丝球不仅接种不便,而且由于“发育点”少,接种效果不佳。菌丝球大小与振荡频率和培养基黏度有关,振荡频率越大,菌丝球越小;黏度越大,菌丝球越小。
优质的液体菌种其培养液内菌球直径在1毫米左右,菌球和菌丝总量占菌液的80%以上。
值得往意的是,如果培养液变混浊可能有两种情况,一是细菌污染,应予以淘汰;二是由于菌丝生长过分乳稠所致。若难以判断,可进行镜检。
四、液体深层发酵法
液体深层发酵法的主要设备是液体菌种培养器(发酵罐)。随着液体菌种的广泛应用,液体菌种培养器的研制有了很大的进展,出现了多种型号、多种功能、不同容量的换代产品,更具有使用方便、污染率低等优点,使液体菌种的应用更为普及,特别是在北虫草栽培和食用菌工厂化生产中,已是必不可少的重要设备。
1.培养基配方与制备
培养基配方与摇床培养法中的配方基本相同,而制备方法一般是与装罐结合起来。装罐之前,要将罐内清洗干净,并对培养器的机械、电气部件进行全面检查,还要进行空罐消毒。
制备培养基时,首先将配制好的培养基倒入罐内,装入量要适当,不能太满,要符合该设备要求的容量。或者直接向罐内加水,再将营养物质用温水溶解之后倒入罐中。用麦麸、玉米渣等配料的,同样需要煮汁、过滤、溶入其他营养成分,然后再倒入罐中。补足应加的水分,拧紧罐口进行灭菌。
2.灭菌与冷却
液体菌种培养器可直接进行灭菌,当需要灭菌时,将温度控制在120℃~125℃,压力为0.12~0.13兆帕,保持30~40分钟。灭菌结束后利用冷却水对罐体进行冷却。冷却至料温25℃~28℃,压力降至0.03兆帕时,一般经过通入无菌氧气,开启排气阀调节 压力,保持0.03兆帕,便可接种。
3.接种
罐内接种所用的种源主要是摇瓶菌种,也可以利用试管母种。如果利用试管母种,要在无菌条件下将其接入已灭菌的液体培养基中,并将菌块打碎。摇瓶菌种可以直接使用。
接种前要将放置液体菌种培养器的房间进行消毒,然后利用火焰保护进行接种。接种时,首先将封口火圈点燃,压在进料口上,在火焰中打开进料口,将种液倒进罐内,迅速把口盖好,拧紧。
4.培养
培养期间发酵罐控制压力为0.02~0.05兆帕,温度为(22±1)℃,当温度高于培养温度时,要用冷却水进行冷却,保持最适温度。培养3~5天即可。
5.发酵中检查
在北虫草的液体深层发酵过程中,为了保证菌种的质量和掌握菌丝的生长情况,需要经常进行检查,通过目测和显微镜检查的结果,确定是否结束培养。
五、液体菌种的质量检测
1.目测法检测

图4-20 优质液体菌种
液体菌种终止培养后,静止一段时间,使里面内容物完全处于静止状态,这时取样仔细观察。如果菌丝球均匀地分布于整个三角瓶中,发酵液清澈、无异味,有虫草菌的特别气味,表示符合质量要求。(图4-20)如果培养液混浊、有异味,如酸、臭、酒精味等各种异味,可能是细菌、放线菌、酵母菌污染所致,就不能作为菌种使用。由于菌液中加入了糖等营养物质,灭菌后溶液呈浅茶红色,随着营养被菌丝利用,溶液颜色越来越淡,绝大多数的菌液呈淡黄色或橙黄色。但颜色的深浅也与培养基配方中的成分有关,因此,要综合考虑颜色问题。
2.污染的检测
液体菌种的少量污染不易被发现,不如固体菌种污染明显,因此,对液体菌种要进行早期检查,准确快速地做出诊断,否则会造成严重的损失。常用的检测方法如下。
(1)显微镜检查
在液体菌种培养过程中定时取样(每隔8~12小时)进行涂片、镜检。方法是用接种针取培养液少许,点在载玻片上,涂均,放在显微镜下观察。如发现异样菌体或菌体碎片等情况,表明已经污染。(图4-21)
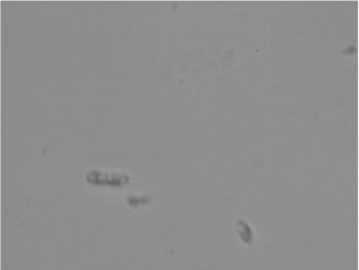
图4-21 镜检菌种中的细菌
(2)划线培养检查
在液体菌种培养过程中,按无菌操作规程用接种针取样,在事先做好并灭菌过的平板培养基上进行划线接种,置于28℃~30℃下培养。如果有杂菌菌落出现,表明已经污染。
(3)肉汤培养检查
用接种针取培养液接入酚红肉汤培养基试管中,置于28℃~30℃下培养,如果溶液由红变黄,表明培养液中染有细菌;如果溶液红色不变,则无细菌污染。检查细菌的酚红肉汤培养基配方:蛋白胨1%,葡萄糖0.3%,牛肉膏0.3%,氯化钠0.5%,酚红0.003%,pH值为7.4~7.5。高压灭菌121℃持续30分钟。
3.菌丝体(菌球)状态检查
(1)活力检查
通过显微镜观察北虫草菌丝球的大小,菌丝球的边缘,菌丝的粗细、分支、着色程度,菌泥的下沉来判断菌丝的活力。(图4-22、4-23)

图4-22 菌丝旺盛生长
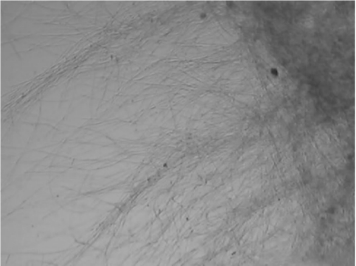
图4-23 菌球边缘
一般来说,接种初期,菌块周边长出白色菌丝,随着菌丝生长和不断繁殖,部分菌丝断落到菌液中而产生新的菌球,然后菌球逐渐增大,培养液中的菌球也不断增多,达到最大的浓度(一般为80%)。优良菌种取样后静置菌液基本不分层,料液的黏度高,菌丝(球)悬浮力好,菌球大小均匀。老化的菌种菌液颜色会逐渐变深,菌球轮廓不清,边缘的菌丝较短,甚至自溶成为粥状物。(图4-24)

图4-24 老化的菌丝球
(2)菌丝球数量测定
取不少于50毫升的培养液,按一定比例在带塞的量筒中加水稀释,摇匀后取一定量在直径150毫米的培养皿中摊匀,培养皿下垫方格纸,用方格法计数。
菌球数(个/100毫升)=[培养皿菌球总数(个)/稀释液取用量(毫升)]×稀释倍数×100
优良的液体菌种菌球浓度达到1000~1500个/毫升,或经3000转/分钟离心10分钟,菌泥湿重在20~25克/100毫升。
(3)菌丝球大小测定
在培养皿中取30个以上菌球排成一列,测量总长度,精确至1毫米。
菌球平均直径(毫米/个)=菌球总长度(毫米)/菌球数(个)
(4)菌丝浓度测定
在液体菌种的菌液中(静止培养的除外),有肉眼能看到的菌球和一些菌丝体,也有看不到的菌丝和分生孢子。这里的菌丝浓度是指单位体积液体菌种中含有该菌类有机体的量。可用显微镜直接计数法测定。
方法是将液体菌种在无菌条件下,用微型电钻将菌球打碎,形成菌丝片段,稀释后将菌液滴在血细胞计数板上,在显微镜下参照单细胞计数法计数。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















