第四节 分离物的鉴定
分离物的鉴定可通过测定其培养特性和生化特性进行。在丙酮酸盐固体培养基上,牛结核分枝杆菌的菌落光滑、色灰白。 37℃下生长缓慢,22℃或45℃不生长。该菌对噻吩-2-羧酸肼(TCH)、异碱酸酰肼(INH)敏感。这可以在含鸡蛋培养基或Middlebrook 7H10/7H11琼脂培养基上生长得到证实。含鸡蛋培养基必须不含甘油,牛结核分枝杆菌生长良好,而且不含丙酮酸盐,因为丙酮酸盐能抑制INH,对TCH(INH的类似物)也有类似影响,所以会产生假阳性结果。牛结核分枝杆菌对对氨基水杨酸和链霉素也较敏感。有效的药物浓缩液对牛结核分枝杆菌的作用在琼脂或鸡蛋培养基上各不相同。此外,牛结核分枝杆菌不产生烟酸,不能使硝酸盐减少。在酰胺酶试验中,牛分枝杆菌为尿素酶阳性,烟酰酶和吡嗪酰胺酶阴性,微需氧,不产色素。鉴定还可用其他试验,包括DNA分析技术等。
一、牛型、禽型和人型结核分枝杆菌生化试验鉴定
牛型、禽型和人型结核分枝杆菌的鉴定,主要依据生化试验和动物试验。牛型、禽型和人型结核分枝杆菌的生化试验特性见表3-1。
表3-1 生化试验特性
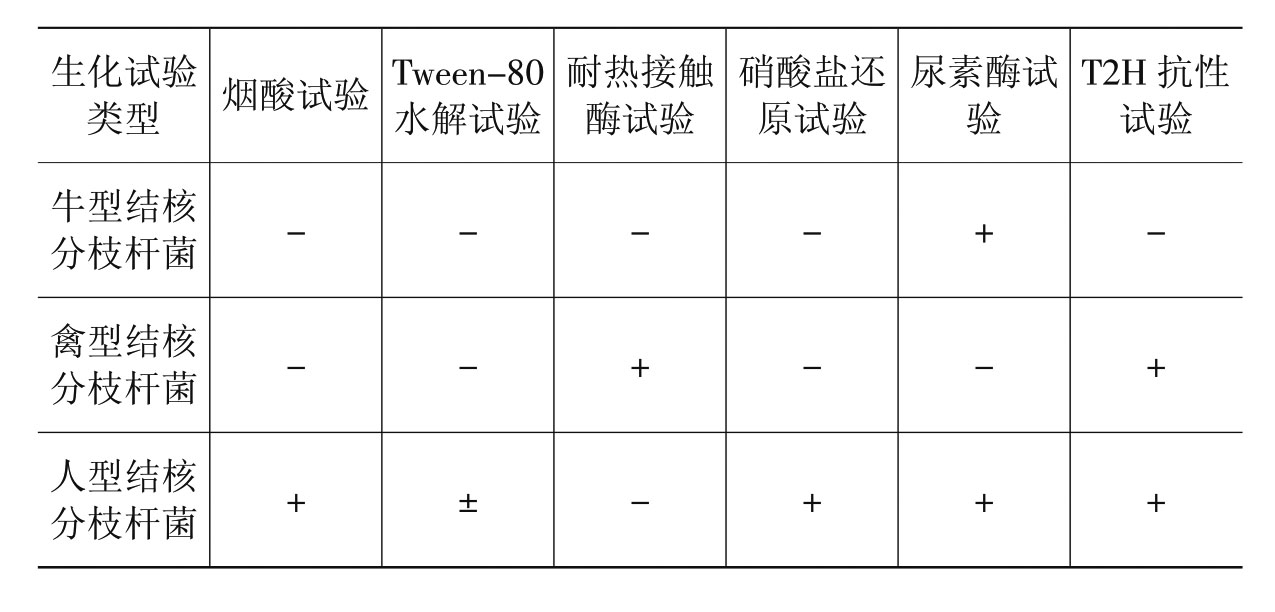
1.烟酸试验
试验方法:以热蒸馏水浸泡固体培养基上的培养物15~30分钟。每个培养物分装入2支试管中,每管0.4ml,再加入3%联苯胺乙醇溶液0.2 ml。然后向其中一管加入10%溴化氰溶液(此液剧毒,应在通风橱内操作)0.2 ml。
结果判定:凡含10%溴化氢溶液的试管出现桃红色沉淀,另一管只产生无色沉淀者判为阳性;两支试管都为产生无色沉淀者判为阴性。
2.吐温-80(Tween-80)水解试验
试验方法:向100 ml磷酸缓冲液(pH 7.0)中加入0.5 ml Tween-80、2 ml 0.2%中性红溶液。经112 kPa灭菌20分钟,分装于试管中,每管2 ml。在4℃~10℃可保存2周。
取上述试管,加入10 mg/ml的菌液0.5ml,37℃培养,3~5天观察结果。
结果判定:试管内由原来的琥珀色变为桃红色或红色者判为阳性。无颜色变化者为阴性。
3.耐热接触酶试验
试验方法:用生理盐水配制出5~10 mg/ml的菌液,分装试管,每管0.5 ml,以68℃水浴20分钟,冷却后加入0.5 ml过氧化氢(H2O2)和Tween-80混合液(10%Tween-80加等量30%H2O2)。观察结果。
结果判断:肉眼观察,如有多量小气泡自管底升起,即为阳性,否则为阴性。
4.硝酸盐还原试验
试验方法:在100 ml pH7.0的磷酸盐缓冲液中,加入硝酸钠85 mg,经112 kPa灭菌20分钟后分装,每管2 ml。向上述溶液中加入10 mg/ml的菌液,经37℃水浴2小时后,加入1滴2倍稀释的盐酸,2滴0.2%氨苯磺胺,2滴0.1%N-甲基盐酸二氨基乙烯。在4℃~10℃存放2周后判断结果。
结果判定:呈粉红色至紫红色者为阳性。无色或淡粉色为阴性。
5.尿素酶试验
试验方法:将被检材料接种于尿素培养基上,37℃培养。
结果判定:在尿素培养基上长出结核分枝杆菌菌苔(或菌落),并且使培养基变成红色,即为阳性;培养基不变色为阴性。
6. T2H(α-羧酸肼噻吩)抗性试验
试验方法:将被检材料接种于T2H培养基和L-J(罗氏)培养基上,37℃培养。
结果判定:在上述两种培养基上长出结核分枝杆菌菌苔(或菌落)即为阳性。若在L-J(罗氏)培养基上生长,而在T2H培养基上不生长,则为阴性。
二、动物试验
牛型、禽型和人型结核分枝杆菌的动物试验特性见表3-2。
表3-2 动物试验特性
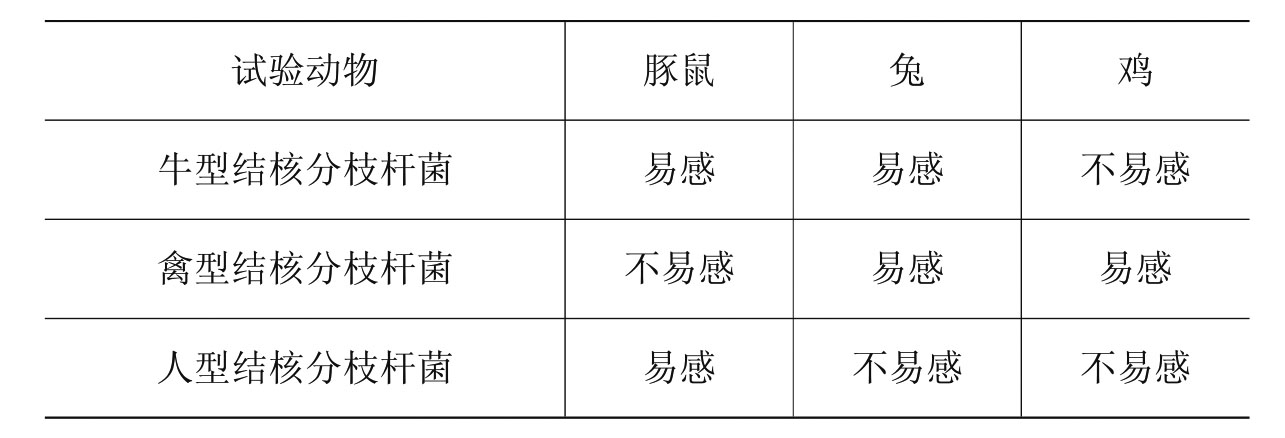
1.试验方法
实验动物在试验前,应进行结核分枝杆菌PPD皮内变态反应试验。豚鼠用牛型结核分枝杆菌PPD检测,鸡用禽型结核分枝杆菌PPD检测,兔用牛型和禽型结核分枝杆菌PPD检测。
将处理过的病料1~3 ml,选用皮下、肌肉或腹腔内途径注射试验动物,每份病料至少接种2只同种试验动物。
接种后30天左右,对豚鼠用牛型结核分枝杆菌PPD检测;对鸡用禽型结核分枝杆菌PPD检测;对兔用牛型结核和禽型结核分枝杆菌PPD检测。如有阳性反应,可剖检其中的半数动物进行病理学观察、细菌培养和涂片镜检。另一半继续观察至3个月再剖检观察。如果为阴性反应,可于40天左右剖检其中的半数,观察病理学变化、细菌培养和涂片镜检,另一半继续观察至3个月再剖检观察。
2.结果判定
(1)牛型结核分枝杆菌感染:鸡用禽型结核分枝杆菌PPD检测阴性,无任何病变,细菌培养和涂片镜检都未见到结核分枝杆菌。同时,从豚鼠和兔检测到结核分枝杆菌,或豚鼠和兔的牛型结核分枝杆菌PPD皮内变态反应试验阳性并观察到典型病理变化。
(2)禽型结核分枝杆菌感染:豚鼠用牛型结核分枝杆菌PPD检测阴性,无任何病变,细菌培养和涂片镜检都未见到结核分枝杆菌。同时,从兔和鸡检测到结核分枝杆菌。或兔或鸡的禽型结核分枝杆菌PPD皮内变态反应试验阳性并观察到典型病理变化。
(3)人型结核分枝杆菌感染:仅从豚鼠检测到结核分枝杆菌,或仅豚鼠的牛结核分枝杆菌PPD皮内变态反应试验阳性并观察到典型病理变化。
将牛分枝杆菌与引起结核病的其他成员,如结核分枝杆菌(引起人类结核病的主要病原)、非洲分枝杆菌(为结核分枝杆菌和牛分枝杆菌中间型)和田鼠分枝杆菌(为野鼠类杆菌,极少遇到的病原)区分开十分必要。按上述提及的试验方法可以把牛分枝杆菌与其他分枝杆菌区分开。
有时可以从牛结核病样病变的牛中分离到禽分枝杆菌。对这样的病例,须仔细鉴定禽分枝杆菌,要排除与牛分枝杆菌的混合感染。结核分枝杆菌可引起过敏牛对牛结核菌素的反应,但不出现明显的结核病变。
三、PCR检测
1. PCR原理与反应条件
(1)原理:DNA的半保留复制是生物进化和传代的重要途径。双链DNA在多种酶的作用下可以变性解链成单链,在DNA聚合酶的参与下,根据碱基互补配对原则复制成同样的两分子挎贝。在实验中发现,DNA在高温时也可以发生变性解链,当温度降低后又可以复性成为双链。因此,通过温度变化控制DNA的变性和复性,加入设计引物、DNA聚合酶、dNTP,就可以完成特定基因的体外复制。
但是,DNA聚合酶在高温时会失活,因此,每次循环都得加入新的DNA聚合酶,不仅操作繁琐,而且价格昂贵,制约了PCR技术的应用和发展。
发现耐热DNA聚合酶-Taq酶对于PCR的应用有里程碑的意义,该酶可以耐受90℃以上的高温而不失活,不需要每个循环加酶,使PCR技术变得非常简捷,同时也大大降低了成本,PCR技术得以大量应用,并逐步应用于临床。
PCR技术的基本原理类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。PCR由变性—退火—延伸三个基本反应步骤构成:①模板DNA的变性:模板DNA经加热至93℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应作准备。②模板DNA与引物的退火(复性):模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合。③引物的延伸:DNA模板—引物结合物在TaqDNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基互补配对与半保留复制原理,合成一条新的与模板DNA链互补的半保留复制链,重复循环变性—退火—延伸三过程就可获得更多的“半保留复制链” ,而且这种新链又可成为下次循环的模板。每完成一个循环需2~4分钟,2~3小时就能将待扩目的基因扩增放大几百万倍。
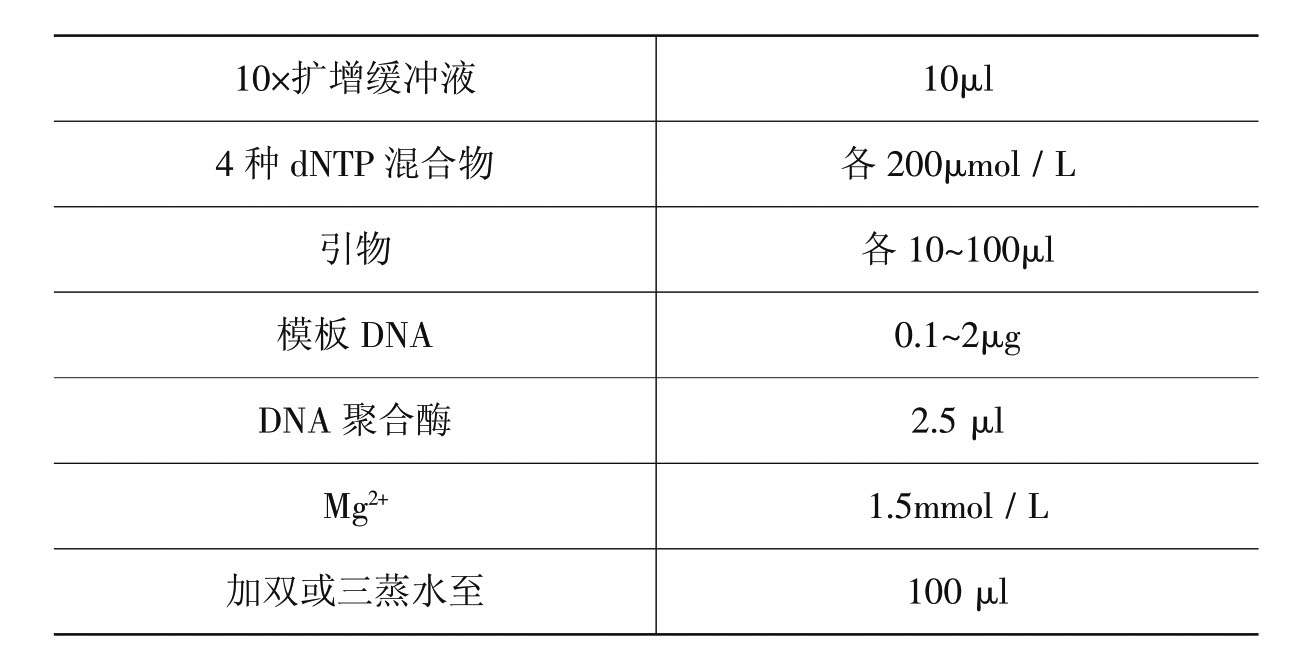
(2)标准的PCR反应体系:PCR反应五要素,参加PCR反应的物质主要有五种,即引物(PCR引物为DNA片段,细胞内DNA复制的引物为一段RNA链)、酶、dNTP、模板和缓冲液(其中需要Mg2+)。
表3-3 反应物质标准的PCR反应体系
(3)PCR引物设计:PCR反应中有两条引物,即5′端引物和3′引物。设计引物时以一条DNA单链为基准(常以信息链为基准),5′端引物与位于待扩增片段5′端上游的一小段DNA序列相同; 3′端引物与位于待扩增片段3′端的一小段DNA序列互补。
引物设计的基本原则:
①引物长度:15~30bp,常用为20bp左右。
②引物碱基:G+C含量以40%~60%为宜,G+C太少扩增效果不佳,G+C过多易出现非特异条带。ATGC最好随机分布,避免5个以上的嘌呤或嘧啶核苷酸的成串排列。
③引物内部不应出现互补序列。
④两个引物之间不应存在互补序列,尤其是避免3 ′端的互补序列重叠。
⑤引物与非特异扩增区的序列的同源性不要超过70%,引物3′末端连续8个碱基在待扩增区以外不能有完全互补序列,否则易导致非特异性扩增。
⑥引物3′端的碱基,特别是最末及倒数第二个碱基,应严格要求配对,最佳选择是G和C。
⑦引物的5′端可以修饰。如附加限制酶位点,引入突变位点,用生物素、荧光物质、地高辛标记,加入其他短序列,包括起始密码子、终止密码子等。
(4)模板的制备:PCR的模板可以是DNA,也可以是RNA。模板的取材主要依据PCR的扩增对象,可以是病原体标本如病毒、细菌、真菌等。也可以是病理生理标本如细胞、血液、羊水细胞等。法医学标本有血斑、精斑、毛发等。
标本处理的基本要求是除去杂质,并部分纯化标本中的核酸。多数样品需要经过SDS和蛋白酶K处理。难以破碎的细菌,可用溶菌酶加EDTA处理。所得到的粗制DNA,经酚、氯仿抽提纯化,再用乙醇沉淀后用作PCR反应模板。
(5)PCR反应条件的控制。
①PCR反应的缓冲液提供合适的酸碱度与某些离子。
②镁离子浓度总量应比dNTPs的浓度高,常用1.5mmol/L 。
③底物浓度dNTP以等摩尔浓度配制,20μmol/L~200μmol/L。
④Taq DNA聚合酶2.5U(100μl)。
⑤引物浓度一般为0.1μmol/L~0.5μmol/L。
⑥反应温度和循环次数:PCR反应条件为温度、时间和循环次数。
变性温度和时间:95℃,30秒。
退火温度和时间:低于引物Tm值5℃左右,一般在45℃~55℃。
延伸温度和时间:72℃,1分钟/kb(10kb内)。
Tm值=4(G+C)+2(A+T)。
循环次数:一般为25~30次。循环数决定PCR扩增的产量。模板初始浓度低,可增加循环数以便达到有效的扩增量。但循环数并不是可以无限增加的。一般循环数为30个左右,循环数超过30个以后,DNA聚合酶活性逐渐达到饱和,产物的量不再随循环数的增加而增加,出现了所谓的“平台期” 。
2. PCR在检测疑似结核杆菌样品中的应用
用PCR方法测定培养分离物或可疑动物组织样品中的牛分枝杆菌DNA已较为普遍。很多商业化的试剂盒和各科研部门新研制的方法已用于结核杆菌病复合体的检测。各种各样的引物也已广泛应用,包括16sRNA、16s rDNA的扩增序列,IS6100和IS1081的插入序列,以及编码结核杆菌复合体特异性蛋白基因,比如MPB64和38Kda抗原。商品化试剂盒和各科研部门研制的方法检测结果差异较大,而且很难获得满意的结果。假阳性和假阴性结果,尤其是含有少量细菌的样品降低了试验结果的可靠性。由于去除污染的方法、DNA提取步骤、去除多聚酶抑制剂技术、内部和外部控制以及交叉污染的防止措施等差异常使得结果千差万别。PCR作为一种检测临床样品结核杆菌复合物的改善的方法需要标准化,并且要求更严格的步骤。该法已经用于福尔马林固定、石蜡包埋的组织以检测结核杆菌群和区分禽结核杆菌。
DNA分析技术与区分牛结核杆菌和其他结核杆菌复合体的生化方法相比更加快速、可靠。到目前为止,已经发现oxyR基因285核苷酸突变在所有结核杆菌复合体中对牛结核杆菌是特异性的,用于杂交、监测扩增片段的特异基因探针可以用生物素或地高锌标记而不用同位素是非常重要的。
四、DNA指纹图谱分析
基因指纹图谱分析可以区分不同株的牛结核杆菌,而且能够定型上述原发的、传染的和散播的牛结核杆菌。这种方法允许不同菌株插入属于结核杆菌复合体,包括牛结核杆菌的各个种中,并且能区分牛结核杆菌和其他结核杆菌。其他新的检测技术仍在研究中,目的是更加精确的区分具有同样spoligotype的菌株。这些方法包括用PGRS探针(多聚G重复序列)的限制性片段长度多态性分析(RFLP)、以VNTR剖面(多种纵列重复)为特征的扩增片段长度多态性分析(AFLP)。PCR-RFLP菌种鉴定法是以分枝杆菌属特异性引物对标本中分枝杆菌6Sku蛋白编码基因、16S或16~23SrDNA进行扩增,然后用不同的限制性内切酶消化扩增片段,通过电泳分析酶切图谱来鉴定菌种。目前只能鉴定部分菌种,重复性还不够理想。下面简单介绍一下。
1.图谱分析原理
从生物样品中提取DNA( DNA一般都有部分的降解),可运用PCR技术扩增出高可变位点或者完整的基因组DNA ,然后将扩增出的DNA酶切成DNA片断,经琼脂糖凝胶电泳,按分子量大小分离后,转移至尼龙滤膜上,然后将已标记的DNA探针与膜上具有互补碱基序列的DNA片段杂交,用放射自显影便可获得DNA图谱。
琼脂糖凝胶电泳是分离、鉴定和纯化DNA片段的常规方法。利用低浓度的荧光嵌入染料溴化乙锭进行染色,可确定DNA在凝胶中的位置。如有必要,还可以从凝胶中回收DNA条带,用于各种克隆操作。琼脂糖凝胶的分辨能力要比聚丙烯酰胺凝胶低,但其分离范围较广。用各种浓度的琼脂糖凝胶可以分离长度为200bp至近50kb的DNA 。长度100kb或更大的DNA ,可以通过电场方向呈周期性变化的脉冲电场凝胶电泳进行分离。
在基因工程的常规操作中,琼脂糖凝胶电泳应用最为广泛。它通常采用水平电泳装置,在强度和方向恒定的电场下进行电泳。 DNA分子在凝胶缓冲液(一般为碱性)中带负电荷,在电场中由负极向正极迁移。 DNA分子迁移的速率受分子大小、构象、电场强度和方向、碱基组成、温度和嵌入染料等因素的影响。
2.实验步骤
(1)DNA样品的制备:采集生物检测样本,在弱碱和螯合剂存在条件下进行组织匀浆,溶解细胞或细胞核膜;利用阴离子去垢剂和蛋白酶,在37℃孵化数小时,消化蛋白质分离DNA ;使用有机溶剂如苯酚、氯仿等除去残余蛋白质,萃取DNA ;用乙醇或某些盐类从溶液中沉淀DNA 。
由于一般采集的样本中的DNA都有不同程度的降解,采用PCR技术扩增出完整的基因组DNA或者特定的高可变位点,以此制备出的DNA样品备用。
(2)DNA样品的酶切反应:设置DNA样品的双酶切反应,按下列顺序加样(见表3-4)。
表3-4 双酶切反应加样表
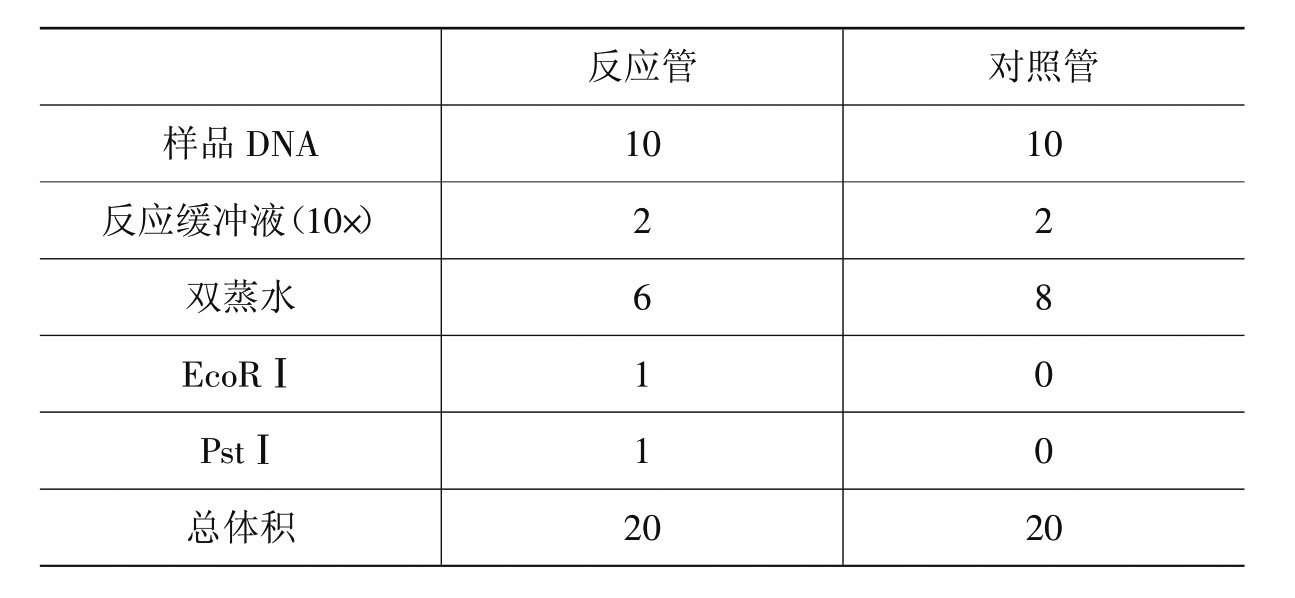
加完反应液,温和混匀,置于37℃水浴中反应1小时,取出备用。
(3)酶切产物的琼脂糖电泳:
①在100ml电泳缓冲液(1TAE或0.5TBE)中加入1g琼脂糖,加热熔化,注意观察,当心煮沸的液体溢出。当凝胶冷却至60℃左右时加入5μl溴化乙锭溶液(最终浓度为1μl/ml),充分混匀。
②先用透明胶带封固胶托边缘,放好梳子,然后再倒入凝胶(凝胶厚度在5mm左右)。
③在凝胶完全凝固后(室温放置30~45分钟),小心移去梳子和透明胶带,将凝胶放入电泳槽中,加入电泳缓冲液(液面超过胶带2~3mm)。
④取已制备好的酶切DNA样品,加入1/5样品缓冲液,充分混匀。用移液器将样品小心地加入点样孔。在不同的点样孔中,分别加入DNA分子量标记物,对照以及酶切DNA样品各5~10ml。
⑤盖上电泳槽,打开电源并调节电压(通常用50~100伏),电泳40~60分钟。(注意:DNA样品从负极向正极泳动)
(4)结果观察与分析:关闭电源,取出凝胶,在紫外灯下观察DNA的迁移位置,分析实验结果。
(5)注意事项:
①酶切时,应尽量减少反应中的加水量,以使反应体系减到最小。但要确保酶体积不超过反应总体积的1/10,否则限制酶活性将受到甘油的抑制。
②进行酶切消化时,将除酶以外的所有反应成分加入后再从冰箱中取出酶,并应放置于冰上。每次取酶时都应换一个无菌吸头。操作要尽可能快,用完后立即将酶放回冰箱。
③溴化乙锭是一种强烈的致癌物质,使用时必须戴手套。实验结束后,含溴化乙锭的凝胶要进行净化处理。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














