【实验原理】 聚丙烯酰胺凝胶电泳(polyacryamide gel electrophoresis,PAGE)是由丙烯酰胺单体和交联剂甲叉双丙烯酰胺在催化剂TEMED(N,N,N,N'一四甲基乙二胺)和过硫酸铵的作用下形成的三维网状结构物质。在抑制核酸中碱基配对的变性剂(如尿素、甲酰胺)存在的情况下发生聚合,变性DNA在凝胶中保持单链状态并以线性分子的形式泳动,迁移率与其分子大小的对数成反比,与碱基组成和序列几乎完全无关。聚丙烯酰胺凝胶电泳适宜分离鉴定低分子量蛋白质、<1kb的DNA片段(尤其对小DNA片段的分析5~500bp)和DNA序列分析,其装载的样品量大,回收DNA纯度高,长度仅相差0.2%(即500bp中的1bp)的核苷酸分子能分离。需根据待分离DNA片段的大小配制适当浓度的丙烯酰胺凝胶(表4-4)。
聚丙烯酰胺凝胶电泳有连续与不连续体系两种:前者指在整个电泳体系中的缓冲液pH 值和凝胶孔径大小相同,主要用于核酸分析;后者主要用于蛋白质样品的分离,它除了电泳槽中的缓冲体系和pH 值与凝胶中不同外,凝胶本身也由缓冲体系、pH 和凝胶孔径不同的两种凝胶堆积而成。不连续体系聚丙烯酰胺凝胶电泳在本书第13章第一节有详细介绍,这里主要介绍连续体系中的DNA聚丙烯酰胺凝胶电泳。
表4-4 不同浓度丙烯酰胺和DNA的有效分离范围
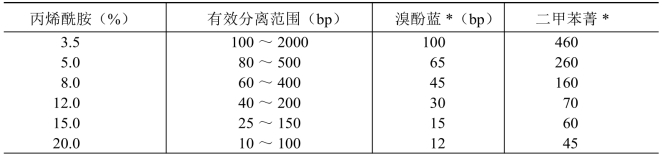
*表中给出的数字为与指示剂迁移率相等的双链DNA分子所含碱基对数目(bp)
【材料】
1.30%(W/V)的丙烯酰胺储存液(1L),配制如下:
(1)称量下列试剂,置于1L烧杯中。
丙烯酰胺 290g
双丙烯酰胺 10g
(2)向烧杯中加入约600ml去离子水,充分搅拌溶解。
(3)加去离子水将溶液定容至1L,用0.45μm滤膜过滤,于棕色瓶中4℃保存。
注意:丙烯酰胺具有很强的神经毒性,并可通过皮肤吸收,其作用具有积累性,配制时应戴一次性手套。聚丙烯酰胺无毒,但也应该谨慎操作,因为可能含有少量的未聚合成分。
2.10%(W/V)过硫酸铵(10ml),配制如下。
称取1g过硫酸铵,加入10ml去离子水搅拌溶解,4℃储存。
注意:10%过硫酸铵溶液在4℃保存时间为2周左右,过期会失去催化作用。
3.10×TBE电泳缓冲液:临用前稀释10倍。
(1)称量下列试剂,置于1L烧杯中。
Tris 108g
Na2EDTA·2H2O 7.44g
硼酸 55g
(2)向烧杯中加入约800ml的去离子水,充分搅拌溶解。
(3)加去离子水将溶液定容至1L,室温保存。
4.TEMED(四甲基乙烯基二胺)。
5.仪器设备,如玻璃板、间隔片、垂直电泳槽、烧杯、磁力搅拌棒、微波炉、天平、点样梳、紫外分析仪、微量移液器等。
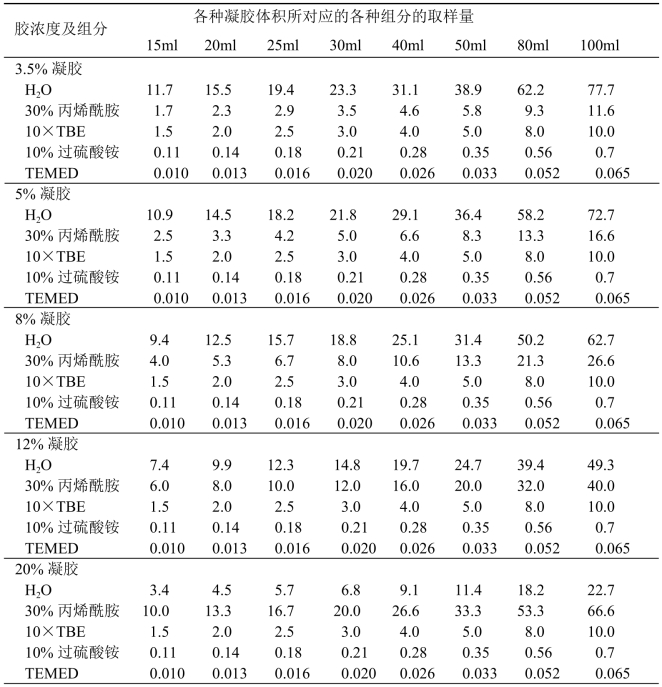
【操作步骤】
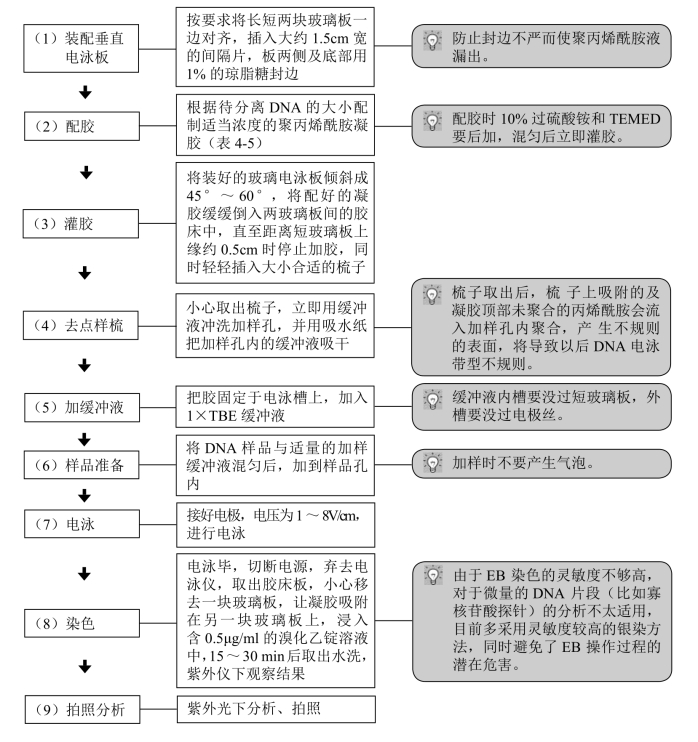
表4-5 各种浓度PAGE胶的配制(DNA电泳用)
【结果分析】
图4-3为DNA聚丙烯酰胺凝胶电泳图。
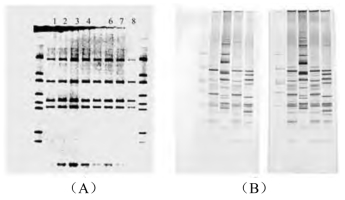
图4-3 DNA聚丙烯酰胺凝胶电泳图(见彩图)
A:EB染色法; B:银染法
【注意事项】
1.丙烯酰胺和双丙烯酰胺均为神经毒剂,可经皮肤吸收,其作用具有积累性。称取粉末丙烯酰胺和亚甲基双丙烯酰胺时,应戴手套和口罩,纯化应在通风橱中进行。
2.勿用手接触灌胶面的玻璃,以防凝胶板和玻璃板剥离,产生气泡和滑胶,或者剥胶时凝胶板断裂,所用器材均应严格清洗。
3.用琼脂糖封底及灌胶时不能有气泡,以免影响电泳时电流的通过,从而影响DNA条带的形状和迁移方向。
4.从凝胶中取出点样梳后要立即彻底地清洗加样孔,否则梳子所留存的少量丙烯酰胺溶液会在加样孔中聚合,产生不规则表面,引起DNA条带变形。
5.电泳槽中的缓冲液和配制凝胶时的缓冲液务必要同一批次,因为离子强度或pH的微小差别会形成缓冲液前沿,使DNA片段的迁移发生严重的扭曲。
6.凝胶完全凝固后,必须放置30min 左右,使其充分“老化”后,才能轻轻取出样品梳,切勿破坏加样孔底部的平整,以免电泳后区带扭曲。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














