SDS-PAGE是目前常用的蛋白质电泳分析方法。其基本原理是:丙烯酰胺(acrylamide)和N',N'-亚甲叉双丙烯酰胺(缩写Bis)在催化剂过硫酸铵作用下聚合形成凝胶。反应液中还加有N',N'-四甲基乙二胺(缩写TEMED)用来引发和控制聚合反应。SDS是一种阴离子去污剂,能使分子内和分子间的氢键断裂,破坏蛋白质分子的二级和三级结构;强还原剂,如β-巯基乙醇和二硫苏糖醇(dithiothreitol,DTT)则能使半胱氨酸残基之间的二硫键断裂。当样品和凝胶中加入SDS和还原剂后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小及丙烯酰胺交联体的孔径大小(有一定的线性分离范围,不同浓度的胶有不同的孔径),而蛋白质本身所带电荷可以被忽略,从而根据分子量将各蛋白质亚基分开。
实验流程如下:
![]()
一、样品的准备
【材料】
1.细菌 重组表达菌BL21。
2.试剂
(1)2×蛋白质样品缓冲液(10ml)
Tris 0.15g
β-巯基乙醇 1.0ml
溴酚蓝 0.01g
甘油 2.0ml
SDS 0.4g
蒸馏水 7.0ml
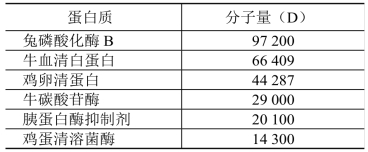
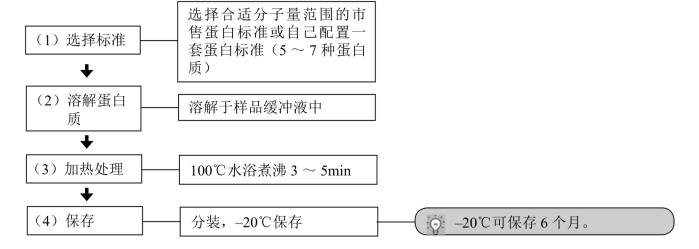
(2)分子量标准蛋白质:市售或自配(选择5~7种合适分子质量范围的蛋白质)常见低分子量标准蛋白质(市售)组成见表13-1。
表13-1 常见低分子量标准蛋白质(市售)组成
(3)1×TE缓冲液:量取1mol/L Tris-HCl 缓冲液(pH 8.0)5ml、0.5 mol/L EDTA(pH 8.0)1ml于500ml烧杯中;向烧杯中加入约400ml蒸馏水均匀混合;将溶液定容到500ml后,高温高压灭菌;室温保存。
(4)LB培养液:参见第3章。
【操作步骤】
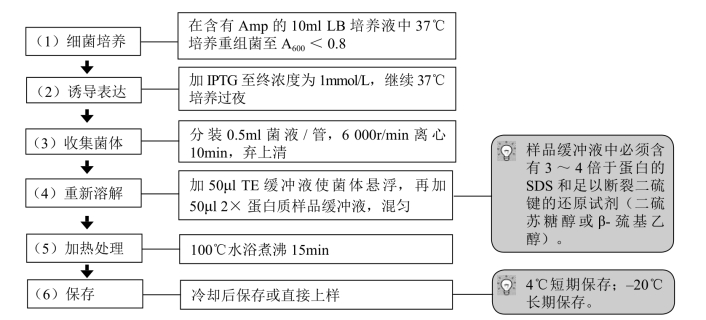
1.电泳样品的准备
2.蛋白标准的准备
【注意事项】
1.上样前样品准备 样品或蛋白标准冻存后取出使用前还需再次在100℃水浴煮沸3~5min,并补加适量β-巯基乙醇(因巯基乙醇具有强挥发性)。若样品溶解不佳,上样前最好先将样品离心,取上清加样,以免电泳时产生拖尾。样品缓冲液中煮沸的样品可在–20℃存放数月,但是反复冻融会使蛋白质降解。
2.样品浓度 样品的浓度取决于样品的组成,分析目的和检测方法。对未知样品可作0.1~20mg/ml蛋白的稀释系列,以寻找最佳加样浓度。如用考马斯亮蓝染色,可用浓度为1~2mg/ml的样品;对高纯度样品,0.5~2mg/ml蛋白为最佳;银染色所用的样品浓度可比考马斯亮蓝染色低20~100倍。电泳后进行转移,应有足够的样品量。
二、制胶
【材料】
1.试剂
(1)30%丙烯酰胺:称29g丙烯酰胺,1g甲叉丙烯酰胺,溶于蒸馏水并定容至100ml,滤纸过滤后置棕色玻璃瓶内室温保存。
(2)10%过硫酸铵:1g过硫酸铵溶于蒸馏水,定容至10ml。
(3)TEMED:N,N,N',N'-四甲基乙二胺,棕色瓶保存。
(4)上胶缓冲液:1.0 mol/L Tris-HCl (pH 6.8),Tris 12.1g,SDS 0.4g溶于60ml蒸馏水,用盐酸调pH 6.8,定容至100ml。
(5)下胶缓冲液:1.5 mol/L Tris-HCl (pH 8.8),Tris 18.2g,SDS 0.4g溶于60ml蒸馏水,用盐酸调pH 8.8,定容至100ml。
(6)1×甘氨酸电泳缓冲液:25mmol/L Tris(3.02g),250mmol/L甘氨酸(18.8g),0.1%SDS(1g),加蒸馏水至1 000ml。
2.设备 垂直电泳槽、制胶架、pH计。
【操作步骤】
1.安装电泳槽凝胶装置

2.凝胶的制备
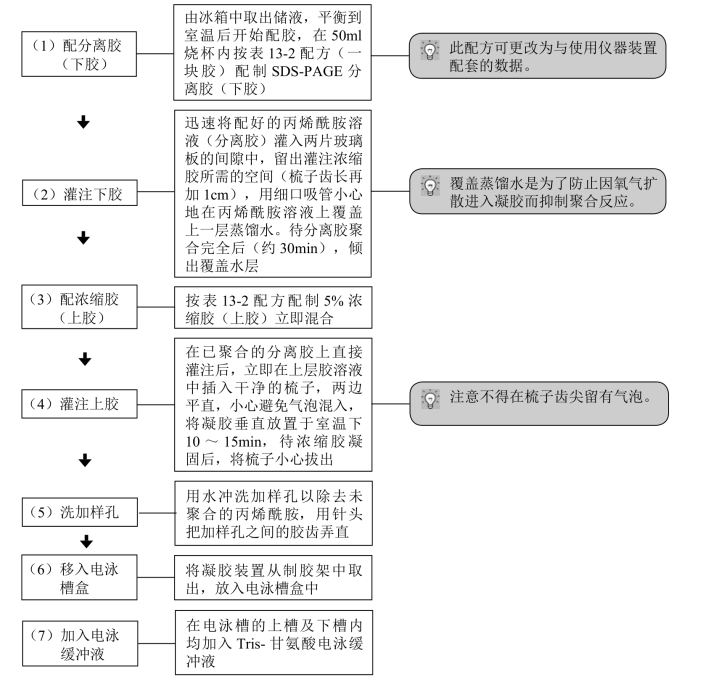
表13-2 SDS-PAGE配方(配制一块胶)

三、电泳
【材料】
1.试剂 1×甘氨酸电泳缓冲液:25mmol/L Tris(3.02g),250mmol/L 甘氨酸(18.8g),0.1%SDS(1g),加蒸馏水至1 000ml。
2.设备 垂直电泳槽。
【操作步骤】
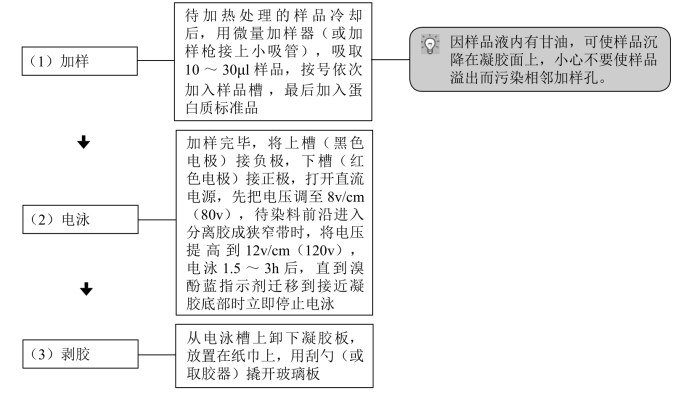
四、染色与脱色
【材料】
1.试剂
(1)染色液:0.1g考马斯亮蓝R250溶于30ml甲醇中,随后再加入10ml冰乙酸,加水至100ml。
(2)脱色液:与染色液成分相似,无考马斯亮蓝R250。
2.设备 脱色摇床
【操作步骤】

五、结果分析
(一)结果计算与分析
1.蛋白质分子量计算 根据经验得知,当蛋白质分子量在11.7~165kD时,蛋白质-SDS复合物的电泳迁移率与蛋白质分子量的对数成线性关系,符合直线方程式;lgMW=-bX+K(MW为蛋白质的分子量,X为蛋白质-SDS复合物电泳的相对迁移率,K和b均为常数),将已知分子量的标准蛋白质在SDS-PAGE中电泳迁移率对分子量的对数作图,即可得到一条标准曲线。只要测得未知分子量的蛋白质在相同条件下的电泳迁移率,就能根据标准曲线求得其分子量。
电泳迁移率的计算:按下列公式计算蛋白质样品的相对迁移率(MR)。
相对迁移率(MR)=(蛋白质样品移动距离/脱色后胶长)×(染色前胶长/指示剂移动距离)
根据蛋白质迁移率按上述直线方程式即可计算蛋白质分子量或通过标准曲线作图得出蛋白质分子量。
2. 电泳图 见图13-1,图13-2。
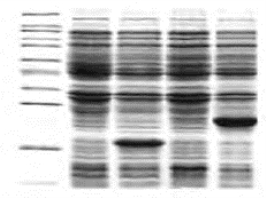
图13-1 SDS-PAGE正常电泳图
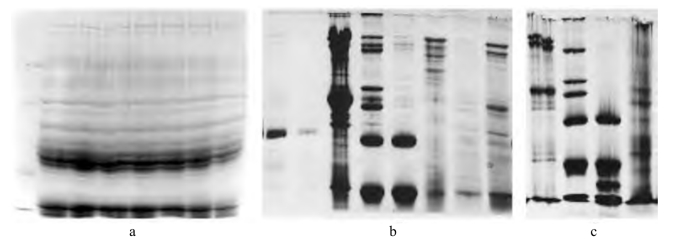
图13-2 SDS-PAGE 失败图示
a. 微笑带形;b. 皱眉带形;c. 拖尾带形
(二)常见问题及解决方案
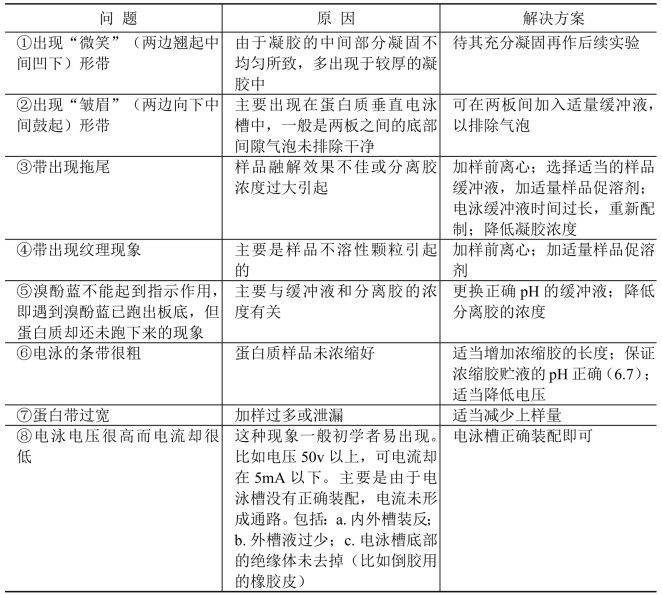
1. SDS-PAGE电泳常见问题及解决方案 见表13-3。
表13-3 SDS-PAGE电泳常见问题及解决方案
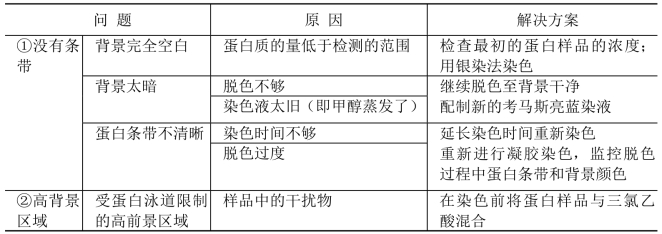
2. 考马斯亮蓝染色常见问题及解决方案 见表13-4
表13-4 考马斯亮蓝染色常见问题及解决方案
(续表)

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














