玉米醇溶蛋白提取及其对酒精发酵的影响
张英华 赵华
(天津市工业微生物重点实验室天津科技大学生物工程学院 天津 300222)
摘要:玉米用磷酸盐缓冲液浸泡后,进行脱胚芽处理,胚乳用于提取醇溶蛋白。利用响应面分析法确定提取玉米醇溶蛋白的最佳工艺条件为:添加液料比为8:1的75%乙醇溶液,在60℃浸提2h后,离心分离,醇溶蛋白提取率为90.25%。将提取醇溶蛋白后的玉米胚乳残渣进行酒精发酵,淀粉出酒率为53.40%,略高于对照试验的53.04%。
关键字:玉米;醇溶蛋白;提取;酒精发酵
玉米籽粒中一般含10%左右的蛋白质,玉米醇溶蛋白(zein)是玉米中主要的贮藏蛋白,约占玉米总蛋白含量的45%~50%[1]。玉米醇溶蛋白易溶于60%~95% (v/v)乙醇[2]水溶液,不溶于水且缺少赖氨酸、色氨酸等人体必需氨基酸,并存在色泽和气味问题,因而其生物学价值低,严重影响了其在食品工业中的应用,大部分用于饲料工业,不能充分利用。但由于玉米醇溶蛋白具有独特的分子形状和结构,以其良好的吸湿性、耐热性、耐脂性和成膜性[3],被广泛用于食品、造纸、印刷、纺织以及医药卫生[4]等方面,尤其是作为果蔬食品的保鲜膜、可食性包装、生物可降解塑料和黏合剂[5],具有广阔的市场前景。
玉米醇溶蛋白的提取一般用醇作溶剂来提取,可以从玉米黄粉[6]、DDGS[7]、CGM[8]、DDG[9]中提取出来。除了用有机溶剂萃取外,可以用超声波萃取[10]或酶解方法来提取玉米醇溶蛋白。本研究采用磷酸盐缓冲液浸泡玉米后,进行胚芽和胚乳分离,胚芽提取SOD和玉米油,胚乳提取玉米醇溶蛋白,再将提取后的残渣用于酒精发酵。采用此工艺提取醇溶蛋白并于酒精发酵相结合,不仅提高其提取率,有效提高玉米综合利用率,并为降低玉米燃料酒精生产成本提供了一条有效途径。
1 材料与方法
1.1 材料
玉米:购于天津市场。
pH 7.8磷酸缓冲溶液:磷酸二氢钠,磷酸氢二钠分别配成0.05mol/L使用时按1:10.8比例混合均匀。
1.2 玉米醇溶蛋白提取方法
用pH 7.8的磷酸缓冲液在40℃浸泡玉米籽粒36h,淋干后分离胚芽与胚乳。用粉碎机将胚乳粉碎,称取50g胚乳粉,加入乙醇,水浴摇床中待醇溶蛋白充分溶解后,离心取上清液,即得玉米醇溶蛋白提取液。
1.3 玉米酒精发酵试验
准确称取50.00g玉米粉,置于500ml三角瓶中,按照1∶4加入70℃自来水200ml,然后加入0.1ml液化酶,沸水浴30min,0.1MPa下蒸煮1h后冷却到60℃~62℃,按150μ/g原料加入糖化酶,60℃水浴糖化1h。糖化醪冷却到30℃,加入5ml干酵母活化液和2ml活化蛋白酶上清液,加发酵栓,置30℃培养箱中培养12h后再转至35℃培养箱中发酵72h。
1.4 分析方法
1.4.1 玉米醇溶蛋白总量的测定
凯氏定氮法[11]。玉米中醇溶蛋白含量占总蛋白的40%[12]。
1.4.2 提取率的测定
![]()
1.4.3 玉米淀粉含量测定
1.4.4 原料出酒率的测定
![]()
式中: D—试样在20℃时的酒精度,% (V) ;
0.81144—95% (V)酒精(20℃)的比重;
W—原料重量,g;
P—淀粉含量,%。
2 结果与讨论
2.1 玉米醇溶蛋白提取条件的优化
影响玉米醇溶蛋白提取的主要因素有乙醇浓度、提取温度、液固比、提取时间[14]。根据Box-Behnken中心组合设计原理,以4个主要因素为自变量,以醇溶蛋白提取率值为响应值,设计4因素3水平27个实验点的响应面分析实验。实验设计及结果见表1。
表1 Box-Behnke响应面实验设计及结果

运用SAS RSREG程序对27个实验点的响应值(醇溶蛋白提取率)进行回归分析,得到回归方程为:
Y=-1443.69+29.68483*X1+8.457333*X2+48.95542*X3+12.50167*X4
-0.198204*X12-0.071158*X22-2.534896*X32-2.822083X42+0.0012*X1X2
-0.123583*X1X3-0.0175*X1X4-0.01675X2X3-0.003X2X4+0.245X3X4。
其F-检验结果见表2。
表2 各因素的F-检验

从方差分析表可以看出,用上述回归方程描述各因子与响应值之间的关系时,起因变量与全体自变量之间的线性关系是非常显著的[F>F0.01(14,10) ],决定系数R2=0.9712,说明回归方程的拟合程度较好。而各项因素的方差分析见表3。
表3 回归方程各项因素的方差分析表

由表3可知,方程一次项,二次项的影响都是高度显著的,失拟项F值较小,说明模型规定适当,可以用该回归方程代替实验真实点对实验结果进行分析。
2.2 响应因子水平的优化
RSA的图形可以直观地反映各因素对响应值的影响,从实验所得的响应面分析图上可以找到它们在反应过程中的相互作用。结果见图1。


图1 响应面曲面图
由图1可知,乙醇浓度在75%及提取温度为60℃时回收率达到最大,在提取2h时最大,再延长提取时间,回收率反而减少。而随着液料比的增加,提取得到的醇溶蛋白的含量也不断增加,回收率逐渐上升,但液料比过大,生产成本会随之增加,故液料比不宜过大。根据SAS的预测,结果见表4。
表4 醇溶蛋白提取预测

为检验RSA分析法的可靠性,并考虑到实际工艺控制的方便,将最佳提取条件修正为:添加液料比为8∶1的体积分数为75%的酒精溶液,在60℃浸提2h后,离心分离,得到醇溶蛋白溶液。在此条件下,测得的提取率为90.25%,与理论预测值(90.33%)相比相对误差低于1%。因此采用RSA分析法优化得到的浸提条件参数准确可靠,具有实用价值。
2.3 玉米醇溶蛋白提取对酒精发酵的影响
玉米酒精发酵主要利用的是玉米中的淀粉。将用磷酸盐溶液浸泡提取醇溶蛋白的玉米胚乳渣和未提取醇溶蛋白的玉米胚乳分别进行酒精发酵,并以未浸泡的玉米胚乳作为对照,考察用磷酸盐浸泡和提取醇溶蛋白对酒精发酵的影响,结果见表5。
表5 提取玉米醇溶蛋白对酒精发酵的影响
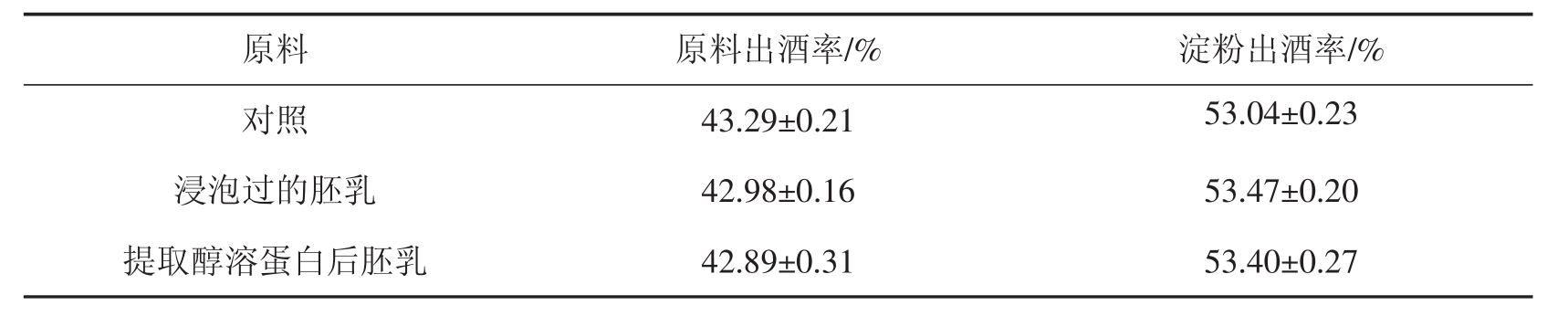
由表5可知,用磷酸盐浸泡过及提取醇溶蛋白后的玉米残渣进行酒精发酵,其原料出酒率都低于未浸泡的对照样,主要由于浸泡和提取过程会造成少量淀粉的损失。但是两者的淀粉出酒率却都高于对照样,且提取醇溶蛋白后的淀粉出酒率与浸泡过的相差不大。由此可见,在浸泡和提取阶段,玉米胚乳中的淀粉被软化,且提取醇溶蛋白后减少了蛋白质对淀粉水解的干扰,从而有利于淀粉的充分利用。因此,提取玉米醇溶蛋白可以促进酒精发酵的进行,采用此工艺提取醇溶蛋白是可行的。
3 结论
3.1 利用响应面分析法确定,从浸泡过的玉米胚乳中提取玉米醇溶蛋白的最佳工艺条件为:添加液料比为8∶1的75% (v)乙醇溶液,在60℃浸提2h后,离心分离,得到醇溶蛋白提取液,提取率为90.25%。
3.2 将提取醇溶蛋白后的玉米残渣进行酒精发酵,其淀粉出酒率达到53.40%,略高于对照试验的53.04%,证明此工艺是可行的。
参考文献:
[1] Landry.Protein distribution in gluten products isolated during and after wet-milling of maize grains[J].Cereal Chem,1997,74: 188~189
[2]VijaySingh,David B Johnston,Robert A Moreau,etc.Pretreatment ofwet-milled corn fiber toimprove recovery ofcorn fiber oil and phytosterols [J].Cereal Chem,2003,80 (9):118~122
[3]Rishi Shukla,Munir Cheryan.Zein: the industrial protein from corn[J].Industrial Crops and Products,2001,13:171~192
[4]L.C.Dickey,M.F.Dallmer,E.R.Radewonuk,etc.Zeinbatchextractionfromdry-milledcorn: cereal
disintegration bydissolvingfluid shear[J],Cereal Chem.1998,75 (4):443~448
[5]Leland C.Dickey.Corn coproduct cuts ethanol production costs [J].Agricultural Research,2002,4: 20~1
[6] L.C.Dickey,A.McAloon,J.C.Craig,etcs.Estimating the cost of extracting cereal protein with ethanol [J]. Industrial Crops and Products,1999,10: 137~143
[7]Swallen,L.C.,1938.Process for the Production ofZein[P].U.S.Patent No.2.120,946
[8] Y.Victor Wu,Neutral Sugar Contents of Corn Gluten Meal and Corn Gluten Feed [J].Agric Food Chem,1996,44 (1):136
[9]H.Takahashi,Y.Norimasa.Process for refiningzein[P].USPatent 5342923.1994
[10]黄国平,温其标,杨晓泉,等.超声波法提取玉米醇溶蛋白的研究[J].食品与发酵工业,2003,28 (10):1~5[11] Rishi Shukla,Munir Cheryan,Richard E.DeVor.Solvent extraction of zein from dry-milled corn[J].Cereal Chem,2000,77: 724~730
[12]Takahashi,H.,Yanai,N.,1996.Process for ProducingZein[P].U.S.Patent No.5,510,463
[13]Mason,I.D.,Palmer,L.S.,1934.Preparation ofwhite zein fromyellowcorn[J].Biol.Chem.107,131~132
[14]Morris,L.,Wilson,A.L.,1959.Process for RecoveringWhole Zein[P].U.S.Patent No2,882,265
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















