实验十九 蛋白质印迹实验
一、实验目的
掌握蛋白质印迹NC膜及检测的原理,掌握通过此方法检测特异蛋白质的方法。
二、实验原理
Western Blot (蛋白质印迹法)又称为免疫印迹法,是一种可以检测固定在固相载体上蛋白质的免疫化学技术方法。待测蛋白既可以是粗提物,也可以是经过一定的分离和纯化的提取物。另外这项技术的应用需要利用待测蛋白的单克隆抗体或多克隆抗体进行识别。
如图19-1所示,可溶性抗原,也就是待测蛋白首先要根据其性质,如分子量,分子大小,电荷以及其等电点等采用不同的电泳方法进行分离;通过电流将凝胶中的蛋白质转移到聚偏二氟乙烯膜上;利用抗体(一抗)与抗原发生特异性结合的原理,以抗体作为探针钓取目的蛋白。值得注意的是在加入一抗前应首先加入非特异性蛋白,如牛血清白蛋白对膜进行“封阻”而防止抗体与膜的非特异性结合。
经电泳分离后的蛋白质往往需再利用电泳方法将其转移到固相载体上,这个过程称为电泳印迹。常用的两种电转移方法分别为:
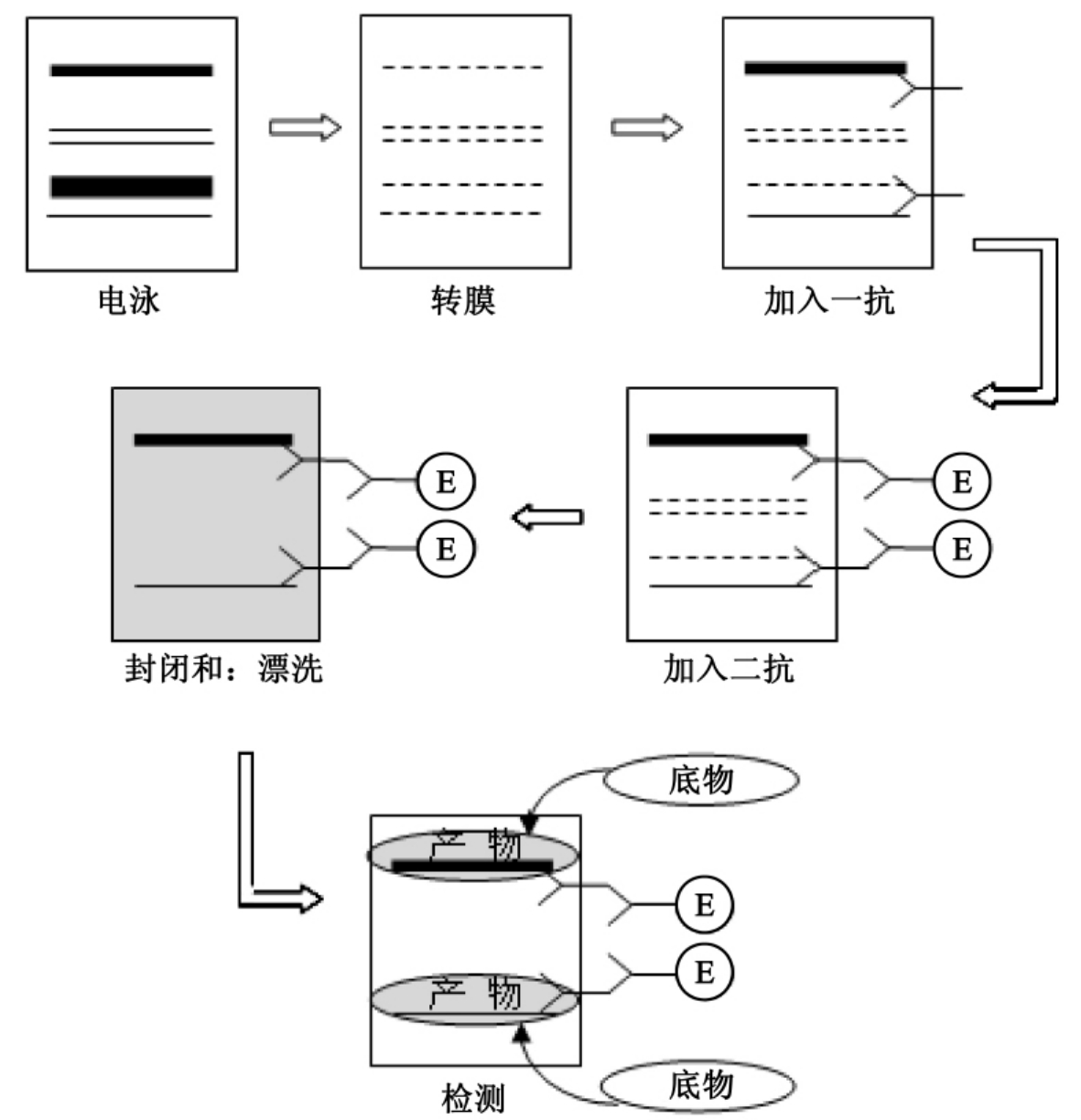
图19-1 Western Blot示意图间,通电时间为10~30min。
②湿法:凝胶和固相载体夹心浸放在转移缓冲溶液中,转移时间可从45min延长到过夜进行。
由于湿法的使用弹性更大,并且不浪费时间和原料,因此本实验中采用湿法。
对于目的蛋白的识别需要采用能够识别一抗的第二抗体。该抗体往往标记了特定的试剂,如辣根过氧化物酶。这种标记是利用辣根过氧化物酶所催化的一个比色反应,该反应的产物有特定的颜色且固定在固相载体上,容易鉴别。因此可通过对二抗的识别而识别一抗,进而判断出目标蛋白所在的位置。其他的识别系统包括碱性磷酸酶系统和125I标记系统。
用Western Blot法可检测特异蛋白的存在。
三、实验材料和器械
1.试剂
(1)PBS溶液:0.01mol/L磷酸缓冲液,pH7.2,内含0.15mol/L NaCl。
(2)吐温-PBS液,500ml 0.01mol/L PBS溶液中加入1.5ml吐温20。
(3)Tris盐缓冲液(TBS):6.05g Tris碱(50mmol/L),8.76g氯化钠(150nmol/L)用HCL调节pH值至7.5,蒸馏水定容至1000ml。
(4)T-TBS:将1ml Tween-20稀释到1000ml TBS。
(5)反应液(辣根过氧化物酶标记羊抗兔IgG):300μl +10ml吐温-PBS液。
(6)联苯回香胺溶液:50μg联苯茴香胺溶于10ml甲醇中。
(7)底物溶液:1ml联苯茴香胺溶液+ 50ml1 3% H2O2+9ml吐温-PBS液(现用现配)。
(8)兔血清。
2.材料与器材
硝酸纤维素膜,50ml烧杯,烘箱,微量加样品,滤纸,摇床。
四、操作方法
(1)蛋白样品的制备:见实验十三。
(2)电泳:见实验十三。
(3)转膜。
①准备PVDF膜:根据胶的大小剪出一片PVDF膜,膜的大小应略小于胶的大小。将膜置于甲醇中浸泡1min,再移至转移缓冲溶液中待用。
②制作胶膜夹心:见图19-2所示。
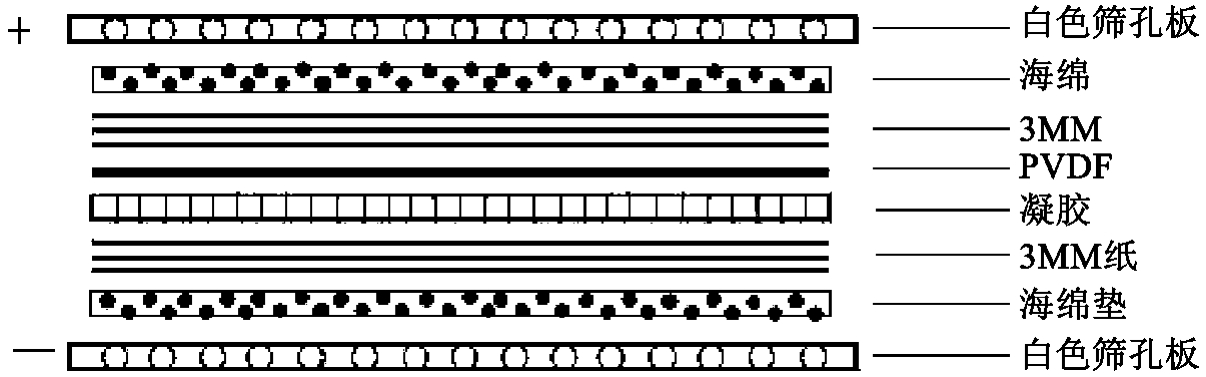
图19-2 转膜时夹心放置顺序
在一浅盘中打开转移盒,将一个预先用转移缓冲溶液浸泡过的海绵垫放在转移盒的黑色筛孔板上,在海绵垫的上方放置经转移缓冲溶液浸湿的3MM纸,小心地将胶板放在3MM纸上,并注意排除气泡。将PVDF膜放在胶的上方,同时注意排除气泡,再在膜的上方放一张同样用转移缓冲溶液浸湿过的3MM纸并赶出气泡,放置另一张浸泡过的海绵垫,关闭转移盒。将转移盒按照正确的方向放入转移槽中,转移盒的黑色筛孔板贴近转移槽的黑色端,转移盒的白色筛孔板贴近转移槽的白色端,填满转移缓冲溶液的同时防止出现气泡。
③电转移:连接电源,凝胶一边接负极,PVDF膜一边接正极,在4°C条件下维持恒压100V,1h。
(4)免疫检测。
①膜染色:断开电源,将转移盒从转移槽中移出,将转移盒的各个部分分开。用镊子将PVDF膜小心放入一个干净的容器中,用TBS缓冲溶液(也可用PBS缓冲液)进行短暂清洗,从膜上剪下一条宽约5mm的膜放入另一个干净的容器中。将这条膜在染色液中浸泡1min,然后在脱色液中脱色30min,确定蛋白质已经转移到PVDF膜上。
②膜的封闭和清洗:对于没有进行染色的膜,首先倒出TBS缓冲溶液,加入3%封闭缓冲溶液,轻轻摇动至少1h。倒掉3%封闭缓冲溶液,并用TBS缓冲溶液清洗3次,每次5min。
③一抗:倒掉TTBS缓冲溶液,加入10ml0.5%封闭缓冲溶液及适量的一抗,轻轻摇动1h以上。从容器中倒出一抗及封闭缓冲溶液,用TBS缓冲溶液清洗两次,每次10min。
④二抗:倒出TTBS缓冲溶液,加入5ml0.5%封闭缓冲溶液及适量的二抗。轻轻摇动30min,倒出二抗及封闭缓冲溶液,用TTBS缓冲溶液清洗两次,每次10min。
⑤检测:倒掉TTBS缓冲溶液,并加入显影剂,轻轻摇动PVDF膜,观察显影情况,当能够清晰地看到显色带时,用蒸馏水在30min内分三次清洗PVDF膜以终止显色反应的继续进行。
⑥实验结果观察:检查膜上的显色结果,有颜色的带(褐色或者蓝紫色带,根据标记的酶和底物颜色不一致)所对应的即是目标蛋白质的位置。
五、技术要点
1.电转移注意事项
(1)操作过程要防止人身上蛋白质的污染(如手上蛋白质),切滤纸和膜时一定要戴手套,因为手上的蛋白会污染膜。
(2)膜预处理时,膜上不能出现任何白点或者斑点,如出现表明是没有完全浸润,会影响转膜。
(3)电转“三明治”的操作应在转移液中进行,不能出现气泡。膜两边的滤纸不能相互接触,接触后会发生短路(转移液含甲醇,操作时要戴手套)。
(4)在胶上以及膜上切个小角以确定电泳的方向。
(5)转膜时的温度最好保持在10℃以下,有条件的可在冷库中进行;没有冷库的可在冰箱中进行,或者冰浴。
2.Western Blot时注意事项
(1)一抗、二抗的稀释度、作用时间和温度对不同的蛋白要经过预实验确定最佳条件。
(2)有条件的用BSA做封闭剂,但好的脱脂奶粉封闭的效果也不错。可以使用的有雀巢高钙奶粉、多力精低脂奶粉等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















