细菌杂交重组实验的成功,促使J.莱德伯格等去寻找更多的标志基因来做实验,并试图画出细菌的基因连锁图。然而这种努力的结果却让J.莱德伯格和塔特姆得到一堆无法解释的数据,因为每次测得的标志基因之间的重组率都不一样,有的数据差异大到令人难以置信的程度。直到1953年,哈耶斯(W.Hayes)的一次出乎意料的实验才使人们重新认识了细菌接合杂交的机制。
最初,J.莱德伯格和塔特姆在总结大肠杆菌K12的几株营养缺陷型之间杂交重组实验时,曾经假定接合杂交是两个亲本细胞的融合,双方遗传物质配对和交换,进行了类似减数分裂那样的过程之后才产生重组子。也就是说他们认为接合的双方在遗传上是对等的,就像动植物中雌雄配子对杂交后代所贡献的遗传物质是相等的,而哈耶斯的实验对这种看法提出了挑战。
为了验证J.莱德伯格和塔特姆的实验,哈耶斯做了一个杂交实验:
![]()
其中,Met、Thr、Leu和Thi分别代表甲硫氨酸、苏氨酸、亮氨酸和维生素B。经过混合培养一段时间后可以获得表型为野生型的重组体Met+Tht+Leu+Thi+,这与J.莱德伯格和塔特姆的结果一样。可是当哈耶斯用链霉素(S)分别处理品系A和B时,却出现了意料之外的结果。用经链霉素处理的A菌株和未经处理的B菌株杂交时,得到的重组体数和不用链霉素处理时基本相同;而用经链霉素处理的B菌株和未经处理的A菌株杂交时,竟然没有重组体产生。为了解释这意外的实验结果,哈耶斯分别选育了A菌株的链霉素抗性突变株A(Sr)和B菌株的抗性突变株B(Sr),再用链霉素处理来证实上述正反交的结果是真实的。哈耶斯实验的示意图如图2-5。
哈耶斯发现B(Sr)在链霉素处理后仍然存活是重组发生的先决条件,他的结论是在细菌杂交中,菌株A和菌株B的作用是不等同的,B的存活增殖是重组子产生的必要条件。他进一步假定,菌株A是遗传物质的供体细胞,B是接受A的遗传物质的受体细胞,遗传物质的重组是在受体细胞中发生的,所以受体细胞的存活和增殖为来自供体DNA的复制,及其与受体的DNA发生重组,从而为形成重组子提供了必不可少的先决条件。供体细胞和受体细胞的关系类似于高等植物中的雄体和雌体。
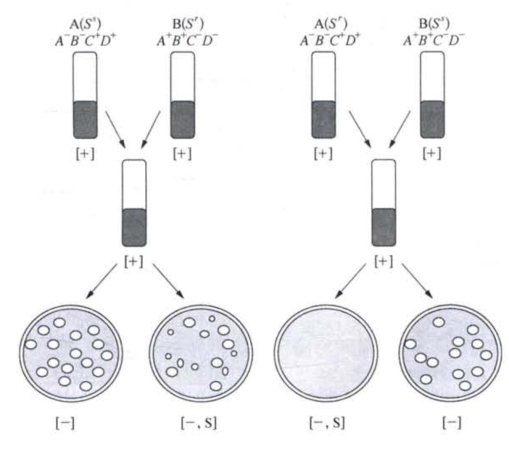
图2-5 证明细菌接合杂交中存在供体菌和受体菌的哈耶斯实验(引自D.T.Suzuki)
在深入研究杂交中供体和受体的关系中,哈耶斯分离到了A菌株的一种突变型,定名为A*。A*自发地失去了与受体菌B杂交而产生重组体的能力。把大量的A*突变菌接种在含链霉素的培养基上,可筛选得到A*(Sr)菌株。A*(Sr)菌株和原始菌株A*(Ss)一样都不能和B杂交。但是,如把A*(Sr)和A(Ss)(有与B杂交能力,但对链霉素敏感的A菌株)混合培养后立刻倒入含链霉素的平皿,则会使大约30%的A*(Sr)变为能和B杂交的A(Sr)菌,而在这过程中并没有发生任何标志基因的重组。不久,莱德伯格夫妇和卡瓦利-斯弗扎(L.Cavalli-Sforza)也发现了类似的情况,他们推测细菌的能育性(fertility)是供体细胞特有的遗传特征,它是由能育因子(fertility factor)F决定的。受体细胞中并没有F因子。杂交实验表明,具有能育因子F的供体菌(F+)和没有F因子的受体菌(Fˉ)接合而发生遗传重组的概率很低(约为10-7),而能育因子从A(Ss)向A*(Sr)转移的频率高达30%左右,况且F因子的转移并不伴以标志基因的重组。所以,可以假定F因子和细菌中的其他基因并不在同一个DNA分子上,而是一个独立的DNA分子。直到1961年,法库(S.Falkow)和巴龙(L.Baron)直接分离到了F因子,并用梅塞尔森和斯塔尔的密度梯度法测出了它是一个密度为1.709的DNA双链分子,关于F因子的推测才得以证实。现已测得F因子为长为94 500 bp(碱基对)的DNA分子,其所含DNA相当于细菌基因组DNA的3%。
不久,卡瓦利-斯弗扎和哈耶斯都在F+菌株中分离到了高频重组(high frequency recombination,Hfr)品系,称为Hfr菌。Hfr菌和Fˉ菌杂交重组频率要比F+和Fˉ之间的杂交重组频率高1 000倍。他们设想Hfr菌和F+菌都有F因子,只是F因子存在的状态不一样,但对这种F因子存在状态改变的本质还是不清楚的。哈耶斯、沃尔曼(E.Wollman)、雅各布一起深入研究了Hfr菌的行为。

图2-6 Hfr菌株[Hfr(H)A+B+Ss]与Fˉ菌株[AˉBˉSr(Fˉ)]杂交实验的基因转移动力学研究(引自G.S.Stent)
他们发现,当F+和Fˉ杂交时,重组子的多数标志基因是原先Fˉ细胞的基因,但重组子的交配型却是F+的。相反,当Hfr与Fˉ杂交时,重组子中基因重组频率虽然大大提高了,但并没有改变其交配型,即重组子的交配型仍为受体细胞的Fˉ型。
接着他们又进行了接合重组的动力学研究。沃尔曼和雅各布将Hfr菌株[Hfr(H)A+B+Ss]与Fˉ菌株[AˉBˉSr(Fˉ)]以1∶10的比例混合培养,然后在不同的时间取样测定重组体A+Sr和B+Sr的频率(图2-6)。结果表明,在混合培养后60 min,Hfr菌把A+标记转入Fˉ受体细胞的概率是18%;Hfr菌把B+标记转入Fˉ受体细胞的概率不到5%。在0~60 min内,重组菌A+Sr和B+Sr的数量呈线性增长趋势,即重组发生概率是混合培养时间的函数。
另外,他们又做了杂交中断实验。在取样混合后的不同时间点,先用搅拌器搅拌2 min,借以中断细菌与细菌之间的接合,再在选择性培养基上测出重组体的发生频率,结果发现了一个非常重要的现象。在交接开始的8 min内,搅拌过的样本中根本不出现A+Sr重组子;交接后8 min出现了第一个A+Sr,重组子数目呈线性增加,60 min时接近混合培养后不搅拌的实验组的重组子数目。B+Sr重组子的出现比A+Sr重组子晚17 min,直到交接后25 min才出现第一个B+Sr,以后呈线性增加,60 min时也接近不搅拌组的水平(图2-6)。
沃尔曼和雅各布对于这组实验的解释是这样的:在不搅拌组,只要Hfr和Fˉ之间的菌体接合开始,就能继续下去并产生重组体,图2-6中的两条细线表示接合的速度。在搅拌组,搅拌会中断正在进行的接合,使供体菌和受体菌分开,因此只有在搅拌之前已经进入受体细胞的标志基因,才能在受体细胞中进行重组。他们还发现所有的B+Sr重组体都是A+,也就是说A+Sr实际上是A+A+Sr,而A+Sr则并非都是B+。这表明Hfr菌的标志基因的转移是定向有序的。
1956年,沃尔曼、雅各布和哈耶斯共同发表了用多个选择性和非选择性标志基因做的杂交实验动力学研究。他们选用Hfr菌株[Hfr Thr+Leu+Azir Tlr Lac+Gal+Ss]和Fˉ菌株[Thrˉ LeuˉAzis Tls Lacˉgalˉ Sr]做杂交实验(图2-7),并从一系列实验结果得出三个结论。
(1)供体的标志基因在重组子中的出现有一定的次序,如该实验中的标志基因出现的次序为Azir、Tlr、Lac+、Gal+。
(2)供体Hfr细胞中每个标志基因在受体Fˉ细胞中出现的时间是确定的。如Azir在接合后8 min开始出现;Tlr、Lac+、gal+分别在接合后10 min、17 min、25 min开始出现。

图2-7 Hf r菌株[Hfr Thr+ Leu+ Azir T1r Lac+gal+Ss]和Fˉ菌株[ThrˉLeuˉAzisT1sLacˉGal-Sr]杂交实验示意(引自E.L.Wollman、F.Jacob和W.Hayes)
Azir:叠氮化钠抗性基因;T1r:噬菌体T1抗性基因;Sr:链霉素抗性基因;Gal:半乳糖酵解基因;Lac:乳糖发酵基因;Thr:苏氨酸基因;Leu:亮氨酸基因
(3)进入受体细胞越早的标志基因,在重组子中能达到的最大比值也越高;反之,进入越迟的,能达到的转移比值上限也越低。如最先进入受体细胞的Azir极值为90%,而最迟进入的Gal+则不及25%。
在综合分析了多次杂交动力学实验结果的基础上,沃尔曼等推测:H fr菌的染色体是以线性方式转移进入Fˉ细胞的,它以某一特定位点为转移起点(设其为0点),以一定的次序将染色体上的基因转入Fˉ细胞,这种转移往往是不完全的,离0点比较远的基因在进入Fˉ细胞之前,转移过程往往会被某些因素阻断,使这些基因最终的重组子能达到比例要比那些较为接近0点的基因低。他们还进一步假设,如果在没有其他因素干扰的理想状态下,H fr细菌染色体的转移是匀速的。那么,利用中断接合实验中各个标志基因最初出现在受体细菌的时间点可绘制出细菌的基因连锁图。图2-8就是一张以时间这个物理量为单位的细菌遗传学图。这使我们又一次想起了摩尔根以果蝇同一染色体上的基因之间的杂交重组百分率作为基因在染色体上距离这个物理量的相对量度的创造性构想。这里,沃尔曼和雅各布同样赋予时间这个物理量深刻的生物学意义。
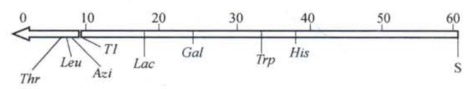
图2-8 用中断接合实验绘制的大肠杆菌K12 Hfr(H株)连锁图
沃尔曼和雅各布不断延长Hfr菌和Fˉ菌接合的时间,以求得更完整的连锁图时,他们发现当接合时间为120 min时,一部分重组子由F-变为Hfr。这暗示性因子F也可以是染色体上的一个标志基因,而且是染色体转移的终点。所以他们把细菌的染色体概括为以0为起点,以F为终点的基因载体。这又是一个极富创造性的思想:在F+细菌中,性因子F是游离于染色体之外的,而在Hfr菌中,F因子是染色体的一部分,是供体细胞的基因向受体细胞转移的最后一个标志。
随着Hfr菌品系的增加,测定细菌连锁图的工作又遇到了新的困难。人们发现,由不同Hfr菌测得的基因连锁图是不一样的,表2-1列出了5株Hfr菌的基因连锁顺序。
表2-1 5株Hfr菌的基因连锁顺序

注:Pur为嘌呤合成基因;Pro为脯氨酸基因;Thr为苏氨酸基因。
粗粗一看,这堆资料似乎杂乱无章,但细细揣摩就会发现不同菌株的标志基因并非都是随机出现的,他们之间的顺序差异是有章可循的。例如,His基因的两侧总是Gal和Gly;Lac基因的两侧总是Pur和Pro。其他基因只要不处于染色体的两端,也有固定的邻接基因,只是不同的Hfr品系的基因转移次序是不一样的。如Hfr H和AB 312的His比Gly早转移,并达到较高的重组率,而在另外三个Hfr品系中His比Gly晚转移,其重组率也要低一些。此外,所有品系都有一个共同的特点,即转移的起始点0和转移的终点F总是位于染色体的两端。
怎样解释这张表呢?
沃尔曼和雅各布提出了一个出人意料的假设,他们认为在F+细胞中,F因子是一个细胞质因子(这可以解释F+和Fˉ杂交时Fˉ极易变为F+),而细菌的染色体是一个环状DNA分子。当F因子插入环状染色体的某一位置时,染色体即断开,成为以0为起点,以F为终点的线状DNA分子。当他们在1957年提出“环状染色体”这个概念时,同行是有疑虑的,甚至是难以接受的,但也不得不承认这是解释不同菌株的基因连锁图差异的最佳方案(图2-9)。1963年,当凯恩斯在研究大肠杆菌DNA复制机制时获得了细菌的环状DNA分子复制的电镜照片,人们在接受环状染色体概念(图1-19)的同时,又一次用惊讶的目光注视着六年前通过杂交分析提出这个假设的沃尔曼和雅各布。
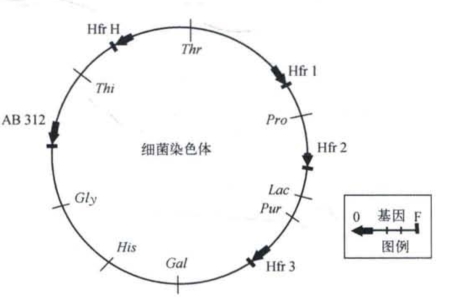
图2-9 细菌环状染色体假设示意
在凯恩斯的照片发表之前,A.坎贝尔(A.Campbell)就把“环状”概念延伸到了F因子,他假设F因子是一个分子量较小的环状DNA分子,并由此建立了两个环状DNA分子可通过一次交换整合为一个大的环状DNA分子的模型。A.坎贝尔假设F因子有三个组成部分:能育基因区段、能和染色体上多处同源区段配对的偶合配对区、决定断裂和转移方向的转移起始区(图2-10)。
关于F因子整合于染色体的A.坎贝尔模型包含三个要点。
(1)F因子和染色体这两个环状DNA分子必须有可以互相识别和偶合配对的同源序列。

图2-10 F因子的结构和A.坎贝尔模型示意(引自D.T.Suzuki)
(2)F因子整合于染色体后,插入环中的基因序列要颠倒(图2-10中三角形空心箭头所示)。
(3)原先的两个不同来源的DNA分子整合后会形成同一个线性结构,即具有结构同线性(collinear)。
综上所述,细菌的性因子F在细菌细胞中有两种可能的存在方式。①在F+细胞中,F因子处于自主状态,它的复制是独立于染色体复制的。在接触Fˉ细胞时,F因子可转移到Fˉ细胞中去,而不必伴有染色体基因的转移和重组。②在Hfr细胞中,F因子整合于染色体,成为染色体的一部分,并与染色体同步复制。在与Fˉ细胞接合时,F因子不能独立转移,而是作为转移的终点随染色体转移而转移。
雅各布和沃尔曼把这类既能以游离状态又能以整合状态存在的遗传因子称为附加体(episome)。附加体的整合过程是可逆的。F+和Fˉ接合重组,实际上是F+细胞群体中,少数F因子整合于染色体的Hfr菌和Fˉ细胞的接合和重组。在Hfr菌群体中也会自发地产生F+细菌,这是因为F因子重新游离于细菌染色体的结果。正如发现由F+菌变为Hfr菌给人们一个认识细菌接合重组本质的机会一样,由Hfr菌变为F+菌的过程也为人们提供了发现新的自然现象的机会。
1959年,阿德尔贝格(E.Adelberg)在用Hfr菌做重组实验时,发现有一株Hfr菌的重组频率非常低,随后的分析表明这个菌株的F因子已经重新游离了出来。但是,阿德尔贝格很快发现这个由Hfr菌演变成的F菌和一般的F+菌有两个明显的不同之处。①新的F菌很容易回复到Hfr菌的状态,回复频率远高于一般的F+变为Hfr菌的频率。②这种回复有某种位置特异性,它总是整合于它原先整合的位置,而不像一般的F性因子那样随机整合。阿德尔贝格把这种特殊的F菌所携带的性因子称为F′。为了探明F′和F的区别,他和雅各布一起用Hfr 2做实验(Hfr 2的基因连锁次序为:0-Pro-Thr-Thi-Gly-His-Gal-Pur-Lac-F),从中选得了一株带F′因子的新菌株。这个带F′的细菌和Fˉ菌混合培养时,Lac+重组子出现的频率异乎寻常的高。

实验表明,几乎所有的Lac+菌都成了F+菌,但也有少数后裔分离出Lacˉ菌。雅各布和阿德尔贝格立刻假设这是因为F′因子携带了一段细菌的染色体基因Lac+,使受体细胞变为F′Lac+/Lacˉ杂合子。也就是说F因子在从染色体上游离出来时,错带了邻接于该F因子插入位点的Lac+基因,形成了F-Lac+这样的F′因子。图2-11是上述设想的示意图。在接受F-Lac+这样的F′细胞中也可能会发生重组与分离。这类部分基因是二倍体的细胞称为部分合子(merozygote),是遗传学上非常有用的分析工具(第1章第5节关于操纵子模型的研究中就广泛地应用了部分合子)。
通过F这个性因子而实现的基因转移和重组现象称为性导(sexduction)。显而易见,在不同的Hfr菌群中会产生不同的、带有染色体上不同片段的F′因子,一系列不同的F′因子可以用来做特定基因的转移和重组实验,也可以用来做基因的定位和功能调控的研究。在噬菌体和其他细菌质粒的整合和游离过程中,也会发生类似性导的现象,这些就是遗传工程技术的“启蒙老师”。

图2-11 F-Lac+因子的起源和重新整合(引自G.S.Stent)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














