实验二十九 2-DE电泳蛋白组学分析菌种代谢差异
一、实验目的
学习和掌握蛋白质双向电泳的基本原理和方法,运用双向电泳-蛋白质组学方法评价高产与低产突变株的差异性。
二、实验原理
高产与低产突变菌株的遗传背景、代谢通路及代谢活性都表现出巨大差异。采用蛋白组学的方法,可以更直接与全面评价突变株的代谢活性差异,从而帮助我们更深入地了解高产菌种的代谢特征,为菌种筛选提供指导。
第一向步骤为等电聚焦(IEF),即根据蛋白质的等电点(pI)差异将蛋白质分离。第二项步骤为十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),即利用蛋白质的分子量(Mr,相对分子量)差异将蛋白质分离。双向凝胶电泳结果中的每个斑点都对应着样本中的一种蛋白。因此,可将上千种不同的蛋白质分离开来,并得到每种蛋白质的等电点、表观分子量和含量等信息。
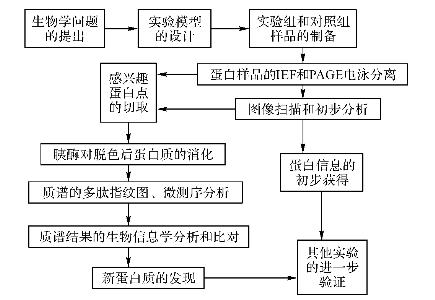
图29-1 菌株差异蛋白表达分析路线图
三、试验材料与试剂配制
(一)试验材料
IPG干胶条(Immobilized pH gradient,pH=4~7,线性),IPG Buffer (Immobilized pH gradient buffer,pH=4~7),IPG覆盖液(Immobilized pH gradient cover fluid),二硫苏糖醇(1,4-Dithiothreitol,DTT),3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸(CHAPS),四甲基乙二胺(N,N,N,N-Tetramethylenediamine,TEMED),甲叉双丙烯酞胺(N,N′-methylenebisacrylamide),琼脂糖(Argrose),丙烯酰胺(Acrylamide),十二烷基硫酸钠(Sodium Dodecyl Sulfate,SDS),超纯脲(Ultra Urea),矿物油(Mineral Oil),甘油(Glycero),三羟甲基氨基甲烷(Tris Aminomethane),碘乙酰胺(Iodoacetamide),过硫酸铵(ammonium persulfate,AP),甘氨酸(Glycine)等均购于Bio-Rad公司(USA);蛋白质定量试剂盒(内含Protein Assay Kit I,牛血清标准品Protein Standard I,RC DC Protein Assay Kit I),蛋白质清洁试剂盒(Clean-up kit)购自Bio-Rad公司(USA);硫脲(Thiourea)、溴酚蓝、考马斯亮蓝R-250购自上海生物工程技术服务有限公司(Sangon)。冰醋酸、无水乙醇等试剂为通用的国产分析纯。
(二)主要试剂的配制
(1)裂解液:8M尿素9.6g,2M硫脲3.04g,4%CHAPS 0.8g,65mM DTT 0.196g,0.8%Carrier Ampholyte(pH 3~10)400μl,加Milli-Q水定容至20mL,分装贮存于-20℃。
(2)水化上样缓冲液:8M尿素9.6g,2M硫脲3.04g,4%CHAPS 0.8g,分装贮存于-20℃,使用时加入65MMDTT 0.196g,0.8%Carrier Ampholyte (pH 4~7)400μl,加Milli-Q水定容至20mL,分装贮存于-20℃中备用。
(3)30%丙烯酰胺贮液:丙烯酰胺150g,甲叉基双丙烯酰胺4g,加Milli-Q水定容至500mL,0.45微米的滤膜过滤后,棕色瓶4℃冰箱保存。
(4)平衡母液:50mM Tris-HCl(pH 8.8)6.7mL,6M尿素72.07g,20%甘油40.4mL,2%SDS 4.0g,加Milli-Q水定容至200mL;分装贮存于-20℃备用;用之前加DTT或碘乙酰胺。
(5)溴酚蓝溶液:溴酚蓝100mg,50mM Tris-HCl(pH 6.8)60mg,加Milli-Q水定容至10mL,分装贮存于4℃备用。
(6)浓缩胶缓冲液(0.5MTris-HCl pH 6.8):0.5MTris碱12g,用1MHCl调整pH至6.8,加Milli-Q水定容至200mL,贮存于4℃备用。
(7)4×分离胶缓冲液(Tris-HCl pH 8.8):1.5MTris base 90.75g,用1M HCl调整pH至8.8,加Milli-Q水定容至500mL,贮存于4℃备用。
(8)2×SDS凝胶上样缓冲液:0.5MTris-HCl(pH 6.8)2.0mL,10%甘油2.0mL,10%SDS 4.0mL,1%溴酚蓝0.05mL,100mM DTT 0.154g(用时现加),加Milli-Q水定容至10mL,贮存于4℃备用。
(9)10×电泳缓冲液:25mM Tris 15.1g,192mM甘氨酸72.1g,0.1%SDS 5.0g,加Milli-Q水定容至500mL,棕色瓶常温(25℃)保存,使用前稀释成1×电泳缓冲液。
(10)10%SDS:10g SDS溶于Milli-Q水中,总体积100mL,混匀后室温(25℃)保存。
(11)10%AP:0.1g AP溶于Milli-Q水中,总体积1mL,用时加水溶解。
(12)琼脂糖封顶液:0.5%低熔点琼脂糖0.5g,25mM Tris碱0.303g,192mM甘氨酸1.44g,0.1%SDS 1mL,0.001%溴酚蓝100μl,加Milli-Q水定容至100mL,混匀后在微波炉中加热直至琼脂糖完全溶解,贮存于4℃备用。
四、实验步骤
(一)蛋白质提取
精确称取样品50mg,在研钵中加入液氮研磨至粉末状,分装于Eppendorf管中并添加500μL的裂解液(100倍稀释),用研磨棒进一步磨匀,于4℃下孵育2h(每30min混旋一次)后在低温(4℃)离心机中12 000rpm离心1h,撇开上面悬浮物和下层沉淀物,取中间层的澄清液,用1.5mL的离心管分装,抽提蛋白质浓度定量后储藏于-80℃备用,实验重复三次。
(二)蛋白质定量
结合Lowry比色法用2-D Quant kit试剂盒检测样本中蛋白质的含量。Lowry法是通过沉淀剂和共沉淀剂去除干扰物质并使溶液中蛋白质沉淀,以碱性铜离子溶液重新溶解蛋白质沉淀,铜离子将与多肽骨架结合,随后加入到能够与游离铜离子发生反应的显色剂,这时溶液颜色发生变化,深浅程度与蛋白质浓度成负相关,根据标准曲线可以精确定量样品中的蛋白质。步骤如下:
(1)将5μL DC试剂S与250μL DC试剂A混合(试剂A′),每份标准蛋白/待测样品需要127μL试剂A′。
(2)将标准蛋白作标准梯度稀释,蛋白质浓度分别为0,0.25,0.50,0.75,1.00,1.25和1.50mg/mL。
(3)从每份待测样品中取出25μL,向每管中加入125μL RC试剂Ⅰ,混旋后室温放置1min。
(4)接着向每管中加入125μL RC试剂Ⅱ,混旋后于15 000rpm离心5min。
(5)弃去上清液,将离心管倒置在吸水纸上,使溶液彻底被吸干。
(6)向每个离心管中加入127μL试剂A′并混旋,直至沉淀彻底溶解,在进行下一步前再次混旋。
(7)分别向每个离心管加入1mL DC试剂B,立即混旋,室温下放置15min。
(8)在750nm下读取吸光值,吸光度测定在1h内完成。
每个浓度测3个重复,以标准蛋白质的浓度为x轴,吸光度A值为y轴作标准曲线。
(三)双向电泳
1.第一向等电聚焦
(1)从冰箱中取出-20℃冷冻保存的IPG预制胶条(17cm,5~8),在室温下放置10min,使胶条恢复到常温状态。
(2)从冰箱中取出-20℃冷冻保存的水化加样缓冲母液(其中8mol/L尿素,2mol/L硫脲,0.065mol/L丙磺酸),置室温解冻,加入二硫苏糖醇(DTT)10mg和两性电解质溶液(Bio-Lyte pH 5~8)6.67μL并充分混匀。
(3)根据蛋白浓度检测结果的计算,将相同蛋白含量(210μg)的样品与一定量的水化加样缓冲液充分混匀,使上样总溶液体积达到300μL。
(4)将样品均匀加入到清洗干净的聚焦盘中(样品的添加量根据胶条的长度和样品的蛋白质含量确定),中间的样品液一定要连贯。
(5)当所有的蛋白质样品都已经加入到聚焦盘中后,用镊子轻轻地去除预制IPG胶条上的支持膜。
(6)分清胶条的正负极,轻轻将IPG胶条胶面朝下置于聚焦盘或水化盘中样品溶液上,使得胶条的正极对应于聚焦盘的正极,确保胶条与电极紧密接触。
(7)在每根胶条上覆盖约2mL矿物油,防止胶条水化过程中液体的蒸发。
(8)盖好盖子后置于等电聚焦仪(IPGphor)电极板上,确保胶条与电极密切接触。
(9)设置水化条件:在50V的低压电场下主动水化12h。
(10)水化结束后搭盐桥,并直接进行IEF(最高电流50μA/gel,温度20℃),等电聚焦程序如表29-1所示。
表29-1 等电聚焦升压程序
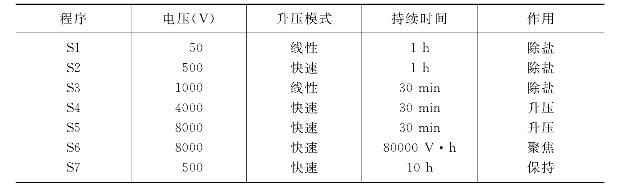
(11)电泳完毕取出胶条,湿润滤纸吸去残余矿物油。如不及时进行垂直板SDS-PAGE电泳,胶条可-20℃暂存。
2.胶条的平衡
(1)在桌上先放置干的厚滤纸,聚焦好的胶条胶面朝上放在干滤纸上;将另一份厚滤纸用Milli-Q水浸湿,挤去多余水分,然后直接置于胶条上,轻轻吸干胶条上的矿物油及多余样品;这可以减少凝胶染色时出现的纵条纹。
(2)将胶条转移至样品水化盘中,每个槽一根胶条,在有胶条的槽中加入6mL平衡缓冲液Ⅰ(平衡母液中临时加入2%DTT),将平衡盘放在水平摇床上缓慢摇晃13~14min(一定要小于15min)。
(3)再加入6mL胶条平衡缓冲液Ⅱ(以2.5%碘乙酰胺替换平衡液Ⅰ中2% DTT),继续在水平摇床上缓慢摇晃约15min。平衡结束后,用滤纸吸取多余的平衡液(将胶条竖在滤纸上,以免损失蛋白或损坏凝胶表面)。
3.SDS-PAGE
(1)将清洗干净并完全干燥的玻璃板按照仪器操作说明要求在支架上安装好。
(2)配制12.5%的丙烯酰胺凝胶两块配方见表29-2,配70mL凝胶溶液,每块凝胶35mL,充分混匀,注意过硫酸铵要新鲜配制。
表29-2 分离胶配方
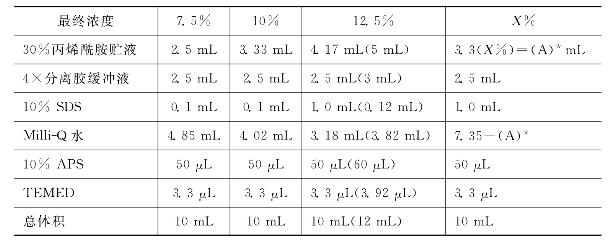
(3)慢慢地将凝胶溶液分别注入玻璃板夹层中(1mm厚度),上部留1cm的空间,用饱和正丁醇封闭,保持胶面平整。
(4)待凝胶凝固后倒去分离胶表面的饱和正丁醇,用Milli-Q水冲洗胶面数次;
(5)用滤纸吸去SDS-PAGE聚丙烯酰胺凝胶上方玻璃板间多余的液体,将处理好的第二向凝胶放在桌面上,长玻璃板在下,短玻璃板朝上。
(6)将10×电泳缓冲液,用量筒稀释10倍,配成1倍的电泳缓冲工作液,去除缓冲液表面的气泡。
(7)将IPG胶条从样品水化盘中移出,并用滤纸吸取多余的平衡液(将胶条竖在滤纸上,以免损失蛋白质或损坏凝胶表面)。
(8)用镊子夹住胶条的一端使胶面完全浸泡在电泳缓冲工作液中,然后将胶条胶面朝上放在凝胶的长玻璃板上,其余胶条同样操作。
(9)用镊子轻轻地将胶条向下推,使之与聚丙烯酰胺凝胶胶面完全接触。
(10)将放有胶条的SDS-PAGE凝胶转移到灌胶架上,短玻璃板一面对着自己,在凝胶的上方加入低熔点琼脂糖封胶液。
(11)如果胶条与聚丙烯酰胺凝胶之间有气泡,就用镊子将胶条轻轻下压。
(12)室温下放置,使低熔点琼脂糖封胶液彻底凝固,将凝胶转移至电泳槽中;
(13)在电泳槽加入电泳缓冲液后,接通电源开始SDS-PAGE电泳,运行电压如表29-3进行。待溴酚蓝指示剂到达底部边缘时即可停止电泳。
表29-3 SDS-PAGE电泳设置参数

(14)电泳结束后,卸下玻璃板,轻轻撬开两层玻璃,取出凝胶,并切角以做记号(戴手套,防止污染胶面)进行染色。
4.硝酸银染色
染色方法与试剂用量如表29-4所示。
(1)取胶:取出的胶板平放在垫有干净吸水纸的桌面上,用塑料尺沿胶板两端轻轻启开玻璃板(注意不要从中间启,防止胶断裂)。取下的玻璃板用自来水冲洗后放在架上,即用即洗。
(2)固定:用手缓慢拉起胶一边(如这边有裂口,换另一边拉起),将胶轻轻放入盛有500mL固定液的染色盒中,脱色摇床摇动过夜。(注意:摇动速率不要太快,适中即可,防止胶破裂。)
(3)敏化:胶固定好后,倒掉固定液(注意用手轻按住胶上部,避免滑入水槽中);在染色盒中加入500mL敏化液,脱色摇床摇动30min。
表29-4 双向电泳银染步骤与配方
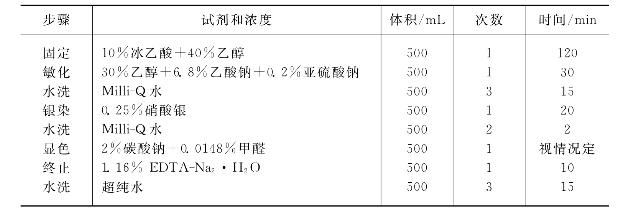
(4)洗胶:敏化到时后,倒掉敏化液,用ddH2O(500mL/次)洗三次,脱色摇床摇动5min/次。
(5)染色:在染色盒中加入500mL染色液,脱色摇床摇动20min。
(6)洗胶:染色到时后,倒掉染色液,用ddH2O(500mL/次)洗二次,脱色摇床摇动1min/次。
(7)显色:在染色盒中加入500mL显色液,观察胶显色情况。
(8)终止:胶显色到适当时间(4~6min),倒掉显色液,加入500mL终止液,终止反应。
如果要取点用于质谱检测,则需要用ddH2O(500mL/次)洗三次,最后一次摇动稍长时间。
5.图像的扫描与分析
蛋白质双向电泳凝胶显色后,要对凝胶图像进行备份保存,从而以数字化图像的形式存储下来,而且要尽量完整地保留定性和定量信息,以利于进一步分析。采用高分辨专业扫描仪(Calibrated Densitometer,GS800,Bio-Rad,USA)对银染凝胶进行灰度扫描,扫描方式为透射,图谱保存为TIF格式。所获得扫描图像可通过图像分析软件进行差异蛋白质组分析。
采用Bio-Rad公司PDQuest 7.0凝胶图像分析软件读取分析二维图像数据。图谱分析前将各组原始扫描图像剪切成同样大小,对图像进行分析。PDQuest 7.0分析软件的工作原理是围绕每一个像素点构建一个算子,然后比较算子中心和边缘的光密度值,比值达到一定强度时该中心点的像素即被认为是蛋白质点的一部分,重复此过程,软件即可自动检测出完整的蛋白质点。分析过程包括蛋白质点检测、背景消减、归一化处理和蛋白质点匹配等。
五、实验记录
(1)以标准蛋白浓度(mg/mL)为横坐标、吸光度A595为纵坐标绘制标准蛋白曲线。
(2)将实验扫描图谱结果贴到指定框内。

六、思考题
(1)简述蛋白组学双向电泳技术的基本原理。
(2)蛋白组学双向电泳样品制备应遵循的基本原理是什么?
(3)实施双向电泳技术操作中应特别注意哪些问题?
[1]李娇.中国对虾贮藏过程中肌肉蛋白质生化特性变化规律研究[D].杭州:浙江工商大学,2011.
[2]黄建国,高学军,李庆章,等.双向电泳检测奶牛乳腺上皮细胞核磷酸化蛋白质方法的建立[J].乳业科学与技术,2011,6(34):250—253.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















