14.2.1 电泳分析法
一般实验室常用电泳法检验酶的纯度。电泳法用样品少(10μg左右)、速度快(2~4h)、仪器简单、操作也较方便。使用最多的为聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)。
PAGE不同于一般的自由界面电泳或其他介质电泳,其电泳分离时,电泳系统兼有“电荷效应”、“浓缩效应”和“分子筛效应”,因而分辨率较高。根据制胶形状的不同,常分成圆盘电泳和垂直板电泳两种。
当聚丙烯酰胺凝胶的孔径约为被分离的蛋白质分子平均大小的一半时,分离效果最佳。因此,用PAGE来鉴定酶的纯度时,应根据被检测酶相对分子质量(Mr)的大小,选用孔径合适的凝胶(见表14-3)。凝胶的孔径可以通过改变聚丙烯酰胺和甲叉双丙烯酰胺的含量和比例方便地加以调节。
表14-3 电泳分离最适凝胶浓度

通常把浓度为7.5%的凝胶称为标准胶,其平均孔径为5nm左右,适合于生物体内大多数蛋白质的分离。溶液的pH值可显著影响蛋白质分子侧链基团的解离状态,使蛋白质分子电荷性质发生改变,故应选择合适的pH凝胶系统,使蛋白质得到较好的分离。一般地,高、中pH凝胶系统适合于分离酸性和中性蛋白质,低pH系统则适宜于碱性或中性蛋白质的分离。电极的接法前者为上负下正,后者为上正下负。
电泳用的样品中通常加一些甘油或蔗糖溶液,用以增加样品密度,预防加样时样品扩散和漂移。样品中有时还要加入一些巯基乙醇,以防电泳时蛋白质侧链中游离的巯基氧化成二硫键,发生聚集现象。另外,样品液中常加入少量溴酚蓝(0.1%左右),用以指示电泳进行的程度。电泳结束后,需将分离的酶蛋白进行染色显示。染色的方法可分为两大类:一类是采用与蛋白质起染色反应的染料染色,常用的有氨基黑10B、考马斯亮蓝R-250及一些荧光染料,如1-苯氨基-8-萘磺酸镁,等等;另一类是利用酶特异性的活性染色,如NBT活性染色等。
14.2.1.1 SDS-PAGE分析法
聚丙烯酰胺凝胶是由丙烯酰胺单体聚合成长链,同时通过双功能化合物例如N,N-甲叉双丙烯酰胺对这些长链进行交联,在加速剂和催化剂的作用下聚合交联成三维网状结构的凝胶。丙烯酰胺的浓度对凝胶有效孔径的大小都有着显著的影响,浓度越高,孔径越小,反之亦然。因而,选择合适的丙烯酰胺浓度是获得蛋白质组分最佳分离效果的关键。
各种蛋白质由于所带的净电荷、大小和形状不同而有不同的迁移率,在电泳体系中加入阴离子表面活性剂十二烷基硫酸钠(SDS),蛋白质与其按质量比结合成复合物,使蛋白质分子所带的负电荷远远超过天然蛋白质分子的净电荷,消除了不同蛋白质分子的电荷差异,电泳迁移率主要决定于蛋白质分子的大小,而与其所带的净电荷和形状无关,这种电泳方法被称为十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。
SDS-PAGE的结果可以使用银或者考马斯亮蓝进行染色。使用银染时,检测限一般为1~10ng,加样量不应低于5μg;采用考马斯亮蓝R-250进行染色时,检测限在0.14μg,加样量不应低于10μg。纯的蛋白质在SDS-PAGE中应显示单一的蛋白条带。所需要使用的聚丙烯酰胺的浓度可根据蛋白质相对分子质量的大小来选择。当样品中含有多聚体时,还应该进行非还原性SDS-PAGE检测。
由于SDS-PAGE分析不需要昂贵的仪器设备,操作简便,能在几小时内得到结果,有较高的重复性,是目前为大家所接受的测定蛋白质亚基相对分子质量的一种最好的方法,因而在SOD的纯度鉴定中得到最广泛的应用。
(1)试剂配制。
水:电阻率不低于18.2MΩ·cm。
A液:1.5mol/L三羟甲基氨基甲烷-盐酸缓冲液。称取三羟甲基氨基甲烷(Tris)18.15g,加适量水溶解,用盐酸调pH至8.8,加水稀释至100mL。
B液:30%丙烯酰胺-0.8%N,N-甲叉双丙烯酰胺溶液(避光保存)。
C液:1%十二烷基硫酸钠溶液。
D液:10%四甲基乙二胺(TEMED)溶液。
E液:10%过硫酸铵溶液,用前配制。
F液:0.5mol/L三羟甲基氨基甲烷盐酸缓冲液。称取三羟甲基氨基甲烷6.05g,加适量水溶解,用盐酸调pH值至6.8,加水稀释至100mL。
电极缓冲液:称取三羟甲基氨基甲烷3g、甘氨酸14.4g、十二烷基硫酸钠1g,加适量水溶解,用盐酸调pH值至8.3,加水稀释至1 000mL。
供试品缓冲液:称取三羟甲基氨基甲烷0.303g、溴酚蓝2mg、十二烷基硫酸钠0.8g,量取盐酸0.189mL、甘油4mL,加水溶解并稀释至10mL,此溶液用于非还原SDS-聚丙烯酰胺凝胶电泳,如用于还原SDS-聚丙烯酰胺凝胶电泳,则再加β-巯基乙醇2mL。
相对分子质量标准:供试品的相对分子质量应包括在使用的相对分子质量标准范围之内。
固定液:量取甲醇250mL、冰醋酸60mL,加水稀释至500mL。
漂洗液:量取乙醇100mL、冰醋酸50mL,加水稀释至1 000mL。
辅染液:称取重铬酸钾10g,量取硝酸2mL,加适量水溶解并稀释至200mL,用前40倍稀释。
银染液:称取硝酸银2.04g,加水溶解并稀释至1 000mL。
显色液:称取碳酸钠30g加适量水溶解,加甲醛0.5mL,并稀释至1 000mL。
终止液:量取冰醋酸10mL加水稀释至1 000mL。
考马斯亮蓝染色液:称取考马斯亮蓝R-250 1g,加入甲醇200mL、冰醋酸50mL、水250 mL混匀。
考马斯亮蓝脱色液:量取甲醇400mL、冰醋酸100mL,与水500mL混匀。
(2)操作方法。
①供试品溶液的制备:将供试品与供试品缓冲液按3∶1的比例混匀,100℃水浴加热3~5min。
②分离胶溶液的制备:按表14-4制成分离胶溶液,灌入模具内至一定高度,加水封顶,室温下聚合(室温不同,聚合时间不同)。
表14-4 不同浓度聚丙烯酰胺凝胶配制表

③浓缩胶溶液制备:待分离胶溶液聚合后,用滤纸吸去上面的水层,再灌入浓缩胶溶液(配方见表14-4),插入样品梳,注意避免气泡出现。
④加样:待浓缩胶溶液聚合后,小心拔出样品梳,将电极缓冲液注满电泳槽前后槽,在供试品孔中加入供试品溶液5μg(银染法)或10μg以上(考马斯亮蓝染色法)。
⑤固定与染色。
银染法:除另有规定外,银染法一般不用于定量试验;做定性试验时,上样量可以适当增加。将电泳后的凝胶浸入固定液中过夜,取出,用漂洗液漂洗三次(温度应不低于25℃),每次10min;漂洗后的凝胶浸于辅染液中7~10min后取出,用水浸洗3次,每次2min;将浸洗后的凝胶浸于银染液中,置较强日光或类似光源下照射30min,再于室内光线下放置20min;将凝胶自银染液中取出,用水浸洗2次,每次1min;然后将凝胶浸于显色液中,每隔2min换液一次,直至蛋白条带显色完全;将凝胶浸于终止液中10min后,取出凝胶保存于水中。
考马斯亮蓝法:将电泳后的凝胶浸入染色液中过夜,取出后浸入脱色液中,至凝胶底色几乎无色后,取出凝胶保存在水中。

图14-1 西瓜子叶的Mn-SOD的SDS-PAGE分析
1—标准相对分子质量对照;2—银染Mn-SOD(2μg);3—采用豌豆叶中的Mn-SOD抗体进行的免疫蛋白印迹试验(80ng蛋白)
(3)应用实例。
①西瓜子叶的Mn-SOD的SDS-PAGE分析。
在对过氧化物酶体膜结合的Mn-SOD研究中,运用SDS-PAGE方法对经Sephadex G-150柱层析后的洗脱组分进行纯度鉴定。分析条件:丙烯酰胺浓度12%,银染法。分析结果如图14-1所示。图14-1显示Mn-SOD的电泳图谱呈单一谱带,表明Mn-SOD为电泳纯,根据结果估计此酶的亚基约为27kD。
②R-cm-SOD(A)和N-cm-SOD(B)的SDSPAGE分析。
袁勤生等运用Pet-21a表达载体在大肠杆菌中成功地表达了重组Cu,Zn-SOD(R-cm-SOD,recombinant Cu,Zn-SOD fromC.militaris),经离子交换色谱和凝胶过滤进行纯化分离,并将分离结果与天然的Cu,Zn-SOD(N-cm-SOD,native Cu,Zn-SOD fromC.militaris)进行了对比。纯度鉴定分析条件:丙烯酰胺浓度13.5%,考马斯亮蓝R-250染色。相对分子质量标准:兔磷酸化酶(97 400),牛血清白蛋白(66 200),兔肌动蛋白(43 000),牛碳酸酐酶(31 000),胰岛素抑制剂(20 000),蛋清溶菌酶14 400)。分析结果如图14-2所示。

图14-2 R-cm-SOD(A)和N-cm-SOD(B)的SDS-PAGE分析
(A)1—粗提物(40μg);2—G-100纯化组分(10μg);3—CM-52纯化组分(15μg);4—DEAE-FF纯化组分(20μg)。
(B)1—G-100柱后酶溶液(5μg);2—CM-52柱后酶溶液(10μg);3—DEAE-FF柱后酶溶液(20μg);4—硫酸铵沉淀物(40μg);5—粗提物(40μg);M—(相对分子质量标记物,单位:kD)。
图14-2分析结果表明,R-cm-SOD(图14-2(A),泳道2)和N-cm-SOD(图14-2(B),泳道1)为单一的谱带,已达电泳纯度。
活性染色法:活性染色法是利用酶本身的催化活性,将酶促反应直接或间接地与可以生成有色物质的化学反应相偶联,从而染色显示酶蛋白所在位置。其中四氮唑盐法使用最为广泛,凡酶促反应的底物或产物能使黄色可溶性硝基四氮唑蓝(nitrotetrazolium blue,NBT)还原生成不溶性的蓝色甲物的都可用该法检测。SOD经凝胶电泳分离后也可用此法检测,核黄素光化学还原时生成的 可使NBT还原,而SOD能够竞争性地清除
可使NBT还原,而SOD能够竞争性地清除 ,因此,当电泳分离的凝胶经含核黄素、NBT、TEMED的溶液浸泡后,再经光照,就能在蓝色背景上显示出含有SOD的空白条带,这种活性染色法可检测出纳克级的SOD。
,因此,当电泳分离的凝胶经含核黄素、NBT、TEMED的溶液浸泡后,再经光照,就能在蓝色背景上显示出含有SOD的空白条带,这种活性染色法可检测出纳克级的SOD。
无论用什么方法染色,如果染色显示出多个条带,说明酶样品中还含有其他蛋白质。假如只有一个条带,有时还需要进一步验证,因为某一条件下可能有两种蛋白质的电泳迁移率完全相同,可以通过改变电泳条件、进行双向电泳或其他方法来进一步确定酶的纯度。
14.2.1.2 等电聚焦法
等电聚焦(isoelectric focusing,IEF)是在具有pH梯度的环境中进行的电泳。将蛋白质置于具有pH梯度的凝胶中进行电泳时,它会朝着与自身所带电性相反的电极移动,直到抵达与其等电点(isoelectric point,pI)相同的pH值处才因失去驱动力而停止移动。如果蛋白质表面所带电荷相同,它们就会具有相同的等电点。平板等电聚焦和毛细管等电聚焦两种方法都可用于蛋白质的纯度鉴定。
(1)平板等电聚焦方法。
①标准蛋白溶液配制:将每种蛋白质的浓度均配成4mg/mL,这些标准蛋白包括:组织纤维溶酶原激活剂(tissue plasminogen activator,tPA),牛血清白蛋白(bovine serum albumin,BSA),人血清白蛋白(human serum albumin,HAS),转铁蛋白(transferrin)以及γ-球蛋白(gamma globulin,IgG)。除转铁蛋白为-20℃冻存外,其他标准蛋白应储存于2℃~8℃;所有的标准蛋白溶液均应用去离子水配制,并在冰浴中进行;配制的标样溶液应记录蛋白质的浓度(4mg/mL)及配制日期,置于-20℃冻存。
②IEF电泳缓冲液的配制:
样品缓冲液:一般在IEF试剂包中配有以下几种。
600mL IEF阳极缓冲液(1×):将试剂包中50×阳极液用去离子水1∶50稀释。
200mL IEF阴极缓冲液(1×):将试剂包中10×阴极液用去离子水1∶10稀释。
将缓冲液过滤并脱气。
脱色液的配制:甲醇450mL,去离子水450mL,冰醋酸100mL,2℃~8℃储存。
染色液的配制:考马斯亮蓝0.5g,配成500mL;2℃~8℃储存。
(2)毛细管等电聚焦方法。
与普通的凝胶等电聚焦一样,两性电解质可在毛细管内形成稳定的pH梯度。样品与两性电解质载体在电场中聚焦至电流趋于零,样品在电场作用下迁移到各自的等电点位置,形成聚焦区带。此时可采用压力推动或者在电极液中加入盐,以改变已经形成的pH梯度等方式驱动蛋白质条带移动并逐一经过检测窗口。在确定的pH范围内,pI与tR呈线性关系。用已知等电点的蛋白质作为标准,绘制其pI对tR的标准工作曲线,用以计算待测样品的等电点。
毛细管等电聚焦采用中性涂层柱、pH=3~10两性电解质和等电点Marker。将待测样品(经过脱盐)溶于2%两性电解质、0.1%~0.4%甲基纤维素(methyl cellulose,MC)或羟丙基甲基纤维素(hydroxypropyl methyl cellulose,HPMC)、0.5%~1%N,N,N′,N′-四甲基乙二胺(TEMED)混合溶液中,用前配制。在聚焦过程中,两极的电极液分别采用91mmol/L H3 PO4溶液和20mmol/L NaOH溶液,聚焦电压13.5kV,聚焦时间2min,紫外检测波长280nm,毛细管温度20℃。
比如:将样品与等电点Marker混合进样分析,对照品及待测样品迁移时间如下:

以标准等电点Marker的迁移时间对其等电点(pI)进行线性回归,得到回归方程式
y=a+bx
式中 a=12.90,b=-0.290。
将被测样品的迁移时间13.29min代入回归方程计算,得到样品的pI为9.05。
14.2.1.3 毛细管电泳法
毛细管电泳法是以弹性石英毛细管为分离通道,以高压直流电场为驱动力,依据供试品中各组分在单位电场强度下的迁移速度和(或)分配行为的差异而实现各组分分离的一种分析方法。
毛细管电泳的分离模式主要有毛细管区带电泳、毛细管凝胶电泳、毛细管等速电泳、毛细管等电聚焦电泳、胶束电动毛细管色谱和毛细管电色谱等几种。分析蛋白质和多肽等两性样品时,一般优先考虑毛细管区带电泳和毛细管等电聚焦电泳的分离模式。
毛细管区带电泳是将待分析溶液引入毛细管进样一端,施加直流电压后,各组分按各自的电泳流和电渗流的矢量流向毛细管出口端,按阳离子、中性粒子和阴离子及其电荷大小的顺序通过检测器。中性组分彼此不能分离。出峰时间称为迁移时间(tm),相当于HPLC和GC的保留时间。
毛细管等电聚焦电泳是一种根据等电点差别分离生物大分子的电泳技术,等电聚焦电泳在毛细管中进行,就是毛细管等电聚焦。如氨基酸、蛋白质、多肽等在其等电点时为电中性,单位电场强度下的迁移速度为零。利用两性物质等电点时呈电中性、单位电场强度下的迁移速度等于零的特性,建立了等电聚焦电泳的分析技术。
(1)仪器与试剂。
①器材:毛细管电泳仪。
②试剂:操作缓冲液的种类、pH值和浓度以及添加剂对测定结果的影响很大,应根据产品的性质进行初试,再将初试的结果进行调整、优化。
磷酸盐是毛细管区带电泳最常用的缓冲体系之一,它的紫外吸收低、pH缓冲范围比较宽(pH为1.5~13),但电导也比较大。研究经验表明,对于蛋白、肽和氨基酸等两性样品,采用酸性(pH为2)或碱性(pH>9)分离条件比较容易得到好的分离结果。
等电聚焦毛细管电泳需要构建pH梯度,所以电泳时正极和负极的缓冲液不同,毛细管中的介质也和电极槽的不完全一样。分离之前,毛细管中通常先灌入含有样品和两性电解质的分离样液:正极电极槽灌入酸性溶液,负极灌入碱性溶液。当加上电压后,管内很快就会在两性电解质作用下建立pH梯度,样品按照等电点迁移到各自的位置上。在毛细管等电聚焦电泳中,正极溶液通常是20~50mmol/L的磷酸,负极溶液是10~50mmol/L的NaOH,两性电解质和传统的等电聚焦相同。两性电解质通常选择pH为3~9者,但如果选用更窄的pH梯度试剂则可获得更精细的分离结果。

图14-3 纯化的cm-SOD的毛细管区带电泳分析
R-cm-SOD为重组的Cu,Zn-SOD;N-cm-SOD为天然的Cu,Zn-SOD。
(2)操作方法。
毛细管电泳技术经过几十年的发展,已经能够利用商品仪器实现自动化分析,因此在此不做进一步详细介绍。
(3)应用举例。
袁勤生等用Beckman P/ACE MDQ电泳仪鉴定Cu,Zn-SOD的纯度。分析条件:二极管阵列检测器;50μmID×40cm毛细管。使用之前,毛细管用0.1mol/L HCl、水和操作缓冲液分别冲洗10min。操作缓冲液为柠檬酸盐缓冲液,pH为3.0。每次进样前,用操作缓冲液冲洗毛细管5min。分离电压为20kV,温度25℃,检测波长214nm,样品浓度为1mg/mL。分析结果如图14-3所示。经计算,纯化后的R-cm-SOD纯度为94.2(±1.0)%。
14.2.1.4 免疫电泳法
利用抗原抗体间的免疫反应也可检测到酶的纯度,常用的有免疫扩散和免疫电泳法,这两种方法都应预先准备好被测酶蛋白的抗血清。对于免疫扩散法,通常将纯化制得的酶样品和抗血清分别加到琼脂糖凝胶板上的小孔中,让其自由扩散,通过观察抗原-抗体间形成的沉淀弧的数量和形状来分析酶的纯度(见图14-4)。
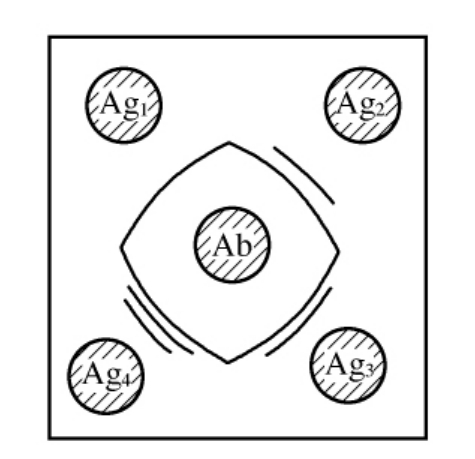
图14-4 琼脂免疫双扩散法检验酶的性质示意图
Ab—抗血清;Ag1~4—不同纯度的酶样品
免疫电泳是将酶样品经电泳分离后,再将抗血清加到抗体槽中进行双向扩散,使其产生沉淀弧。免疫电泳由于利用扩散和电泳两种方法将不同抗原组分一一分开,故其灵敏度比单纯的免疫扩散法要高得多。不同纯度的酶样品经多步纯化后,酶蛋白中的杂质比例一般都很低,有时用一般方法可能无法分析,这时若改用测定样品中有关污染酶活性可能比分析杂质蛋白本身的存在与否更容易一些。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















