项目二 人工育种的主要途径
一、菌种选育的意义
食用菌生产中的“种子”即菌种,其质量的好坏直接影响栽培的成败和产量的高低,只有优良的菌种才能获得高产和优质的产品,因此选育生产优良的菌种是食用菌栽培的一个极其重要的环节。
食用菌的菌种选育在生产上有重要意义:①好种结好果,好菌种出好菇;②技能技巧多,技术含量高;③生产周期短,资金回收快;④菌种价格高,经济效益好。
二、菌种分离的常用方法
将有价值的子实体的局部组织、孢子或基内菌丝移接到斜面试管培养基上,获得纯培养菌丝的操作称为菌种分离。分离对象应从当地当家品种,或从外地引进并经大面积栽培后表现出高产、稳产的菌株中选择。种菇要求选用菇形理想、长势健壮、无虫无病的子实体。
经过分离纯化,初步筛选,淘汰大部分表现一般的菌株。经初筛后再做出菇试验比较,选出优良菌株。
菌种分离法可以分为组织分离法、孢子分离法和基质分离法三种。
组织分离法是最常用的方法,孢子分离法较为烦琐,基质分离法不常用。
(一)组织分离法
1.概念
组织分离法是将食用菌的部分组织移接到斜面培养基上获得纯培养的方法。
常用于分离的部分组织包括:子实体或菌核、菌索的任何一部分组织。
2.特点
组织分离属于无性繁殖,能保持原有菌株的优良种性。组织分离法简单易行,适用于所有伞菌及猴头菇。若种菇感染病毒,需多次分离纯化才能脱毒。
3.常用的组织分离法
(1)子实体组织分离法:它是采用子实体的任何一部分(如菌盖、菌柄、菌褶、菌肉)进行组织培养,而形成菌丝体的方法。尽管子实体的任何一部分都能分离培养出菌种,但是多年的实践经验表明,选用菌柄和菌褶交接处的菌肉最好。
子实体组织分离的步骤包括:种菇选择→种菇消毒→切块接种→培养纯化→出菇试验→母种。
具体的操作过程(以伞菌类为例)如下。
①种菇选择:选择头潮菇、外观典型、大小适中、菌肉肥厚、颜色正常、尚未散孢、无病虫害、长至七八分成熟的优质单朵菇做种菇。
②种菇消毒:用0.1%升汞溶液或75%酒精浸泡或擦拭,无菌水冲洗,再吸干表面的水分。
③切块接种:将分离种菇沿柄中心纵向掰成两半,用解剖刀在菇盖柄交接处划成游离的0.5cm2的田字形小块,取黄豆大一小块菌肉组织,快速接在斜面培养基上。
④培养纯化:在适宜温度下(25℃左右),培养2~4天,长出白色绒毛状菌丝体,当菌丝延伸到基质上后,用接种针挑取菌丝顶端部分,接种到新的斜面培养基上,长满管后即为母种。
(2)菌核组织分离法:它是从食用菌菌核分离培养获得纯菌丝的一种方法。如猪苓、茯苓、雷丸等食用兼药用菌采用此法。进行组织分离时,采用含浆汁多的菌核,在无菌的条件之下,将菌核剖开,于菌核的附近,剖取蚕豆大小的菌核组织块移入斜面培养基上,在26~30℃下培养,待菌丝长满斜面即为母种。
(3)菌索组织分离法:它是从食用菌菌索分离培养得到纯菌丝的方法。如蜜环菌、假蜜环菌等食用菌采用此法。将菌索表面消毒处理后,切取黄豆大小的菌索组织块移入斜面培养基上,在该菌适宜温度下培养。待菌丝长满斜面,挑选健壮无杂菌的作为母种。
(二)孢子分离法
1.概念
孢子分离法是利用子实体产生的成熟有性孢子分离培养获得纯菌种的方法。
2.特点
(1)属于有性繁殖,后代易发生变异,可用此法培育出“杂种优势”新品种。
(2)分离过程较复杂,适用于胶质菌类和小型伞菌。
3.操作过程
种菇选择→种菇消毒→采集孢子→接种→培养→挑菌落→纯化菌种→母种。
4.常用的几种分离方法
(1)单孢子分离法。
所谓单孢分离,即从收集到的多孢子中将单个孢子分离出来,分别培养,作为育种的材料。
①划线培养法:用已蘸无菌水的接种针,从孢子印上沾取孢子,在无菌条件下,插入盛用无菌水的小试管内振荡稀释成适宜浓度的孢子悬浊液。随后在无菌条件下划线培养。用于杂交,选育新的优质菌种。
②平板浓度梯度稀释法:用同样的方法制成浓度较高的孢子悬浊液。同时取灭菌过的空试管数根,排序编号。按无菌操作规程获得一系列的不同浓度梯度的孢子悬浮液。再用毛细管在各个梯度孢子悬浮液中取样培养,单孢萌发后菌丝便长入小培养基块中,再将其转移到试管斜面上培养,获得单孢培养物。
(2)孢子印分离法。
取成熟子实体经表面消毒后,切去菌柄,将菌褶向下放置于灭过菌的有色纸上,外加消毒的玻璃钟罩做成无菌孢子收集器,在20~24℃静置1~2天,大量孢子落下形成孢子印,然后无菌操作移取少量孢子在试管培养基上培养,获得孢子萌发的菌丝体,从而进行多孢分离或单孢分离。
(3)孢子弹射分离法。
①钩悬法:在无菌操作的条件下,剪取一小块新鲜的菌褶组织或耳片组织,悬挂或钩吊在盛有培养基的三角瓶的棉花塞下方(见图7-1),或贴于培养皿的上盖内倒扣在盛有培养基的凹盘上,放在25℃温箱中或室温下,2~3天后,组织块上的担孢子会弹射到下面的培养基表面,萌发后形成菌丝菌落,再挑取分离培养。
②支撑法:这是用整朵成熟食用菌收集孢子,培养萌发成菌丝体而得到菌种的方法。在无菌操作的条件下,利用大三角瓶或玻璃钟罩做成无菌孢子收集器,取整朵成熟新鲜的菇体或耳体,菌褶向下放在支撑架上,再放入盛有固体培养基的无菌孢子收集器中,放在适宜温度(25℃左右)或室温下,2~3天后,菇体或耳体上的担孢子会弹射到下面的培养基表面,萌发后形成菌丝菌落,再挑取分离培养(见图7-2)。
(三)基质分离法
1.概念
基质分离法(菇木分离法)是从生长子实体的基质(段木或土壤)中分离菌丝获得纯培养的方法。
2.操作流程
菇木选择→菇木消毒→切块接种→培养纯化→母种。
下面以木腐菌基质分离为例,介绍分离操作步骤。
(1)把分离用菇木的部分或全部的表面在火焰上轻燎。
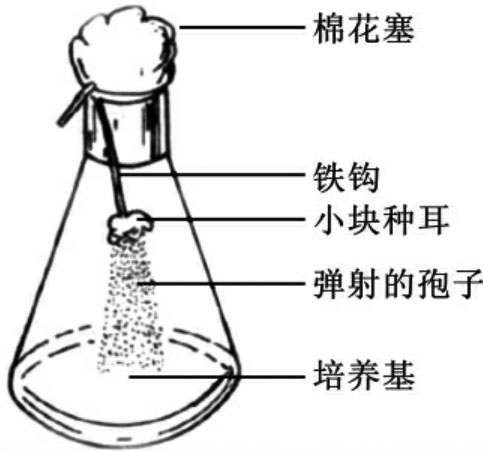
图7-1 钩悬法收集孢子
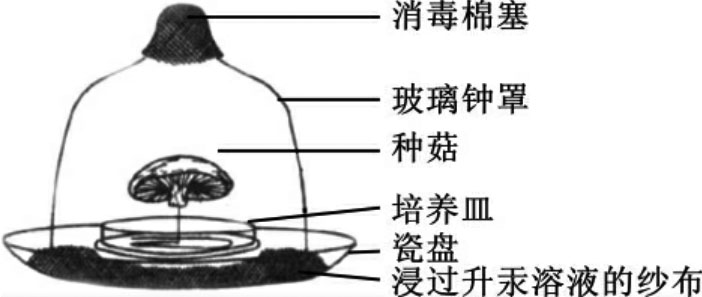
图7-2 支撑法收集孢子
(2)取小刀在火焰上灭菌,对准菇木上菇柄(耳基)的着生位置切成两半。
(3)确定欲分离菌丝在菇木上的位置,再次用火焰灭菌过的小刀在欲分离部位刻划数个井字形游离小块(木屑状)。
(4)用火焰灭过菌的接种钩钩取1~2小块木屑(绿豆大小或更小),移接于斜面培养基。
(5)接种后将试管在25~27℃下培养,促使其恢复。近风干的种木内菌丝常处于休眠状态。接种后,种木吸湿,菌丝逐渐恢复生长。如果短期内分离物未增发,则可保留至4周后,再断定分离是否成功。
3.特点与适用情况
基质分离法污染率高。
基质分离法适用于以下情况:①子实体已腐烂,但又必须保留该种菌种;②有些子实体小而薄,用组织分离法和孢子分离法较困难;③还有一些菌类如银耳菌丝,只有与香灰菌丝生长在一起才能产生子实体,如果要同时得到这两种菌丝的混合种,也只能采用基质分离法进行分离。
(四)菌种分离提纯,控制杂菌污染的方法
(1)利用选择性培养基。
①抗霉菌培养基:涕必灵(TBZ)、克霉灵或多菌灵(MBC)培养基。在普通培养基中加入一定浓度抗霉菌菌素,抑制霉菌生长。
②抗细菌培养基:在普通培养基中加入一定浓度抗菌素,如四环素、氯霉素、链霉素、金霉素等,从而控制细菌污染。
(2)菌丝尖端分离,排除病毒、细菌性污染。
利用某些大型真菌在温度较低(20~25℃)时,菌丝生长比细菌要快的特点,用接种针切割菌丝的前端,接种到斜面培养基上(无冷凝水、硬度高),连续操作2~3次,就能获得纯菌丝。
三、人工育种的五大途径
为了使食用菌达到高产、优质、抗逆性强、适应性强以及满足某些特殊要求的育种目的,在食用菌育种中,人们采取了人工选择育种、诱变育种及杂交育种等常规手段,以及原生质体融合、基因工程等新的育种手段。
(一)人工选择育种
人工选择育种是将自然界的优良品种选育出来,保留纯种品系,并进一步繁衍的育种方法。
人工选择育种是目前获得新菌种的一种最常用的方法,其实质是广泛搜集品种资源,积累和利用在自然条件下发生的有益变异。这样通过长期的去劣存优的选择作用,不断淘汰那些不符合人类需要的菌株,保留那些符合人类需要的菌株,就可逐步形成符合人类需要的新的菌株。
1.人工选择育种的操作流程
品种资源的收集→纯种分离→生理性能的测定→菌株比较试验→扩大试验→示范推广。
2.操作步骤简介
(1)品种资源的收集:从自然界现有菌株中选择培育新品种,首先要收集大量的品种资源,以便“优中选优”。目前我国有许多优良品种均是由此方法获得的。如“北京猴头菌1号”新菌株,具有转潮快、朵大、肉实等优点;耐低温型草菇菌株“V20”,子实体分化发育温度比一般草菇低3~4℃,对外界适应性强,日平均气温为22℃时子实体能正常分化发育,使草菇的栽培范围扩大,延长种植季节,提高经济效益;黑木耳“新科”,现已成为浙江、安徽、河南、江西、湖北等地区的黑木耳主栽品种。
(2)纯种分离:对收集的品种资源进行菌种分离。如上述介绍的孢子分离、组织分离或基质分离三种方法,选用其中简便、快捷的方法进行操作。
(3)生理性能的测定:包括菌丝生长速度、吃料能力、菌丝形态特征、生理生态特性、出菇速度、菇体形态特征、产量、质量等,经过检测,尤其是出菇试验进一步测定,如有优良性状,才具有人工选择育种的意义。
(4)菌株比较试验:又称品比试验,即将多个品种在同一条件下培养,比较各菌株的优劣,详细记录各菌株的产量、菇形、温性、干鲜比、始菇期、菇潮间隔、形态等。为了保证试验的准确性,菌种的质量、培养基配方、接种、管理措施等可能影响结果的因素应尽可能一致。试验还应按生物统计原理进行安排。
(5)扩大试验:上述的品种评比结果仅是阶段性的成果,还应和当地的当家菌株同时进行栽培,证实它是更优良的菌株,进行扩大试验。
(6)示范推广:经扩大试验后,确定其有稳定性、重现性,将选出的优良品种放到有代表性的试验点进行示范性生产,待试验结果进一步确定之后,再由点到面逐步扩大规模推广示范。
食用菌多是以菌丝的营养繁殖为主要繁殖方式,一个种的性状是通过菌丝体的繁衍来维持和逐代传递的,所以选择应侧重于在不同菌株间进行而不是在同一菌株的后代中进行。此外,由于人工选择不能改变个体的基因型,而只是积累并利用自然条件下发生的有益变异,所以要使选择育种产生效果,除了细心观察现有品种中产生了明显有益变异的个体外,更主要的是要广泛收集不同地域、不同生态型的菌株,以便从大量菌株中弃劣留优,筛选到适合人们需要的菌株。
(二)诱变育种
诱变育种是指人们有意识地利用物理、化学或生物诱变剂处理生物细胞群体,促使细胞遗传物质发生改变,进而从变异群体中筛选优良品种的过程。
1.诱变育种的操作流程
出发菌株→制备孢子悬浮液→诱变处理→涂布培养皿→挑菌移植→斜面传代→初筛→复筛→试验、示范、推广。
2.诱变剂和诱变机理
能够使DNA分子结构发生改变,提高生物体突变频率的物质称为诱变剂。大多数诱变剂在诱发生物体发生突变的同时还造成生物细胞的大量死亡,因此,诱变剂都是一些剧毒的化学物质,具有致癌致畸的特性。
(1)诱变剂的分类。
诱变剂可分为物理诱变剂、化学诱变剂和生物诱变剂三大类。常见的物理诱变剂有紫外线(UV)、X射线、γ射线、快中子等,其中以紫外线应用最为普遍。化学诱变剂可分为四大类:第一类,脱氨基诱变剂,如亚硝酸、羟胺;第二类,烷化剂类化合物,如氮芥(NM)、乙烯亚胺(EI)、硫酸二乙酯(DES)、甲基磺酸乙酯(EMS)、亚硝基胍(NTG)等;第三类,碱基天然类似物,如5-溴尿嘧啶(5-Bu)、2-氨基嘌呤(AP);第四类,移码诱变剂,如吖啶橙、吖啶黄。生物诱变剂应用得较少,它实际上是一些DNA片段,如转座因子,Is、Tn、Mu。此外还有其他诱变因素,如抗菌素、除草剂、脱氧核糖核酸等。当这些诱变剂渗入生物细胞后,便可作用于遗传物质DNA,改变细胞遗传物质的正常结构。
(2)诱变剂的作用机理。
不同的诱变剂,其作用机理及引起的生物学效应是不同的。诱变剂的作用机理主要有以下几类。
①碱基置换。
碱基置换即DNA分子中的一对碱基被另一对碱基所置换。如原来是AT,突变后变为GT。一对碱基被改变称为点突变,多对碱基被改变称为多点突变。点突变对DNA来说属微小损伤。能引起碱基对置换的诱变剂主要有亚硝酸、羟胺、硫酸二乙酯、甲基磺酸乙酯、亚硝酸胍、乙烯亚胺、氮芥等。如亚硝酸作用的机理主要是脱去碱基分子中的氨基,使腺嘌呤(A)脱去氨基后变成次黄嘌呤(H),胞嘧啶(C)变成尿嘧啶(U),鸟嘌呤(G)变成黄嘌呤(X)。生物细胞经亚硝酸处理后,在DNA复制时,脱去氨基变成次黄嘌呤的腺嘌呤不能按原来的配对原则与胸腺嘧啶(T)配对,而只能与胞嘧啶(C)配对,同理,胞嘧啶脱去氨基转变成尿嘧啶,不能与鸟嘌呤配对,只能与腺嘌呤配对,结果便造成AT→HC→GC和GC→UA→TA的碱基对转换,从而引起遗传信息的错误而造成突变。此外,碱基类似物也能引起碱基对的转换,但与上述相比,它不是直接作用于碱基使碱基改变,而是通过代谢渗入DNA分子中,当DNA再次复制时间接引起碱基对转换。
②移码突变。
移码突变也属于DNA分子的微小损伤。它是指DNA链上失去或增加一个或几个碱基造成的mRNA的译框的改变,无论前译或后译,所翻译出的蛋白质都会出现错误(见表7-3)。
表7-3 移码突变对比
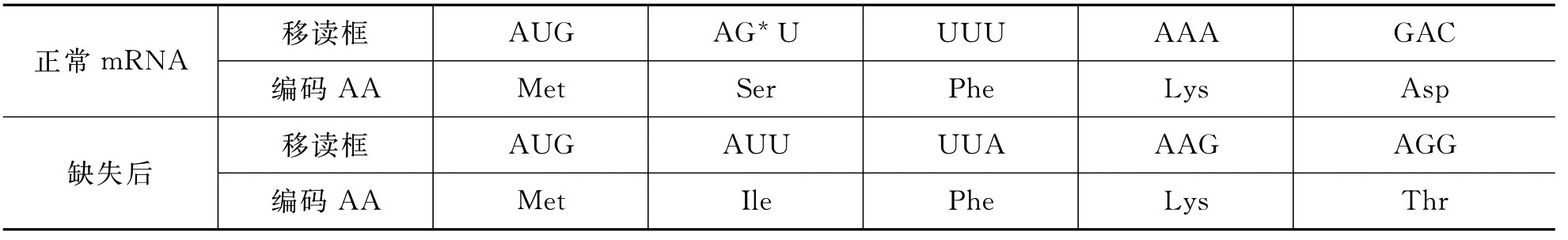
在发生移码突变时,如果加进一个碱基又失去一个碱基,则密码子可恢复正常。如果加进或缺失3个或3个的倍数,则只会打乱一小段码组,其余的仍为正常的密码子。造成移码突变的诱变剂主要是一些吖啶类物质,如吖啶黄、吖啶橙、2-氨基吖啶等。这类化合物的分子结构为平面三环结构,与核酸中的碱基很相似,能插入DNA两相邻碱基对之间,使DNA链拉长,原来两碱基对距离为0.34nm,当加入一个吖啶类化合物后则变为0.68nm。吖啶类化合物的插入造成DNA碱基对上碱基的添加或缺失,在DNA复制时,突变点以下的三联体密码子改变而发生突变。生物诱变剂本身就是一段DNA,插入后也能引起移码突变。
③染色体畸变。
某些强烈的诱变因子(如X射线、亚硝酸等)除了引起点突变以外,还会产生DNA分子的大损伤,导致染色体数目的变化及结构的改变。染色体结构改变有以下几种类型:a.缺失,即染色体某一段丢失;b.重复,即染色体某一段出现重复;c.倒位,即染色体某一段正常顺序发生颠倒;d.易位,即一条染色体的片断搭接到另一条同源染色体上去。每种生物的每个细胞都有一定数目的染色体,各个染色体的形状也是恒定的。所以如果它们的数目和结构改变了,就会出现可遗传的变异。各种诱变剂虽然作用机理不同,但大多有多种功能。如甲基磺酸乙酯,既能诱发碱基对的转换,又能诱发染色体的畸变。紫外线作用于DNA可引起DNA链的断裂、DNA分子内和分子间的交链、核酸和蛋白质的交链、胞嘧啶的水合作用以及胸腺嘧啶形成二聚体等。诱变剂对DNA造成损伤的程度取决于诱变剂量。
从上述诱变剂作用机理看,诱变剂渗入细胞后,接触生物体的遗传物质而使其发生改变。但对生物体来说,它们也有对DNA损伤的修复作用。因此,诱变剂所造成的DNA分子某一位置的结构改变通常称为前突变,这一突变可以通过DNA分子修复而成为真正的突变,也可通过修复变为原结构并不发生突变。常见的一种修复作用就是光复活作用。生物体细胞受损伤后能产生光复合酶,该酶能与受伤的DNA结合,行使核酸内切酶作用,切除突变部分,以另一链为母链重新合成DNA。该酶在黑暗的条件下无活性,光照条件下能激活光复合酶。所以对诱变材料进行诱变处理时,须在暗室红光下进行,处理后还要用黑纸包严,以提高突变概率,防止光修复作用。生物体的修复系统还有许多,如暗室修复、重组修复、SOS修复等。
3.基因突变的规律
整个生物界,由于它们的遗传物质相同,因此,基因突变都遵循着相同的规律。
(1)突变的方向与生物所处的环境不对应。例如抗药性突变并非因接触药物而引起。任何一种诱变剂都能诱发任何一种突变型,要想得到特定表型效应的突变,是靠不同的筛选方法实现的。
(2)突变是随机发生的。即突变发生的时间及个体都具有随机性,如图7-3所示。
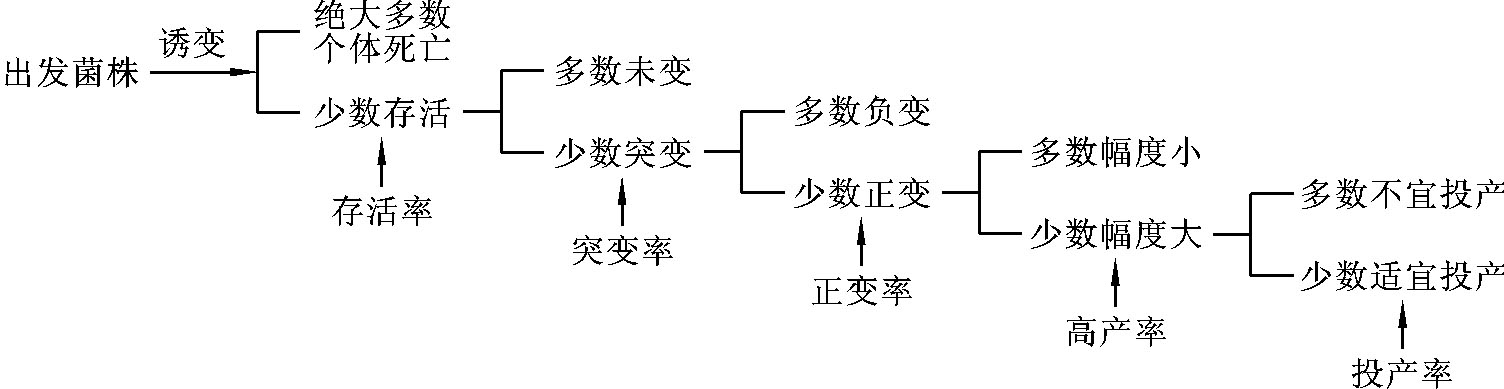
图7-3 诱变与突变概率示意图
(3)突变仅以很低的概率出现于生物体中。
(4)突变发生后,可以一定的概率发生回复突变,恢复原有性状。
可见,设计和采用效率高的筛选方案和方法极其重要。
4.诱变育种中应注意的几个方面
(1)诱变剂的选择。
诱变剂选择的依据主要是根据实际操作的方便程度和已成功的经验尽可能地选择简便有效的诱变剂。同时在了解诱变剂作用机理的基础上,可考虑诱变剂复合使用。因为不同诱变剂对DNA分子作用的“热点”(DNA分子易发生突变的位点)不同。复合使用可防止因一种诱变剂多次使用而产生“热点”饱和。如紫外线主要作用在DNA分子中的嘧啶上,而亚硝酸则主要作用在DNA的嘌呤上,紫外线和亚硝酸复合作用,使突变谱变宽,提高诱变效果。
用于诱变育种的诱变剂种类很多,但各种诱变剂对食用菌诱变效果不同,对诱发某一特点性状的概率不同,应根据具体菇类使用。紫外线具有不需特殊设备、成本低、对人体损害作用易于防止等优点,诱变效果也较好,是目前最常见的物理诱变因素之一。
(2)诱变剂量的选择。
要选用最适的诱变剂量。剂量的大小一般是以诱变后的杀菌率来确定的。剂量大则细胞死亡率大,剂量小则相反。剂量大小的确定应以能够提高正变株变异概率为最适剂量。正变是指诱变处理后,其机体的某个或某一些生物活性有明显增加,负变则是有明显减弱,甚至丧失。近年来,根据对紫外线、X射线、激光和乙烯亚胺等诱变剂的研究,发现正变多出现在偏低的剂量中,而负变则往往出现在偏高的剂量中。因此,目前都倾向于采用较低诱变剂量来处理。如紫外线过去选用杀菌率为99.9%的剂量,而近年来采用的杀菌率为30%~70%。由于每种诱变材料的最佳剂量差异很大,故在选择合适的剂量时,必须通过大量的预备试验才能找出。一般认为,如果菌株不很稳定,要求其稳定地提高产量或改变品质,宜用缓和一些的因子,剂量低一些为好。如果出发菌株比较稳定,又要求突变幅度大,则应考虑诱变能力强的诱变剂和高的诱变剂量,使其遗传物质受到强烈的冲击而发生大的改变。化学诱变剂的剂量通常通过溶液的浓度(0.01~1mol/L)、作用时间和处理温度来控制。使用的浓度越高,杀菌率越高。物理诱变剂中常用的是紫外线,紫外线的绝对剂量单位是erg/cm2,但不易掌握和计量,紫外线的剂量大小取决于灯管的功率、灯和被照射物之间的距离及照射的时间。若灯管的功率、照射距离固定,那么剂量就和照射的时间成正比,也就可以用照射时间作为相对剂量。在具体操作中,常用15W波长为253.7nm的紫外灯管,照射距离控制在30cm以内。
紫外线诱变现在倾向于采用杀菌率70%~75%甚至更低的剂量,一般在30%左右。人工诱变可以提高突变概率,能够创造自然界原来没有的性状,且操作简单,周期短,因而受到食用菌研究者的普遍重视。近年来,食用菌育种发展较快,我国利用诱发突变已选育出平菇、香菇、木耳、猴头菇、双孢蘑菇、金针菇等食用菌的新品种。
(3)选择出发菌株。
出发菌株的选择直接影响诱变结果,出发菌株就是用于诱变的原始菌株,选好出发菌株有助于提高育种效果。实践证明,选择已在生产上应用过的、发生了自然变异的菌株,具有生长速度快、营养要求低、出菇早、适应性强等有利性状的菌株,对诱变因素较为敏感的菌株等,往往能收到较好的效果。
(4)诱变材料的选择。
为使每个细胞均匀接触诱变剂,达到较好的诱变效果,用于诱变的材料应呈单细胞分散状态,这样不仅可以使细胞均匀地接触诱变剂,还避免了多细胞体系中,正常细胞对遗传基因已发生突变细胞的掩蔽作用。
不同食用菌的生活史有差异,在诱变材料选择和育种程序上也有差异。草菇是初级同宗配合的食用菌,由担孢子萌发而来的单核菌丝具结实性。因此,可直接处理担孢子,并能直接筛选那些符合育种目标的菌株。对于异宗配合的担子菌,如香菇、平菇等,以它们的担孢子为诱变材料时,单核菌丝不能结实,不能直接进行菌种选育,还必须通过杂交才能产生结实性菌丝。也就是说,诱变的直接产物是杂交育种的材料。
去壁的原生质体不仅呈单细胞分散状态,而且除去了细胞壁的阻挡,诱变剂更容易接触细胞内的DNA,若处理由双核菌丝体制备的原生质体,它的再生菌株可直接进行菌种的筛选,大大地简化了异宗配合食用菌诱变育种的程序。
诱变材料的生理状态与诱变效应密切相关。各种诱变剂对菌株的诱变效应虽然不尽相同,但有一点是共同的,即诱变剂对DNA处于转录状态或翻译状态的效应要比处于静止状态或休眠状态敏感得多。要使待处理的诱变材料达到转录或翻译的生理状态,对于担孢子,应考虑采用预培养担孢子促其萌发;对于原生质体,应采用幼嫩、处于对数生长期的菌丝体作为制备原生质体的材料。
(5)影响诱变效果的外部条件。
诱变剂的诱变效应同样受到培养条件、pH值、氧气、可见光等外部条件的影响。光对诱变后的影响前面已谈到。在用亚硝基胍(NTG)进行诱变处理时,不能用中性条件,而应用酸性或碱性条件,因为NTG在中性条件下的诱变效应很弱。在用碱基类似物进行诱变处理时,必须创造天然碱基贫乏的环境,因此,平板培养基中不应含有机氮源等富含天然碱基的成分,而应用合成培养基添加碱基类似物来培养,以迫使菌种在生长过程中为了合成DNA的需要而错误地吸收碱基类似物,同时,也可以用孢子进行饥饿萌发处理。
(三)杂交育种
杂交是一种遗传物质在细胞水平上的重组过程。由于食用菌能产生有性孢子,因此原则上都可以像高等植物那样通过有性杂交育种,从而获得综合双亲优良性状的新品种。
1.食用菌杂交育种的特点
食用菌杂交育种的特点包括:①单核菌丝是基因重组的产物,具有丰富的基因型,但单核菌丝的表型性状非常少,因此,用以杂交的单核菌丝不能太少,否则会漏掉携带优良基因的单核菌丝;②单核菌丝可独立地进行无性繁殖,作为育种材料进行保存,可大大减少工作量,缩短育种程序;③食用菌单核菌丝的配对杂交在室内进行,杂交育种不受时间限制;④一旦从杂交子中筛选到具结实性,且各方面表现优良的菌株,便可通过无性繁殖保持菌株的优良特性,无须年年制种。
2.食用菌杂种优势的形成
杂种优势是生物界普遍存在的现象,表现为杂种一代在生长势、生活力、抗逆性、产量和品质上明显超过双亲。杂种优势并不是某一两个性状单独表现突出,而是许多性状综合表现突出。在栽培菇类中,杂种优势通常表现为菌丝生长旺盛、出菇较早、菇体较大、菌盖较厚、菇峰整齐等。杂种优势的大小与以下因素有关。
(1)取决于双亲性状间差异性的大小和互补性。实践证明,在一定范围内,双亲间的亲缘关系、生态类型和生理特性差异越大,双亲间相对性状的优缺点越能彼此互补,杂种优势就越强。因此要进行杂交育种,必须广泛搜集遗传资源,以期得到相对性状差异较大、种质基因丰富的杂交亲本。我国幅员辽阔,食用菌品种资源异常丰富,为杂交育种提供了坚实的物质基础。
(2)杂种优势的大小与双亲基因型纯合程度有关。双亲基因型纯合程度越高,F1代基因型杂合化程度也越高,杂种优势就越大。
(3)杂种优势的大小与环境条件的作用也有密切关系。性状的表现是基因型与环境条件综合作用的结果,不同的环境条件对杂种优势表现的强度有很大影响。在杂交育种中,并非有杂交就有杂种优势,其实杂交子一代有的是集双亲优良基因并能表现出杂种优势,有的则不表现杂种优势。因此,杂交子能否作为品种来推广,还需进一步选择。
3.杂交育种的操作流程
选择亲本→单孢分离→单孢菌丝培养与选择→孢子单核菌丝配对→将可亲和的组合转管繁殖→杂交菌株初筛→杂交菌株复筛→试验、示范、推广。
(1)亲本选配。
在杂交育种中,亲本选配是杂种后代出现理想性状组合的关键。长期以来,人们在育种实践中,往往根据地理差异、表现型差异、生境差异来选配亲本。这种选配亲本的方法不能科学地预测杂种优势的大小,带有较大的盲目性。20世纪70年代以来,国外在高等植物的杂交育种中,应用多元分析法测定若干与产量有关的数量性状的遗传距离,进而预测杂种优势,选配强优组合,取得了显著成果。近年来,国内外食用菌工作者也开展了菇类的遗传距离分析。选择亲本应遵守如下原则。
①至少亲本之一有较好的产量。一般高产种与高产种杂交,所得菌种的产量也较高。
②所选亲本优点多,缺点少,亲本间优缺点可以互补。例如某一高产菌株质量欠佳,而另一菌株产量不够理想,但质量性状突出,这样的两个菌株杂交往往能够获得综合两者优良性状的杂交种。在这一组合中,高产的菌株是要改造的对象,优质的菌株则是要引入性状的介体。这两个亲本除了性状能互补外,任何一方劣性的性状都不能太多,集中力量解决一两个主要矛盾。
③在亲缘关系较远、生态环境差异大的菌株间杂交,后代中更容易出现超越亲本的优良性状,成为进一步选育的宝贵材料。
④用当地菌株与外来菌株杂交时,应选当地适应强的菌株。
(2)单孢分离。
首先采集获得纯净无污染担孢子,进一步进行单孢分离,获得同核菌丝体。单孢分离的方法有稀释平板分离法、单孢挑取法等。稀释平板分离法较为常用,步骤如下:配制孢子悬浮液→稀释至300~500个/毫升→取0.1mL涂布平板→培养→挑取单核菌丝。
当担孢子萌发并长出肉眼可见的单菌落时,就应及时挑取至斜面培养基上,避免两种单核菌丝因相距太近而杂交。挑取时应注意,对那些萌发较迟、生长缓慢的单菌落也应保留,它并不影响杂交后形成的双核菌丝的生长速度。无锁状联合是单核菌丝鉴定常用的标准,除此之外,单核菌丝的生长速度一般比双核菌丝慢且长势弱。
除了从分离担孢子获得单核菌丝外,还可利用原生质体技术,以双核菌丝为原料获得单核菌丝。该单核菌丝非亲本重组的产物,它的遗传组成与亲本异核细胞中的一种细胞核相同。
(3)配对杂交。
杂交是可亲和的单核菌丝体双核化的过程。在食用菌的杂交育种中,通常采用单核菌丝体间配对杂交,即单×单杂交。把欲杂交的同核菌丝体两两对峙培养,经过一段时间的培养,凡可亲和的两单核菌丝间便发生质配,形成双核菌丝。双核菌丝在两菌落交界处旺盛生长,并迅速生长形成扇形杂交区。把这种双核菌丝挑取出来进一步纯化培养,就得到了杂种菌丝。
除了以单核菌丝为材料进行单×单杂交外,单核菌丝体也可以单方面地接受双核菌丝体中与之配对的核完成双核化,这就是所谓的布勒现象,也称为布勒杂交或单双杂交。日本学者Mori等以香菇为试验材料,在固体培养基上首先接种单核菌丝体,一周后在单核菌丝体的外围接种双核菌丝体,三周后在单核菌丝体的放射状的边缘可找到新的杂合异核菌丝体。他们用日本5个香菇栽培种的单核菌丝与我国台湾及新几内亚的野生香菇菌株的双核菌丝杂交,均取得成功。在单×双交配中,亲本之一为双核菌丝体,可省去再进行单孢分离的过程。另外,与单×单杂交相比,单×双杂交可减少杂交配对的数量,加快育种过程。虽然布勒现象可以作为一种杂交育种的手段,但它不能完全代替常规杂交。因为从担子菌遗传的角度看,一个双核体基本上只有两种不同遗传型的核,用同一单核体与之进行布勒杂交时,最多也只能获得两种不同类型的杂种双核体。因此,杂交子基因型的多样性不如单×单杂交。
(4)杂交子的鉴定与筛选。
异宗配合的食用菌,杂交子应为双核菌丝体,凡双核菌丝具有锁状联合的种类,其杂交后代也应具有锁状联合,可作为鉴别标准。当然,对杂交子进行进一步的出菇试验就更能说明问题,还可作为初筛去劣的依据。
目前,杂交育种多在有性生殖为异宗配合的食用菌中开展,对于有性生殖为同宗配合的食用菌,杂交育种也是一个有效的途径,但困难较大,双孢蘑菇就是一例。双孢蘑菇属次级同宗配合的食用菌,它的担孢子中有含两个交配型的核,属自交可孕型,占76%~80%;也有含一个交配型的核,属杂交可孕型,占20%~24%,双孢蘑菇的杂交育种就在这类担孢子萌发的单核菌丝间进行。
在杂交育种的过程中,为了判断杂种的真实性,亲代必须有标记。异宗配合的品种,由于自交不孕,因此亲本的性别本身可作为标记,但对于同宗配合的品种,由于自交可孕,因此必须对亲本加以特殊标记,例如营养缺陷型突变、抗药性突变等。也可通过同工酶差异鉴定是否产生新菌株。另外,杂交优势来源于亲本,取决于亲本的相对差异和互补能力,因此,亲本选择非常重要。希望杂交种的重要性状上有优良表现,很难通过一次杂交就圆满实现,因此可以通过回交,在一次杂交的基础上,继续改进品种性状,同时要考虑到杂种的性状表现是基因和环境综合作用的结果。下面以香菇为例说明单孢杂交育种。香菇是典型的四极性异宗配合菌类,异宗配合指自身不孕,需由不同交配型的单核菌丝杂交完成性生活史。香菇担子上有四个担孢子,通过交配反应,确定孢子的极性后,用可亲和性菌丝共同培养,菌丝接触后,分别从两方取菌丝体移入另一试管。这是因为经过杂交,虽然双方都双核化了,但细胞质是有区别的,因此杂交后代的表现型也是有区别的,应对这两个双核菌株分别比较,全部考核生长性状和出菇能力,最后挑选性状良好的菌株用于生产。以上是指种内杂交而言,种间杂交则几乎所有的单孢菌株都是可亲和的。
(四)原生质体融合育种
原生质体融合育种技术是通过脱壁后不同遗传类型的原生质体在融合剂的诱导下进行细胞融合而达到整套基因组的交换和重组,产生新的品种和类型。
1.原生质体融合育种流程
原生质体的制备→遗传标记→原生质体融合→再生培养基上再生→被假定为异核体的融合产物通过营养互补作用而发育→杂交子间及与亲本间的拮抗试验→杂交株与亲本株的酯酶同工酶分析。
20世纪50年代末期,从真菌中分离原生质体获得成功,从20世纪60年代起即进入了真菌的原生质体时代。现在,真菌的原生质体分离已成为一项常规的、程序化的技术,原生质体的应用也日益广泛。
2.食用菌原生质体的基本特点
和动物细胞不同,食用菌细胞外面包着一层坚硬的细胞壁。这一道天然的“屏障”阻挡着食用菌细胞间的彼此融合,并给各种遗传操作带来极大困难。游离的原生质体是真正的单细胞,在同一时间内能得到大量的遗传上同质的原生质体,为遗传学研究及用原生质体为材料开展食用菌育种提供了可能性。它与组成菌丝的细胞相比具有以下几个特点:①原生质体超越了性细胞的一些不亲和障碍,为种内、种间、属间食用菌细胞杂交提供了融合的亲本;②原生质体能有效地摄取多种外源遗传颗粒,如DNA质粒、病毒和其他细胞器,因此,在食用菌基因工程研究及基因工程育种方面具有重要作用;③游离的原生质体除去了细胞壁的阻挡,诱变剂更容易进入细胞,是良好的诱变育种的材料。此外,食用菌原生质体也和食用菌完整细胞一样具有该菌株的全部遗传信息,在合适的培养条件下,能发育成与其亲本相似的菌株。
从食用菌菌丝中分离出有活性的原生质体,经再生后发育成菌落,这种方式称为原生质体无性繁殖。食用菌原生质体无性繁殖过程也是细胞水平的筛选过程,可直接从食用菌原生质体无性繁殖后代中筛选突变菌株进行品种选育。
3.获得原生质体的材料
能够制备原生质体的材料很多,如各种类型的有性和无性孢子、单核菌丝、双核菌丝和不同发育时期的子实体组织均能获得食用菌的原生质体。但由于材料的结构、性质不同,酶解处理后获得原生质体的数量差异很大。如担孢子具有较厚的细胞壁且成分复杂不易酶解,子实体组织不易分散,不能全面接触溶壁酶,而且组织化的菌丝细胞壁也较厚,不利于原生质体的释放,目前主要用幼龄菌丝体制备原生质体。
从菌丝体制备原生质体主要有以下两个优点:①培养时间短,菌丝体生长均匀一致,进而从菌丝体中释放的原生质体在生理和遗传特性上比较一致;②该材料在液体酶液中易分散,适宜当前用酶解的方法分离原生质体。由于不同食用菌菌丝生长速度不同,获取幼龄菌丝体的时间也不同。如草菇一般需要2~3天,平菇需要3~4天,香菇需要5~6天,双孢蘑菇需要7~9天,木耳则需要9~11天。菌丝体培养一般采用液体静置培养法,每瓶放十余粒玻璃珠,培养期间每天用手摇1~3次。
4.原生质体融合育种操作技术
(1)亲本的准备。
原生质体融合需要两株亲本,亲本必须带有遗传标记,两亲本的遗传标记必须各不相同,以便筛选融合子。目前,食用菌融合常用的遗传标记有营养缺陷型标记、抗药性标记、灭活原生质体标记、自然生态标记及形态标记等。营养缺陷型菌株和抗药性菌株的筛选在诱变育种中已介绍过。它们都是由于基因的改变而产生的表现型突变,是比较可靠的遗传标记。灭活原生质体作为标记,在食用菌中采用的也比较多,可采用物理或化学因子来灭活原生质体,使原生质体失去再生能力,仅成为遗传物质的载体,与其他原生质融合。其中化学试剂是较好的灭活因子,它能专一性地抑制原生质体上某些酶的活性,从而影响原生质体的再生能力。在灭活食用菌原生质体时常用的灭活剂有碘代乙酸铵和焦磷酸二乙酯。物理方法灭活原生质体多采用热灭活法。自然生态标记是根据不同种、属之间,甚至种内之间的生态习性差异作为标记。生物由于生长的地理区域和生态环境不同,经长期的进化选择,都形成了独特的对生态和生活环境的适应性,这些适应性具有明显的特殊种性。如香菇中的豹皮香菇、虎皮香菇和近裸香菇,由于它们起源于热带和亚热带,对高温有较强的抵抗性,菌丝体能在32~37℃的高温范围内正常生长,而栽培香菇在这个温度范围内生长很缓慢或停止生长,这些生态习性的差异可被用来作为亲本菌株的遗传标记。
(2)原生质体的分离和纯化。
①菌丝体的收集与洗涤:液体培养后通过离心或过滤收集幼龄菌丝体,然后用无菌水和渗透稳定剂(0.6mol/L的MgSO4溶液)分别冲洗菌丝体,用无菌吸水纸吸干多余的水分后备用。
②酶解处理:按菌丝体(g)∶酶液(mL)为1∶(2~3),将菌丝体、溶壁酶放入无菌的离心管内,让酶液和菌丝体充分混匀后,在合适的温度下保温酶解。溶壁酶用0.6mol/L的MgSO4溶液配制,保持一定的渗透压,以利于质膜的稳定。酶液需预先经细菌过滤器过滤除菌,过滤膜选用0.2~0.45μm为宜。酶解温度一般为28~35℃,酶解时间一般为4~5h,其间每15min轻轻振荡一次。
③原生质体的纯化:原生质体纯化的目的是除去酶液及酶解剩余的菌丝体片段。首先用纤维类物质(如脱脂棉)过滤除去菌丝残片,滤液经4000r/min离心20min,去掉上清酶液,沉淀用渗透稳定剂(0.5 mol/L蔗糖溶液)离心洗涤2~3次,即得到纯净的原生质体。
(3)原生质体的再生。
原生质体在含有渗透稳定剂的再生培养基上能重新形成细胞壁,并能发育成菌丝体,这称为原生质体的再生。原生质体在固体再生培养基和液体再生培养基上均能再生,为了获得再生单菌落,常采用固体再生培养基。再生培养通常采用双层培养基培养法,底层含琼脂2%,上层含琼脂0.7%。原生质体纯化后,要进行适当的稀释,用血球计数板准确计数每毫升原生质体数,然后根据实际再生菌落数,便可计算出再生率。

为了检查原生质体的纯度,纯化后的原生质体用水做系列稀释,然后涂布到不含渗透稳定剂的一般培养基上。若有再生菌落,说明原生质体脱壁不彻底或有菌丝片段。原生质体再生率与再生培养基成分、培养方法、酶解时间及离心条件有关,一般随着酶解时间的延长,原生质体的释放量增多,但由于酶对原生质体膜的破坏作用,再生率有所下降。酶解时应以达到所需原生质体的数量为宜。较高的离心力及较长时间的离心均可引起原生质体的破裂,一般采用2000~5000r/min、5~10min的离心条件。营养丰富的再生培养基能促进原生质体的再生,提高再生率。适宜原生质体再生的培养基可以查阅相关资料,其中1%大麦芽浸出液、0.4%葡萄糖、0.4%酵母膏、0.4%蛋白胨、0.5mol/L蔗糖就是一个较好的再生培养基配方。研究表明,适当添加细胞壁合成所需的前提物质能提高再生率,例如,添加0.1%的水解酪蛋白、0.03%L-谷氨酸能明显提高再生率。再生培养基的渗透稳定剂也是影响再生的因素,有机物质如蔗糖、甘露醇、山梨糖醇,比无机物如KCl、NaCl、MgSO4要好。渗透稳定剂通常采用0.5mol/L蔗糖溶液。
(4)原生质体融合。
原生质体融合就是把两亲本的原生质体混合在一起,在物理的(电融合)或化学的(聚乙二醇)促融作用下,诱导细胞融合。细胞融合现象最初是在动物细胞中发现的,20世纪50年代,日本学者用灭活的仙台病毒成功地诱导动物细胞融合。随后细胞融合技术逐渐扩展到植物及微生物细胞,融合方法也不断地改进和发展。目前在食用菌原生质体融合中,报道最多的是聚乙二醇(PEG)诱导融合,也有一定数量的电场诱导融合。PEG的相对分子质量随乙二醇聚合数目的不同而不同,在一定范围内,相对分子质量越大,其促融效率越高,但毒性也越大。真菌融合常采用相对分子质量为4000~6000的PEG,动物细胞融合采用相对分子质量为1000的PEG。融合适宜pH值为7.0~7.5,钙离子浓度为0.01~0.05mol/L,PEG的使用浓度为35%,双亲原生质体数量应保证有107个/毫升。
原生质体融合时将两种原生质体悬液等体积混合,5000r/min离心后弃上清液,然后用巴氏吸管使其悬浮,用巴氏吸管滴入1mL PEG,边加入边轻轻摇动,1min内加完,30℃水浴,静置促融10min,离心除去PEG,然后将稀释融合液涂布于再生培养基上进行培养。
(5)重组融合子的检出与鉴定。
重组融合子的检出方法包括直接检出法和间接检出法。①直接检出法:根据亲本菌株的遗传标记,直接筛选出融合子。如果两亲本菌株均为营养缺陷型标记,可将融合液涂布于基本培养基上,直接筛选出融合子。若为抗药性标记,可在补充两种药物的培养基上,筛选出双重抗药性的重组子。②间接检出法:将融合液涂布在营养丰富的再生平板上,使亲本菌株和重组子都能再生,再施加选择因子检出重组子。间接法虽然费时,但它可以克服某些有表型延迟作用的遗传标记因直接选择而产生的干扰作用。
重组融合子拣出后,需对融合子进行进一步的鉴定。融合子的鉴定通常从以下几个方面进行综合分析。①生物学特性分析:锁状联合是食用菌种内杂交子所具有的特征,可以作为种内是否融合成功的一个标志,但作为种间融合子的标志时不完全可靠。融合子菌株与双亲菌株在遗传物质组成上有差异,因此在对峙培养时,能产生拮抗反应,也是常用的鉴定方法。融合子若能形成子实体,可对子实体特征进行鉴定以及对担孢子进行遗传分析。另外,还可对融合子菌丝体进行荧光染色,确认融合子细胞内核的数目。②生化指标分析:主要从氨基酸、DNA含量及同功酶谱等方面进行分析。
5.存在的问题
目前,食用菌原生质体融合存在一些尚待解决的问题,主要有融合子遗传性很不稳定、种间融合子难以形成子实体、融合体难以产生优良性状等。
(五)基因工程育种
1.基因工程育种的意义
基因工程是在基因水平上的遗传操作,它以人为的方法从某一供体生物中提取所需要的基因,在体外条件下用适当的限制性核酸内切酶切割,把它与载体连接起来一并导入受体生物细胞中进行复制和表达,从而选育出新品种。利用基因工程技术可以更方便地对更多基因进行有目的的操纵,打破自然界物种间难以交配的天然屏障,将不同物种的基因按人们的意志重新组合,实现超远缘杂交,培育高产、优质、多抗新品种。基因工程育种是一种前景宽广、正在迅速发展的定向育种新技术。
2.基因工程的操作流程
获取目的基因→选择载体→目的基因与载体DNA的体外重组→DNA重组体导入受体细胞→受体细胞的繁殖扩增→克隆子的筛选和鉴定→“工程菌”或“工程细胞”的大规模培养。
(1)获取目的基因。取得符合要求的DNA片段,这种DNA片段被称为目的基因。目的基因可以人工合成,也可以用限制性核酸内切酶从基因组中直接切割得到。目前获取目的基因的方法主要有三种:①从适当的供体生物包括微生物、动物或植物中提取;②通过逆转录酶的作用由mRNA合成cDNA(互补DNA);③用化学方法合成特定功能的基因。
(2)选择载体。载体必须具备下列几个条件:①是一个有自我复制能力的复制子;②能在受体细胞内大量增殖,有较高的复制率;③载体上最好只有一个限制性核酸内切酶的切口,使目的基因能固定地整合到载体DNA的一定位置上;④载体上必须有一种选择性遗传标记,以便及时把极少数“工程菌”选择出来。目前原核受体细胞的载体主要有细菌质粒(松弛型)和λ噬菌体两类。真核细胞受体的载体动物方面主要有SV40病毒,植物方面主要是Ti质粒。
(3)目的基因与载体DNA的体外重组。即用人工方法,让目的基因与载体相结合形成重组DNA。首先对目的基因和载体DNA采用限制性内切酶处理,获得互补黏性末端或人工合成黏性末端,然后把两者放在较低的温度(5~6℃)下混合“退火”,由于每一种限制性内切酶所切断的双链DNA片段的黏性末端有相同的核苷酸组分,所以当两者相混时,凡黏性末端上碱基互补的片段,就会因氢键的作用而彼此吸引,重新形成双链。这时,在外加连接酶的作用下,供体的DNA片段与质粒DNA片段的裂口处被“缝合”,目的基因插入载体内,形成重组DNA分子。
(4)DNA重组体导入受体细胞。上述体外反应生成的重组载体只有被引入受体细胞后,才能使其基因扩增和表达。受体细胞可以是微生物细胞,也可以是动物细胞或植物细胞。把重组载体DNA分子引入受体细胞的方法很多。当以重组质粒作为载体时,可以用转化的手段;当以病毒DNA作为重组载体时,则用感染的方法。
(5)受体细胞的繁殖扩增。含重组DNA的活受体细胞,在适当的培养条件下,能通过自主复制进行繁殖和扩增,使得重组DNA分子在受体细胞内的拷贝数大量增加,从而使受体细胞表达出供体基因所提供的部分遗传性状,受体细胞就成了“工程菌”。
(6)克隆子的筛选和鉴定。把目的基因能表达的受体细胞挑选出来,使之表达。受体细胞经转化(传染)或传导处理后,真正获得目的基因并能有效表达的克隆子一般来说只是一小部分,而绝大部分仍是原来的受体细胞,或者是不含目的基因的克隆子。为了从处理后的大量受体细胞中分离出真正的克隆子,需要对克隆子进行筛选和鉴定。
(7)“工程菌”或“工程细胞”的大规模培养。在进行“工程菌”或“工程细胞”的大规模培养以前,还要进行“工程菌”或“工程细胞株”的表达、检测,准备标准实验室工艺流程生产线和进行一系列生产性试验等。
3.基因工程在食用菌育种中的应用及前景
基因工程在食用菌育种中的应用包括两个方面:一方面,利用食用菌作为新的基因工程受体菌,生产出人们所期望的外源基因编码的产品,由于食用菌也具有很强的分泌蛋白能力,利用食用菌作为新的受体菌将更为安全,更易为消费者所接受;另一方面,利用基因工程定向培育食用菌新品种,包括抗虫、抗病、优质(富含蛋白质、必需氨基酸)的新品种,以及将编码纤维素降解酶基因导入食用菌体内,以提高食用菌菌丝体对栽培基质的利用率或开拓新的栽培基质,最终提高食用菌产量。这方面主要是转基因技术的应用。
(1)什么是转基因?
通俗地说,转基因就是将一种生物体内的基因转移到另一种生物或同种生物的不同品种中的过程。
(2)自然界里的“转基因”。
一般来说,在自然界转基因是通过有性生殖过程来实现的。例如,植物的花粉(含有雄配子)通过不同的媒介由一个植物“跑”到另一种植物,或“跑”到同一种植物的另一个品种花朵里边的雌蕊(含有雌配子)上并与其杂交,这种杂交的过程就产生了基因的转移。又如在猫这种动物中,不同品种和类型的猫进行交配后产生了与父母都不一样的子代,就是由于产生了基因的转移。
(3)人工“转基因”。
转基因是大自然中每天都在发生的事情,只不过在自然界中,基因转移没有目标性,好的和坏的基因都可以一块转移到不同的生物个体上。同时,通过自然杂交进行的转基因是严格控制在同一物种内(特别是在动物中),或是亲缘关系很近的植物种类之间。
人工转基因可以实现有目的的、远缘化的基因转移。
(4)什么是转基因育种?
转基因育种主要根据育种目标,从供体生物中分离目的基因,经过DNA重组与遗传转化或直接运载进入受体,经过筛选获得稳定表达的遗传工程体,并经过检测试验与筛选,育成转基因新品种或种质资源。
(5)转基因育种的优势。
与常规育种技术相比,转基因育种在技术上较为复杂,要求也很高,但是具有常规育种所不具备的优势:①拓宽了可利用的基因资源;②为培育高产、优质、高抗优良品种提供了崭新的育种途径;③可以对动植物、大型真菌的目标性状进行定向变异和定向选择;④可以大大提高选择效率,加快育种进程。
此外,还可将动植物、大型真菌作为生物反应器生产药物等生物制品。
(6)食用菌转基因。
①食用菌转基因的研究进展。
科学家通过将新的基因插入蘑菇中,可以使蘑菇产生人类需要的药物作用。人们所熟悉的蘑菇可能成为生产人类药物的生物工厂。
美国利用转基因双孢蘑菇生产疫苗。英国科研人员从海藻和蘑菇中分离出制造多不饱和脂肪酸的3个基因,并植入水芹中。实验证明,食用这种富含ω-3和ω-6多不饱和脂肪酸的水芹,能够调节人体血压和免疫反应。
②食用菌转基因研究方向及意义。
食用菌转基因研究主要在抗霉菌、抗细菌、抗病毒基因方面。因为每年因杂菌污染损失惨重。还要研究食用菌抗高温、抗低温基因,抗害虫基因,使食用菌也和抗虫棉那样旺盛生长。
食用菌产量、品质、抗性和耐贮等相关重要基因紧密连锁的分子标记的寻找,基因的克隆、表达与功能验证,适宜载体的构建和高效稳定遗传转化体系的建立等方面,是今后食用菌育种的主要研究课题。
由于食用菌基因工程起步较晚,尚有许多基础性课题需要研究,如适宜载体的构建、转化体系的建立等。随着食用菌分子生物学研究的不断深入,以及基因工程研究技术的发展,人们有理由相信,食用菌基因工程育种一定会取得丰硕的成果。
思考题
1.名词解释
组织分离法、无菌操作、担孢子、孢子分离法。
2.简述题
(1)对于下列对象,最优的灭菌或消毒方法分别是什么?
接种针、培养皿、斜面培养基、无菌室、培养料。
(2)食用菌菌种的分离有哪些方法?生产中最常用的是哪一种?
(3)优质的母种、原种和栽培种一般应符合哪些要求?
(4)食用菌菌种选育的途径有哪些?
(5)食用菌菌种保藏的原理、目的是什么?
(6)基因工程育种有哪些主要操作步骤?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















