离子注入诱变筛选低产高级醇果酒酵母
李春明 赵树欣 李凤美
摘要:本文采用离子注入对一株黎族酒曲中分离的酵母TQ601诱变选育,依次通过乳酸培养基、产酸培养基和TTC上层平板初筛,再经果汁发酵复筛,并用气相色谱法测定果酒中高级醇含量,最终得到一株TQ105高级醇产量降低了34.5%的菌株。
关键词:酵母,离子注入,高级醇,气相色谱
高级醇(higher alcohols)是指碳原子数超过2的脂肪醇的混合物,是果酒中重要风味物质。苹果酒中的高级醇主要有正丙醇、正丁醇、异丁醇、戊醇、异戊醇、活性戊醇、辛醇、色醇、酪醇等。适量的高级醇使酒体具有丰满的香味和口味,并增加酒的协调性,赋予酒醇厚感,但含量过高也会影响酒的质量与风味,使酒具有不愉快的苦味,更重要的是影响饮用者的健康,容易使人头痛致醉,故其含量必须控制在一定的范围内。鉴于高级醇在果酒中的重要性,筛选低产高级醇的果酒酵母,对于提高果酒的质量和风味有着很重要的意义。
高级醇是酵母酒精发酵正常的副产物,其主要有两条途径形成。早在1907德国化学家埃尔利希(Felix Ehrlish)就提出了啤酒中高级醇形成的机理,他认为醇类是原料中的蛋白质经过分解发酵生成的。1953年哈里斯(Harris)研究并提出了高级醇由糖代谢通过丙酮酸合成的途径。并且证明了两种途径对于高级醇的生成都同等重要。
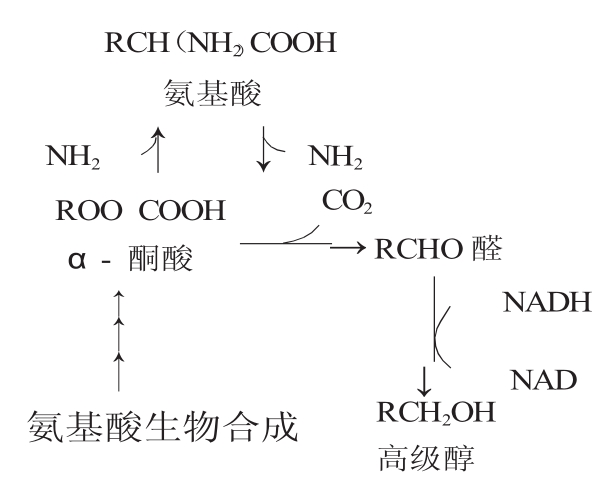
图1 Ehrilish合成途径

图2 Harris合成途径
(天津工业微生物重点实验室天津科技大学生物工程学院30022)
离子注入诱变育种技术是近些年发展起来的物理诱变技术。离子在注入过程中不断与生物分子键合,置换或填充空位形成新的分子基因,既存在着电荷交换,能量交换,动量交换等过程,又存在着入射粒子沉积过程,动量,能量,电荷,质量四种作用均可引发不同的生物学效应。最主要的是离子注入可引起DNA键断裂,致使大量受体原子移位,重组,形成新的分子结构和基因,产生丰富基因突变,从而获得高突变率。该技术能以较小的生理损伤得到较高的突变率、较广的突变谱,而且具有设备简单、使用方便,成本低廉、对人体和环境无害等优点,因此将有很好的发展前景。
1 材料与方法
1.1 出发菌株
TQ601分离自海南省五指山黎族酒曲。
1.2 培养基
1.2.1 发酵培养基
70Bx苹果浓缩汁稀释至20Bx。
1.2.2 YEPD
蛋白胨2%,酵母膏1%,葡萄糖2%,pH6.0。
1.2.3 乳酸培养基
乳酸4%,硫酸铵0.5%,磷酸二氢钾0.1%,氯化钠0.01%,硫酸镁0.05%,氯化钙0.01%,酵母膏0.02%,pH6.0。
1.2.4 酵母产酸培养基
在YEPD固体培养基中加入干热灭菌后的碳酸钙0.5%。
1.2.5 TTC上层培养基
TTC0.05%,乳酸0.5%,琼脂1.5%,pH6.0。
1.3 离子注入诱变方法
1.3.1 N+离子注入前样品的制备
取培养24 h后的活化菌种一环于25mlYEPD液体培养基培养至对数期,取0.1ml菌液均匀涂于平皿底大约硬币大小面积,以在显微镜下观察无相互重叠的细胞为宜。用无菌风吹干后立即进行N+注入。
1.3.2 N+注入处理
注入能量为30 keV,注入剂量为1×105,2×105,3×105,5×105,8×105,1×106每秒离子数,注入靶室的真空度为10-3Pa,束流量为1 mA。
1.3.3 N注入后的培养
+
将待注入样品做好组标记后,放入靶室。经过不同剂量的照射后,盖上培养皿盖,并在样品上滴加1ml无菌水。用灭过菌的橡皮擦下菌体,取0.1ml菌液作十倍稀释。
1.4 筛选方法
1.4.1 初筛
将诱变处理过的酵母细胞均匀涂布在乳酸培养基上,置黑暗处25℃培养3~5d。挑选生长菌落较大、菌层较厚的菌株转接于酵母产酸培养基上于25℃培养3d,菌落影印到乳酸培养基上,25℃培养3d。菌落长成后加入TTC暗培养2~3h,挑选出在酵母产酸培养基上生长较好、中央隆起较突出、溶钙圈较适中、乳酸培养基上红色较深的菌株。
1.4.2 复筛
稀释至20Bx苹果浓缩汁200ml于22℃发酵9天,测定高级醇含量,选择低产高级醇的菌株。
1.5 气相色谱测定高级醇
1.5.1 相对校正因子的测定
以正丁醇作内标,分别用移液管移取气相色谱标准物均为1g/L的甲醇、正丙醇、正丁醇、异丁醇、异戊醇各1ml于100ml容量瓶中,以40%乙醇定容,混匀后进样,进样量不超过1μl,即可测定各组分的相对较正因子。
1.5.2 内标法测定高级醇
以正丁醇为内标物,在10ml容量瓶中准确加入0.1ml 1g/L正丁醇,以酒样定容至刻度,混合均匀后即可进样。
2 结果与讨论
2.1 酵母生长曲线
取1环冰箱保存的TQ601于5mlYEPD液体培养基活化24小时,吸取1ml菌液转接于100ml YEPD液体培养基,震荡培养,每2小时测1次OD值。由图3可知,在4小时开始进入对数期,诱变选在培养8小时后进行。

图3 酵母生长曲线
2.2 离子注入诱变后初筛结果
诱变后菌株的生长情况如图4乳酸平板生长所示,可见诱变后菌株在乳酸平板上生长大小不一,生长较大菌株是能较好的利用乳酸脱氢酶的菌株,也就是说代谢乳酸的能力增强要消耗较多的NADH,也就减少了生成高级醇所要消耗的NADH,即这些菌株有可能是低产高级醇的酵母。挑选在乳酸培养基上较大的菌落大约80株接种到产酸培养基上。产酸培养基上产透明圈适中的菌落为所需要的,将菌落影印到乳酸培养基上,TTC显色后红色较深的菌落为产酒精能力较强的菌落,因此该菌落可能为低产高级醇菌落,挑出接种到YEPD斜面,备用。共挑出18株菌株进一步做发酵复筛试验。

图4 乳酸平板生长情况
注:图4圈注的为较大菌落

图5 产酸培养基生长情况

图6 TTC显色情况
2.3 发酵复筛试验结果
将初筛得到的这18株菌在稀释至20Bx的苹果浓缩汁中22℃发酵9天,发酵结果如表1所示。
表1 发酵后各菌株高级醇产量
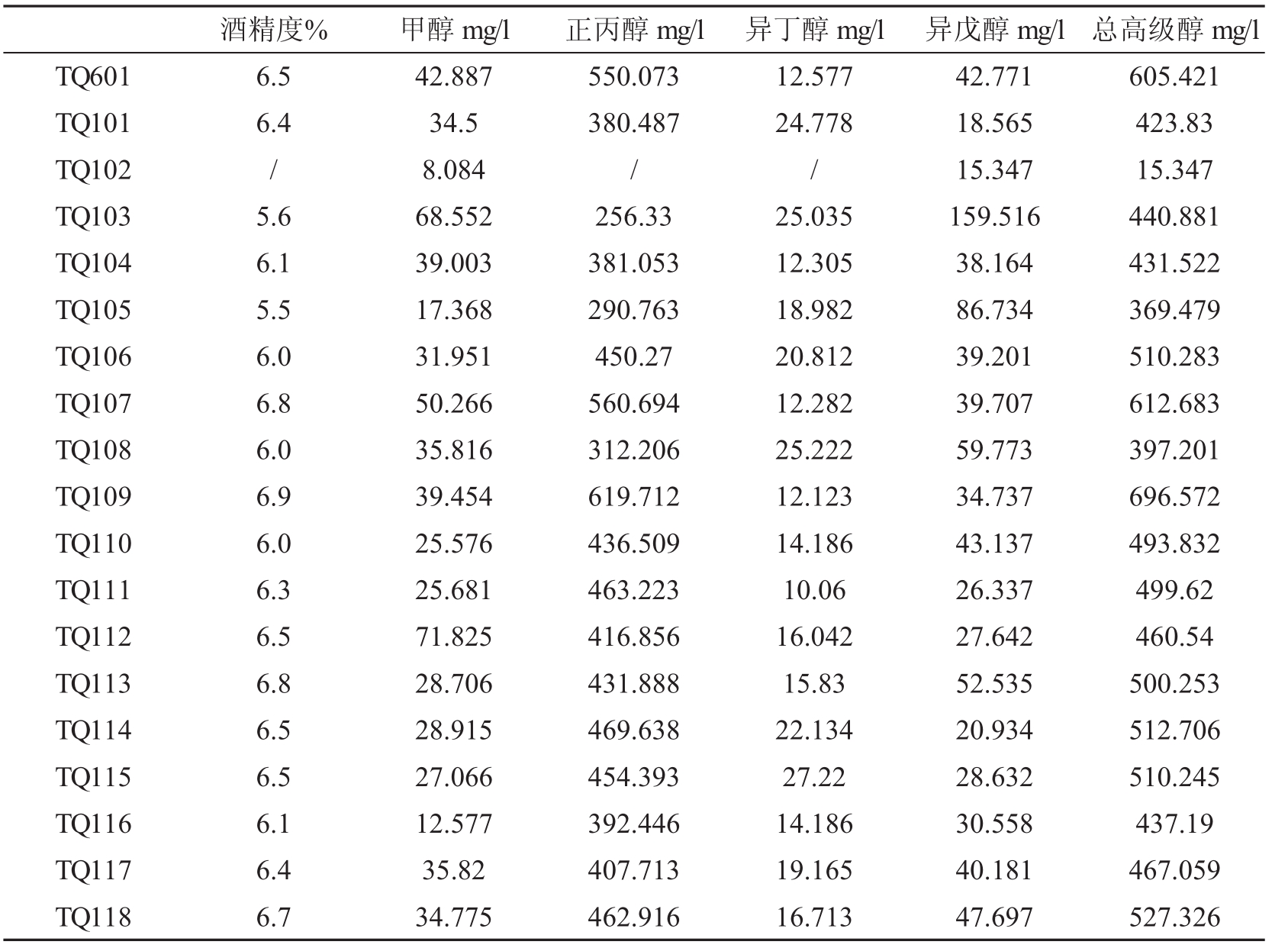
注:其中TQ102菌株发酵过程中发酵拴中硫酸有倒吸现象,发酵受到影响。
由发酵后的结果可以看出,18株初筛后的菌株中16株经复筛发酵高级醇的产量低于TQ601发酵高级醇产量。其中TQ105和TQ108高级醇产量低于400mg/l,有7株菌高级醇产量低于500mg/l,另外5株菌高级醇产量低于600mg/l。其中TQ105的高级醇产量仅为396.479mg/l,比原菌株高级醇产量降低了34.5%。
3 结论
本文采用离子注入这一新兴、高效的诱变方法对一株分离自黎族酒曲的酵母TQ601进行诱变处理,经过乳酸培养基,产酸培养基,TTC显色等一系列过程的初筛,初步得到18株菌株。进一步果汁发酵复筛后,除一株发酵失败外另外15株菌的高级醇产量均低于原菌株的高级醇产量。最好的一株菌TQ105醇产量降低了34.5%。离子注入诱变方法虽然是一种高效的诱变方法,但是在人们实践的过程中发现该方法的回复突变率高,因此我们正在用其他诱变方法加以巩固离子注入的诱变效果,以保证获得遗传性状稳定的菌种。
参考文献:
[1]方维明,等.低含量高级醇啤酒酵母菌种的选育.南京农业大学学报,2005,28 (1):61~65
[2]汪志军,等.紫外诱变筛选低高级醇和双以酰含量的啤酒酵母.中国酿造,2005,1: 13~17
[3]刘勇军,等.离子注入诱变筛选高产L-乳酸菌及其发酵条件的初步研究.中国乳品工业,2003,31 (1) :9~13
[4]宋安东,等.离子注入对苹果酒酵母菌的诱变研究.郑州大学学报,2003,35 (3):48~51
[5]甄会英,等.气相色谱法测定葡萄酒中高级醇.食品科技,2005,4: 74~76
[6]孙俊红,何碧英.白酒中甲醇、高级醇类的毛细管气相色谱测定法.职业与健康,2005,21 (5):696~698
[7]冯志华,孙启玲.低能离子注入微生物育种及其机制研究进展.四川食品与发酵,2002,2: 6~8
[8]虞龙,张宇.离子注入微生物育种的研究与应用进展.微生物学杂志,2005,25 (2):80~83
[9]黄文彩,等.离子注入微生物的诱变效应研究.安徽农业大学学报,1994,21 (3):282~285
[10]张明,等.低能氮离子注入大肠杆菌诱发的生物学效应研究.生物学杂志,2004,21 (3):23~26
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















