实验三十一 酵母双杂交技术
【实验目的】
1.掌握酵母双杂交实验的原理。
2.学习应用酵母双杂交实验验证蛋白质之间的相互作用。
【实验原理】
酵母双杂交系统,又称蛋白捕获系统,是由Fields和Song等人根据真核转录调控的特点创建的。真核生长转录因子含有两个不同的结构域: DNA结合结构域(DNA binding domain,BD)和DNA转录激活结构域(transcription-activating domain,AD)。BD识别DNA上的特异序列,并使转录激活结构域定位于所调节基因的上游; AD与转录复合体其他成分作用,从而启动所调节基因的转录。二者连接区在适当部位打开,可使BD与AD分离,而且两结构域可重建转录因子发挥转录激活作用。将拟研究的靶蛋白(prey)基因与AD序列结合,编码另一蛋白——诱饵蛋白(bait)的基因与DNA的BD序列结合,形成两段融合基因。在构建融合基因时,靶蛋白或诱饵蛋白与结构域基因必须在阅读框架内融合(不破坏各自的密码子)。当这两段融合基因在同一菌株内表达,靶蛋白与诱饵蛋白在核内相互作用时,才能重新形成一个完整的有活性的转录因子,从而激活报告基因的转录。所以根据报告基因表达与否,即可判断靶蛋白与诱饵蛋白之间是否作用。该系统中常用的两个质粒如图3-21所示。
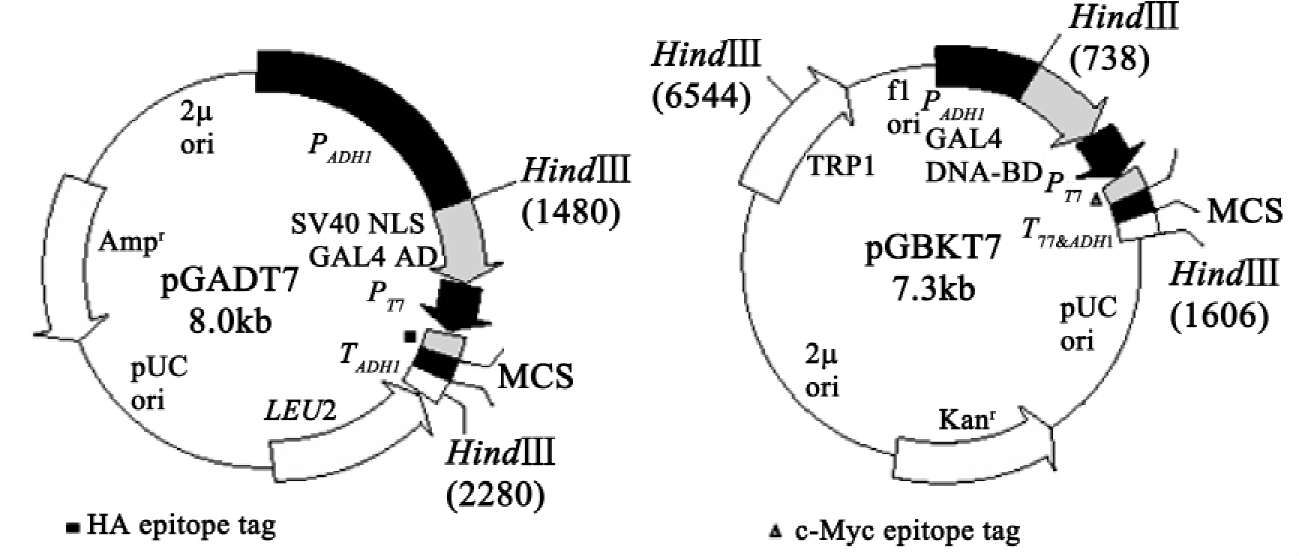
图3-21 酵母双杂交中使用的质粒
酵母双杂交技术应用于检验蛋白质间的相互作用、分析蛋白质相互作用的结构域以及发现新的作用蛋白质。在研究特定的基因功能、信号传导、代谢途径中,蛋白质相互作用的关系网络的研究发挥着重要的作用。
常规的酵母双杂交实验对于检测膜蛋白的相互作用有局限性,一种可用于膜蛋白的酵母双杂交系统USPS(ubiquitin-based splitprotein sensor)应运而生(Fashena et al.,2000)。
【实验材料】
1.菌株: E. coli DH5α,Y1090,DH10B。
2.酵母双杂交系统: MATCHMAKER Two-Hybrid System 3试剂盒购自CLONTECH公司。包括GAL4 DNA结合域表达载体pGBKT7,带有Kan抗性和Trp选择标记; GAL4 DNA激活域表达载体pGADT7,带有Amp抗性和Leu选择标记;自激活阳性对照质粒pCL1,带有Amp抗性和Leu选择标记;自激活阴性对照质粒pGBKT7-lam,带有Kan抗性和Trp选择标记(图3-21)。酵母菌株AH109,酵母菌株Y187。
【药品试剂】
1. LB培养基。
2. YPD: 20g Difco peptone,10g Yeastextract,调pH值至5.8,加超纯水定容至950 ml,高压灭菌,之后加入灭菌的40%葡萄糖50 m l。YPDA培养基中另加0.2% Ade(adenine腺嘌呤)。固体培养基含Agar 20g/L。
3. SD/-Trp: 0.74g DO/-Trp,6.7g YNB,以NaOH调pH值至5.8,加超纯水定容至950 ml,之后加入灭菌的40%葡萄糖50 ml。固体培养基含琼脂粉20g/L。
4. SD/-Leu: 0.69g DO/-Leu,6.7g YNB,以NaOH调pH值至5.8,加超纯水定容至950 ml,之后加入灭菌的40%葡萄糖50 ml。固体培养基含琼脂粉20g/L。
5. SD/-Trp-Leu: 0.64g DO/-Trp-Leu,6.7g YNB,以NaOH调pH值至5.8,加超纯水定容至950 ml,之后加入灭菌的40%葡萄糖50 ml。固体培养基含Agar 20g/L。
6. SD/-Trp-Leu-His-Ade: 0.6g DO/-Trp-Leu-His-Ade; 6.7g YNB以NaOH调pH值至5.8,加超纯水定容至950ml,之后加入灭菌的40%葡萄糖50ml。固体培养基含琼脂粉20g/L。
7.酵母转化使用液:
10×TE buffer: 0.1 mol/L Tris·Cl,10 mmol/L EDTA,pH 7.5。
10×LiAc: 1mol/L LiAc,用醋酸调pH值到7.5。
50% PEG3350:取50g PEG3350溶于60 ml超纯水中,加热溶解,定容到100ml。
以上溶液高压灭菌。
8.酵母裂解液: 2% Triton X-100,1% SDS,100mmol/L NaCl,10mmol/L Tris-Cl(pH 8.0),1mmol/L EDTA。
9.β-半乳糖苷酶活性检测所用试剂:
Z buffer: 16.1g/L Na2 HPO4·7H2O,5.50g/L NaH2 PO4·H2 O,0.75g/L KCl,0.246g/L MgSO4·7H2 O,调pH值至7.0,高压灭菌。
X-gal储存液:以DMF为溶剂溶解X-gal配成50mg/ml的溶液,-20℃条件下避光保存。
Z buffer/X-gal溶液: 100ml Z buffer,0.27 m lβ-巯基乙醇,0.668 mL X-gal储存液。
【实验方法】
一、载体构建
将编码待检测蛋白的基因分别构建到pGBKT7和pGADT7上(方法参见分子生物学实验)。
二、自激活实验
以酵母菌AH109为受体菌,采用LiAc法分别转化自激活阳性对照质粒PCL1、阴性对照质粒pGBKT7-lam、诱饵蛋白重组质粒pGBKT7-gene。将转化的菌体分别涂布相应的SD-Leu或SD-Trp平板,生长2~3天,分别挑取酵母转化子至SD-His平板做组氨酸营养型检测或至滤纸片上,进行β-半乳糖苷酶活性检测。含有pCLl的转化子在很短的时间内变为蓝色,含有pGBKT7-lam和pGBKT7-gene的转化子在8小时之内没有颜色改变。而在SD-His平板上,除了PCL1转化子外,其他菌株都不能生长,这一结果表明待测基因没有自激活特性,可以作为诱饵蛋白进行。
三、酵母感受态细胞的制备和LiAc介导的质粒DNA转化
1.挑取几个直径2~3mm的酵母克隆至5ml YPD或SD培养基中,30℃,200r/min过夜培养。
2.将其转接到含有50mL相应的培养基中,30℃培养3~5小时,室温条件下,1000r/min离心5分钟收集菌体,弃上清液。
3.沉淀加入25~50m l灭菌水重悬,室温,1000g离心5分钟,弃上清液,以新鲜配制的1×TE/LiAc溶液(体积比10×TE: 10×LiAc: H2 O= 1∶1∶8)重悬细胞沉淀,即制成酵母感受态细胞。
4.在1.5ml离心管中加入0.1μg质粒DNA和1μg鲑精DNA(鲑精DNA使用前用沸水煮10分钟后快速置于冰浴),混匀。
5.加入0.1m l酵母感受态细胞,混匀,再加入0.6 m l灭菌的PEG/LiAc溶液(体积比10×TE∶10×LiAc∶50% PEG4000= 1∶1∶8),高速振荡10秒以混匀。
6.之后,30℃条件下,200r/min培养30分钟,加入70μl DMSO,42℃水浴热击15分钟,再置于冰上冷却1~2分钟,14000r/min室温离心5秒钟,去上清液。
7.沉淀用200μl灭菌水重悬后涂布带有相应选择标记的缺失平板上,30℃倒置培养。
四、报告基因的检测
1.LacZ报告基因的检测:采用β-半乳糖苷酶活性检测:将在缺失平板上生长的酵母菌落用无菌牙签挑到一张干净的滤纸上,菌落面朝上,置于液氮中10秒,室温解冻后,将滤纸放入事先浸泡于Z buffer/X-gal溶液中的另一张干净的滤纸上,30℃孵育,观察菌落是否出现蓝色,以8小时之内出现蓝色为阳性,没有颜色变化的为阴性。
2.His3报告基因的检测:将生长的酵母克隆,用无菌牙签画线转接于不含His C(SD/His)的营养缺陷型平板上,30℃培养3~4天,观察菌落生长情况。
3.Ade2报告基因的检测:将生长的酵母克隆,用无菌牙签画线转接于不含Ade(SD/Ade)的营养缺陷型平板上,30℃培养3~4天,观察菌落生长情况。
【思考题】
1.酵母双杂交的原理如何?
2.酵母双杂交实验有哪些优缺点?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















