1977年Alwine等人提出一种用于分析细胞总RNA或含poly A尾的RNA样品中特定mRNA分子的大小和丰度的分子杂交技术,即Northern印迹技术(Northern blotting),也称为RNA杂交。由于该杂交与用于分析DNA的Southern杂交技术的原理和方法类似,故被称为Northern杂交,与之类似的还有被命名为Western blot的蛋白质印迹技术。Northern杂交自出现以来已得到广泛应用,成为分析mRNA的常用方法之一。
Northern杂交曾经是应用得最广的技术之 ,尽管其分辨率和操作简易性都不如RT-PCR等方法,但依然是检测、定量mRNA大小及在组织中表达水平的标准方法;灵敏度,而且这种膜可以重复利用。
对于以地高辛标记探针的检测,在杂交结束后加入结合有辣根过氧化物酶或碱性磷酸酶的抗地高辛单克隆抗体,它可以与地高辛标记的探针特异性结合。随后的检测过程与上面介绍的生物素探针标记的检测相同。这些非放射性标记物探针的杂交结果的检测都已有商品化的检测试剂盒。
(二)结果与分析
杂交结果常见问题及解决方案 见表9-5。是能直接提供有关RNA完整性、不同的剪接信息及mRNA大小等信息的唯一方法,也是在同一张膜上直接比较同一信息在不同样品中的表达丰度的首选方法,且具有高度特异性。操作上,膜杂交前可制备部分同源探针、可检测所提取RNA的含量及质量,而杂交过后的杂交膜若适当保存,可存放数年后重复进行杂交。
尽管具有很多优点,Northern杂交也存在一些限制:首先,其操作步骤相当繁琐,且对RNase污染非常敏感,任何一步操作不当都会严重影响分辨率,使得表达水平定量分析大打折扣,因此用不含RNA酶的试剂及耗材是非常必要的。Northern杂交所用水和离心管通常都用DEPC处理,使RNA酶灭活。其次,标准的Northern杂交分析灵敏度相对于RT-PCR来说比较低。再次,Northern杂交分析在进行多重探针分析时比较困难。为了检测多种mRNA,通常需要先去除第一种探针再进行第二种探针的杂交,这一操作很耗时,并且容易出现问题。
一、Northern印迹杂交的基本原理
与Southern杂交相似,Northern杂交也采用琼脂糖凝胶电泳。首先将分子量大小不同的RNA分离开来,随后将其原位转移至固相支持物(如尼龙膜、硝酸纤维膜等)上,再用放射性(或非放射性)标记的DNA或RNA探针,依据其同源性进行杂交,最后进行放射自显影(或其他非放射自显影方法)检测。以目标RNA所在位置标示其分子量的大小,而其显影强度则可提示目标RNA在所测样品中的相对含量(即目标RNA的丰度)。与Southern杂交不同的是,总RNA不需要进行酶切,可直接应用于电泳。另外,点样前用羟甲基汞、乙二醛或甲醛使RNA变性,而不用能使RNA降解的NaOH。
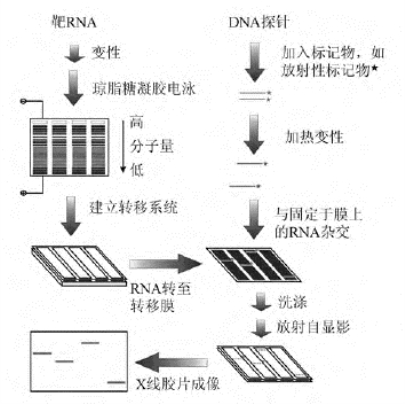
图9-8 Northern杂交实验的基本流程
Northern杂交的实验流程如图9-8所示。待测靶RNA经过变性处理后通过电泳进行分离,之后再应用转移系统将凝胶分离的RNA转移至固相的支持物(如尼龙膜或硝酸纤维素滤膜)上。然后将已经标记的单链探针或变性双链与固定于转移膜上的目标RNA进行杂交。杂交后通过洗膜去除未结合的或非特异性结合的探针,检测特异性结合的探针的标记信号并分析结果。
二、Northern印迹杂交方法
Northern杂交方法是单一基因表达分析的首选方法,主要包括以下几个步骤:①RNA的提取与质量检测; ②RNA的变性和分离; ③RNA转移至固相支持物中;④固相RNA与探针分子杂交;⑤对特异性结合的探针分子进行检测和分析。其中每个步骤都有很多可以选择的实验方法,必须根据所要检测的RNA分子的大小、性质、丰度等不同因素进行选择,此外还需考虑实验条件和仪器等,选择合适的实验方案来进行。
所需材料、试剂、仪器概述如下。
材料:总RNA样品或mRNA样品、探针、模板DNA(25 ng)、尼龙膜或硝酸纤维素膜、 X线底片、底片暗盒等。
试剂:NorthernMax Kit、琼脂糖、随机引物、111TBq/mmol[α-32P]dCTP、DEPC、dNTP 混合物、Exo-free Klenow Fragment和10 ×缓冲液、Sephadex G-50、SDS、过氧化氢(双氧水)、灭菌水等。
仪器:恒温水浴箱、电泳仪、凝胶成像系统、真空转移仪、真空泵、UV 交联仪、杂交炉、恒温摇床、脱色摇床、涡旋振荡器、分光光度计、微量移液器、电炉(或微波炉)、离心管、烧杯、量筒、三角瓶等。
以下按照实验过程的顺序介绍Northern杂交实验操作。
(一)总RNA的提取
Trizol法提取总RNA可参见第6章第三节,这里介绍两种改良的方法。
方法1.改良异硫氰酸胍提取法
【材料】 主要试剂及其配制如下。
(1)异硫氰酸胍变性液
储存液:在含484ml 水(经DEPC处理),17.6ml 0.75mol/L柠檬酸钠(pH 7.0)和26.4ml10%Sarkosyl的溶液中加入250g异硫氰酸胍,加热至60~65℃并持续搅拌使之充分溶解。储存液室温保存备用(不超过3个月)。
工作液:在每50ml储存液中加入0.35ml 2-ME即配制成工作液。工作液于室温下保存不超过1个月。工作液各成分的终浓度为:4mol/L异硫氰酸胍,25mol/L柠檬酸钠(pH 7.0), 0.5%(w/v)N-十二烷基肌氨酸(Sarkosyl),0.1mol/L巯基乙醇(2-ME)。
(2)2mol/L乙酸钠(NaAc)缓冲液(pH 4.0)。
(3)水饱和酚(pH 3.5)。
(4)49∶1 (v/v) 氯仿/异戊醇。
(5)100%异丙醇。
(6)70%乙醇(用DEPC处理水配制)。
(7)DEPC处理后高压灭菌水。
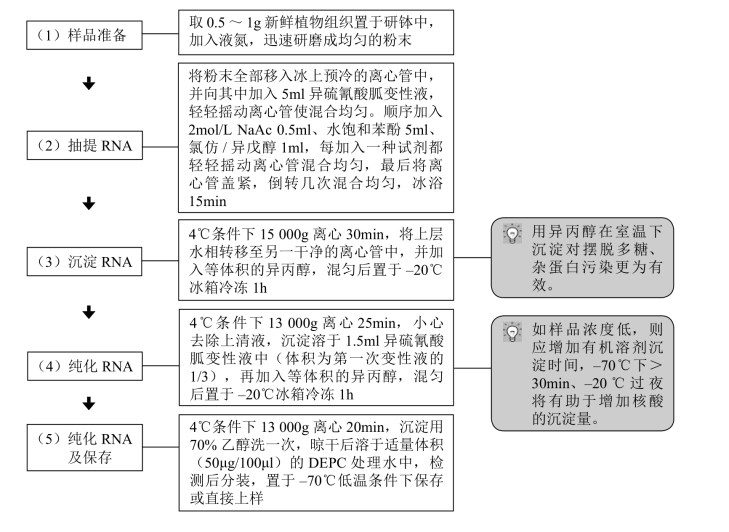
【操作步骤】
【注意事项】 RNA提取过程中,为了保证所提取的RNA的纯度和完整性,有两个方面的问题需要特别注意:一是去除与RNA结合的蛋白质;二是避免内外源RNase对RNA的降解。
在RNA的提取中,常采用的蛋白质变性剂有苯酚、氯仿、十二烷基磺酸钠(SDS)等。酚能有效变性蛋白质,但也能溶解10%~15%的水,从而溶解一部分poly(A)RNA,且不能完全抑制RNase的活性。氯仿能克服酚的缺点,加速有机相与液相分层,最后用氯仿抽提可去除核酸溶液中的过量酚。少许异戊醇的作用是可以降低表面张力,从而减少核酸提取过程中的气泡产生。另外,异戊醇有助于分相,使离心后的上层含DNA的水相、中间的变性蛋白相及下层有机溶剂相维持稳定。
为防止外源RNase的污染,所有实验用品均需用DEPC处理并高压灭菌,所有试剂配制均需使用经DEPC处理过的水并灭菌处理。内源RNase的抑制采用异硫氰酸胍等强还原剂。为避免人体污染,所有实验操作均应戴手套,避免人体直接接触所有用品。
方法2.改良Krapp提取法
【材料】 主要试剂及其配制如下。
(1)RNA抽提液。
(2)异硫氰酸胍变性液。
储存液:4mol /L异硫氰酸胍,20mmol/L EDTA,20mmol/L MES(pH 7.0)。
工作液:取400ml母液加入1.7ml 2-ME储存在4℃条件下备用。
(3)RNA重悬液:2mol/L LiCl,10mmol/L NaAc,调整终体积为250ml,pH 5.2,灭菌后储存在4℃条件下备用。
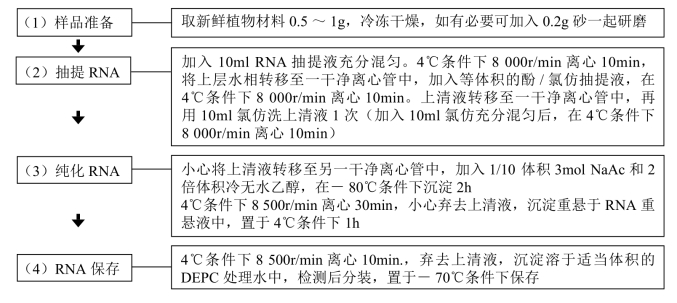
【操作步骤】
(二)RNA质量检测
提取的RNA需要对其质量和数量进行检测。实验室常用的方法有紫外吸收值检测和电泳检测两种(具体可参见第4章、第6章相关内容)。
(三)RNA电泳
RNA电泳与DNA电泳不同之处在于其电泳过程是在变性条件下进行的,以消除RNA中的二级结构,保证RNA完全按分子大小分离。根据所用变性剂不同共分为3种:甲醛变性电泳、乙二醛变性电泳和羟甲基汞变性电泳。电泳后再将琼脂糖凝胶中RNA转移到硝酸纤维素滤膜或尼龙膜上,然后与探针杂交。下面以常用的甲醛变性电泳为例简介(根据需要选用适当的分子量标准)。
【材料】 主要试剂及其配制如下。
(1)MOPS缓冲液(10×):200mmol/L MOPS(pH 7.0),50mmol/L NaAc、10mmol/L EDTA。
准确称取41.86g MOPS、6.8g NaAc、3.72g EDTA,先用适量的DEPC处理水溶解NaAc,再将MOPS溶解其中,再加入已用同样方法处理水溶解的EDTA,混匀后用2mol/L NaOH调整pH 至7.0,最后定容至1 000ml,过滤灭菌后避光保存。
(2)加样缓冲液:50%甘油、1mmol/L EDTA、0.4%溴酚蓝、0.4%二甲苯蓝。
(3)甲醛(37%溶液,13.3mol/L)。
(4)去离子甲酰胺:将10ml甲酰胺和1g离子交换树脂混合,室温搅拌1 h后用Whatman滤纸过滤。等分成1ml于-70℃储存。
(5)溴化乙锭:EB,10mg/ml。
(6)70%乙醇。
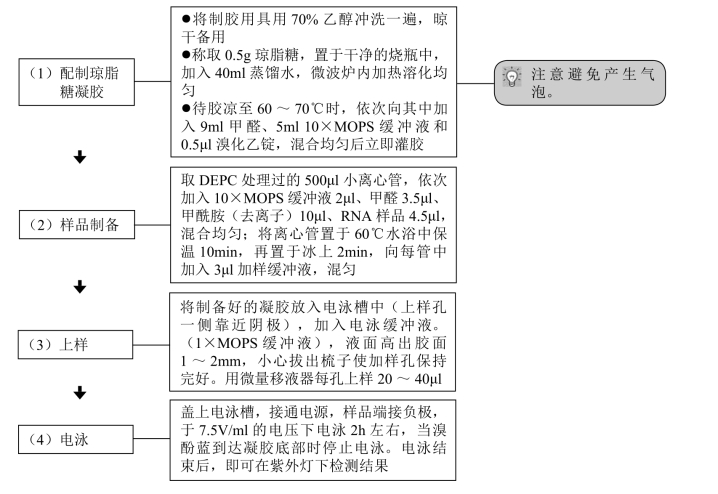
【操作步骤】
RNA样品质量分析:完整的总RNA样品应呈现出3条条带,分别为28S rRNA、18S rRNA、5S rRNA。其中28S rRNA条带的亮度应约为18S rRNA条带亮度的2倍,这表明RNA样品比较完整,基本无降解。如果2条带的亮度反过来,则说明RNA样品已发生降解。如果在点样槽内或槽附近有荧光区带,则表明RNA样品中有DNA污染。植物总RNA中28S rRNA及18S rRNA在变性胶上的迁移率相当于分子量5.1kb及2.0kb RNA的迁移率,以此可作为分子量的参考。
(四)将变性RNA转移至尼龙膜
电泳完毕后,立即将RNA自琼脂糖凝胶转移至硝酸纤维素滤膜或尼龙膜。有以下几种转移方法:毛细管转移法、真空转移法和电印迹法。毛细管转移法如下所述,真空转移法和印迹法则按有关仪器生产厂家产品说明书进行。以下以尼龙膜为例介绍将变性RNA转移至尼龙膜的方法,硝酸纤维素滤膜的转移方法与其类似。目前商业化的尼龙膜有两种:未经修饰的(中性的)和带正电荷的尼龙膜。二者都能结合单链和双链核酸,但在不同缓冲液中结合核酸的量不同,相应RNA转移所用的缓冲液亦不同。
【材料】
(1)转移缓冲液1:0.01mol/L NaOH,3mol/L NaCl(用于碱性转移至带正电荷的尼龙膜)。
(2)转移缓冲液2:20×SSC(3.0mol/L NaCl,0.3mol/L 柠檬酸三钠,调至pH 7.0 )(用于中性转移至不带电荷的尼龙膜)。
(3)其他试剂:0.05mol/L NaOH、6×SSC、去离子水。
(4)其他材料:尼龙膜、RNA电泳凝胶、玻璃皿、新的解剖刀或切纸刀、手套、平头镊子、一叠玻璃板、滤纸、纸巾。
【操作步骤】

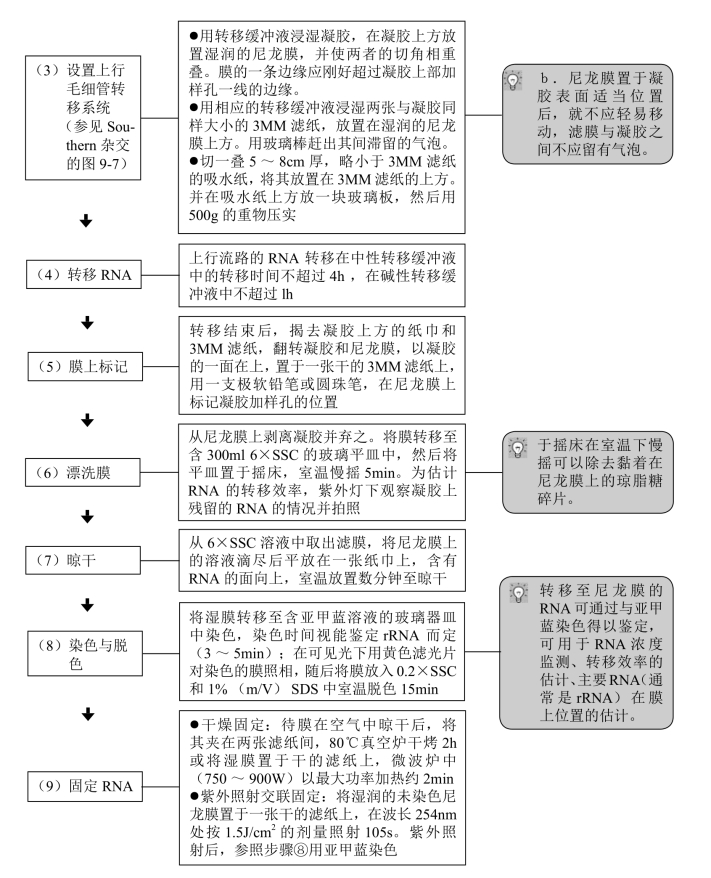
(五)杂交与预杂交
由于使用的探针类型和标记方法不同,Northern杂交的具体操作步骤各异,但主要包括预杂交、探针的变性、杂交、洗膜及结果显示这几个步骤。
预杂交和杂交过程使用的是同一种缓冲液,预杂交一定时间后,更换新鲜缓冲液,加入探针进行杂交。目前经常使用两类缓冲液:标准杂交缓冲液和高浓度SDS杂交缓冲液。标准杂交液是一类常用的缓冲液,用SSC或SSPE与Denhardt试剂、SDS一起配制,临用前加入变性鲑精DNA。高浓度SDS杂交液也称为Church缓冲液,其配方最早是由Church和Gilbert提出的。Church缓冲液中加入高浓度的SDS,可以有效地消减背景,减少由于背景过高而杂交信号太低无法分辨的情况。此外,使用Church缓冲液无需加入变性鲑精DNA之类的DNA、RNA运载体,以及硫酸葡聚糖、聚蔗糖和PVP等试剂,组成简单,配制方便。
选择最适杂交反应温度对杂交技术来说也非常重要。若反应温度低于解链温度10~15℃,碱基顺序高度同源的互补链可形成稳定的双链,错配对减少。若反应温度再低(Tm-30℃),虽然互补链之间也可形成稳定的双链,但互补碱基配对减少,错配对增多、氢键结合得更弱。因此,在实验前必须首先确定杂交温度。通常有3种温度可供试验,即最适复性温度、严谨复性温度及非严谨复性温度。
最适复性温度=Tm-25℃
严谨复性温度= Tm-10℃或15℃
非严谨复性温度=Tm-30℃或35℃
有研究人员报道,反应液中每增加1%的甲酰胺浓度,Tm值可降低0.72℃。因此,可用调节甲酰胺浓度的办法来调节Tm。对于探针与靶序列没有同源性,即低严谨度杂交时,通常在杂交液中加入30%~50%甲酰胺,并在较低温度(37~42℃)下进行杂交。
【材料】
(1)预杂交/杂交缓冲液
标准预杂交/杂交缓冲液:6×SSC(或6×SSPE)、5×Denhardt'试剂、0.5% (w/v)SDS,100 µg/ml鲑鱼精DNA(临用前加)。
20×SSPE(调至pH 7.4):3.0mol/L NaCl,0.2mol/L NaH2PO4,0.02mol/L EDTA。
50×Denhardt试剂:1%(w/v)聚蔗糖,1%(w/v)PVP,1%(w/v)BSA。
Church 缓冲液:0.5mol/LPBS(pH 7.2)、1mmol/L EDTA、1%(w/v)BSA、7% (w/ v)SDS。
(2)洗涤液:SSC(0.5×,l×和2×)含0.1 %(m/V)SDS,SSC(0.1×和0.5×)含0.1 %(m/V)SDS。
(3)3mol/L NaOH、lmol/L Tris-HCl(pH 7.2)、3mol/L HCl。
(4)探针。
【操作步骤】


2.化学发光检测
【材料】
(1)洗膜缓冲液:100mmol /L Maleic acid、150mmol/L NaCl、0.3%(v/v) Tween20(pH 7.5)。
(2) Maleic acid缓冲液:100mmol/L Maleic acid、150mmol/L NaCl(pH 7.5)。
(3) 封闭液:5% (w/v) SDS、17mmol/L Na2HPO4、8mmol/L NaH2PO4、室温保存,如果需要,用0.45μm的滤膜过滤除菌。
(4) 检测缓冲液:100mmol /L Tris-HCl(pH 9.5)、100mmol /L NaCl。
(5) TE缓冲液:10mmol/L Tris-HCl (pH 8.0)、1mmol /LEDTA。
(6) Anti-DIG-AP。
(7) CSPD: 25mmol CSPD(用前稀释)。
【操作步骤】

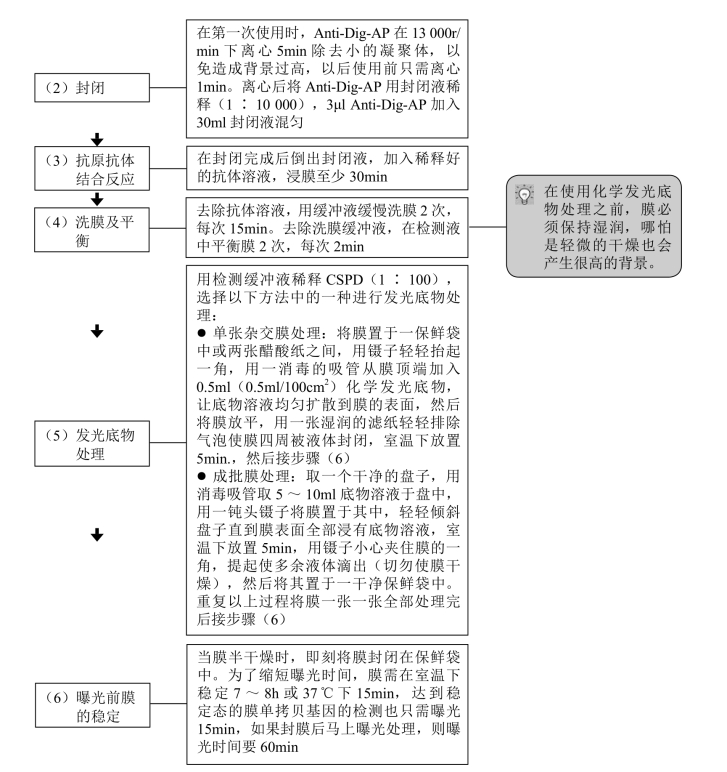
3.NBT-BCIP荧光检测
【材料】 Anti-Dig-AP、NBT、BCIP,其他同化学发光检测。
【操作步骤】


(七) 杂交结果的分析
一般来说,一个基因的转录本很少只在一种组织中表达,较常见的是在不同的组织中有不同的表达水平。即使在所有组织和不同细胞中都有表达的基因,它在不同组织中的表达仍存在一些差异。因此,建议在对实验结果做出任何结论之前,应进行多次X线胶片曝光分析。例如组织型纤溶酶原激活物,如果X线胶片曝光时间过短很可能会得出错误的结论,以为它只在肺和肾中表达。在基因转录表达水平非常低的情况下(即使是在获得cDNA探针的组织中),有必要将X线胶片曝光较长时间。如果长时间曝光也不能产生强烈的信号,则可以通过提高探针的比活性来增强其敏感性,也可以通过使用RNA探针来提高敏感性。
图9-9源自某实验研究,图中上部分显示了各组织中agouti基因的表达情况,下部分表示常用内参基因3-磷酸甘油醛脱氢酶(GAPDH)在相应组织中的表达。agouti基因通常只在野生型小鼠皮肤中表达,该检测结果表明这些组织中表达呈阳性的agouti是转基因小鼠特异性的。
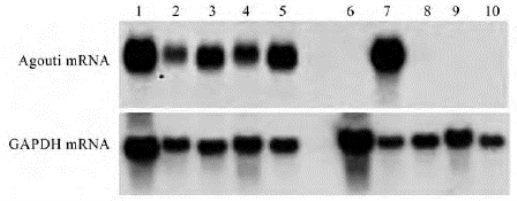
图9-9 Northern杂交结果实例
1-5道:BAPa20转基因小鼠的肌肉、肝脏、小肠、脑、脂肪组织样品;
6-10道:alb-agouti 86转基因小鼠的肌肉、肝脏、小肠、脑、脂肪组织样品
(八) Northern杂交常见问题及解析
Northern杂交常见问题及解析 见表9-6。
表9-6 Northern杂交常见问题及解析
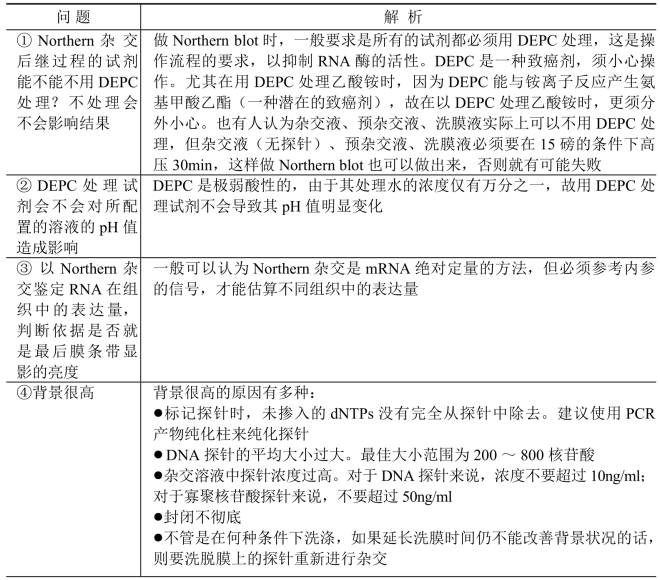
(续表)

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















