(一)一氧化氮
一氧化氮(nitric oxide,NO)最早被片面地认为是工业毒气。1990年美国纽约州立大学的弗奇戈特通过研究认为内皮细胞在乙酰胆碱的作用下产生了一种新的信使分子,这种信使分子作用于平滑肌细胞,使血管平滑肌细胞舒张,从而扩张血管。这种未知的信使分子因此被命名为内皮细胞松弛因子(endothelium-derived relaxing factor,EDRF)。加州大学洛杉矶分校的伊格纳罗(Louis J Knarro)教授等也在研究EDRF,与弗奇戈特合作,发现EDRF就是NO能够激活可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC)。1998年,因为发现了NO自由基,弗奇戈特、伊格纳罗博士和美国弗吉尼亚大学的穆拉德教授被授予当年度的诺贝尔生理和医学奖。
现在NO/cGMP途径被视为是细胞生理和组织稳态的一个主要调节因子,其基本过程如下:NO合成酶(NOS)以精氨酸(Arg)为底物合成NO,并作为一种可以自由弥散的气体信使分子与细胞内的可溶性鸟苷酸环化酶(sGC)结合并激活之,后者又以GTP为底物合成环磷酸鸟苷(cGMP),cGMP作为一种第二信使再激活下游的酶系统(例如依赖cGMP的蛋白激酶1,cGK-1),从而引起细胞的生理效应。NOS有三类,分别是:神经元NOS(nNOS)、可诱导的NOS(iNOS)和内皮细胞NOS(eNOS)。这三种NOS的分布状况具体见表16-1。
Hess A等利用免疫组织化学技术发现可溶性鸟苷酸环化酶(sGC)定位于Corti器的感觉细胞、支持细胞、神经纤维,神经节细胞,螺旋韧带血管壁和螺旋缘上皮细胞。Fessenden等利用免疫细胞化学方法,发现sGC活性可在Hensen细胞、Deiters细胞中检测到,而在感觉细胞中检测不到。耳蜗中sGC还定位于螺旋韧带的周细胞和支配外毛细胞的神经纤维。Tian F等利用同样的方法,在Hensen细胞、Deiters细胞、柱细胞上检测到鸟苷酸环化酶依赖性的蛋白激酶-1 (cGK-1),并且认为这与sGC的分布一致。以上试验结果提示我们,神经冲动或其他刺激因素可以引起耳蜗内多种细胞合成NO,后者又作用于支持细胞和螺旋韧带的血管周细胞上的sGC,产生cGMP并进一步作用于cGK-1,以调节支持细胞生理和耳蜗的血液供应。
表16-1 一氧化氮合成酶在耳蜗的分布
(二)ATP/ NO/cGMP途径
NO/cGMP途径
如上所述,ATP和NO/cGMP都是耳蜗生理功能的重要调节因子。当我们把相关的研究综合起来,就可以发现以下规律:ATP在耳蜗中可以起到神经递质或神经调质的作用。当耳蜗受到声音刺激时,它可能会与传入或传出的神经递质如谷氨酸、乙酰胆碱、GABA共存并一同释放,ATP也可能会从血管纹的边缘细胞释放。由于在耳蜗中的多种细胞如内毛细胞、外毛细胞、支持细胞以及豚鼠耳蜗的侧壁和神经组织上都有ATP受体(嘌呤能受体)分布,因此ATP可以引起耳蜗内多种细胞内的[Ca2+]i升高。另一方面,许多的研究都表明NO/cGMP途径存在于耳蜗中并且参与耳蜗生理的调节。而在该途径中的关键酶-可溶性一氧化氮合成酶的激活需要细胞内的钙离子浓度升高。据此,我们推测在耳蜗中ATP和NO/cGMP之间可能有一定的相互作用。
在No/cGMP途径对豚鼠耳蜗的作用的研究中,我们向离体豚鼠的耳蜗内灌流一氧化氮供体二乙胺一氧化氮-亲核复合体(Di-ethylamine NONOate,DEA-NO),通过放射免疫的方法测定内耳cGMP的含量,结果显示:向即刻离体的豚鼠耳蜗内灌注DEA-NO可以显著地升高内耳组织中cGMP的含量,而预先灌注可溶性鸟苷酸环化酶的抑制剂1H-[1,2,4]草酸重氮[4,3-a]喹 啉(ODQ)10μmol/L/APL基础液,则可以抑制DEANO引起的cGMP浓度升高的效应。
啉(ODQ)10μmol/L/APL基础液,则可以抑制DEANO引起的cGMP浓度升高的效应。
当向耳蜗中灌流ATP或Ca2+载体A-23187,结果发现耳蜗组织中cGMP含量可以显著升高(图16-8),这一结果与我们的推测相符,当先灌流非选择性一氧化氮合酶抑制剂L-NNA或可溶性鸟苷酸环化酶的抑制剂ODQ然后再灌流ATP时,所测得的蜗轴平均cGMP含量则与空白对照组之间没有显著性差异,但与单独灌流ATP或A-23187组相比有显著性差异,即灌流了这两种抑制剂的试验组的蜗轴平均cGMP含量明显低于单独灌流ATP或A-23187组,也就是说,当抑制NOS或sGC时,ATP不再引起耳蜗组织中的cGMP合成量增加。
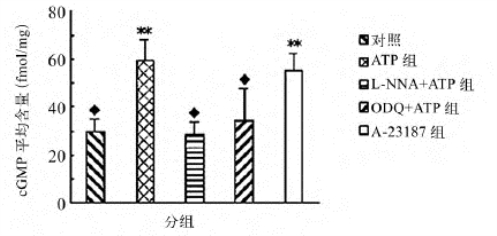
图16-8 各组耳蜗组织cGMP平均含量
经秩和检验与对照组相比较,**P<0.001,◆P>0.05;ATP组与A-23187组比较,P<0.05
综合上述文献和实验结果,我们认为,当ATP引起耳蜗中细胞内的Ca2+浓度增加时,NO/cGMP途径可能会被激活,其基本过程是ATP引起耳蜗组织中细胞的胞内Ca2+浓度升高,Ca2+与钙调蛋白(CaM)结合,激活了一氧化氮合酶,后者利用L-Arg作底物合成NO,NO进一步激活可溶性鸟苷酸环化酶,产生环磷酸鸟苷(cGMP),cGMP作为细胞内的第二信使再进一步激活cGMP依赖性的蛋白激酶,从而起到调节耳蜗的电位、微循环和细胞生理的作用。也就是说,在耳蜗内存在ATP/Ca2+-NO/cGMP途径,其基本过程如图16-9所示。
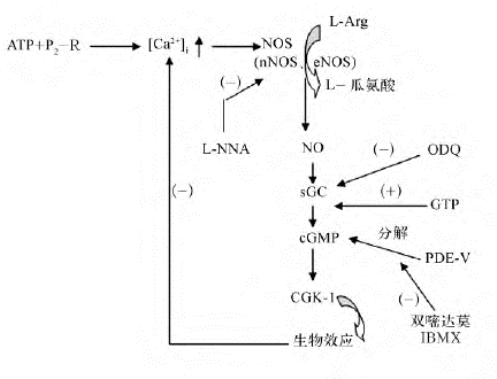
图16-9 耳蜗内的ATP/Ca2+-NO/cGMP途径
P2-R:ATP的P2受体;NOS:一氧化氮合成酶;NO:一氧化氮;L-Arg:L-精氨酸;L-NNA:左旋-NG-硝基精氨酸;ODQ:1H-[1,2,4]草酸重氮[4,3-a]喹 啉,可溶性鸟苷酸环化酶抑制剂;sGC:可溶性鸟苷酸环化酶;GTP:三磷酸鸟苷;cGMP:环磷酸鸟苷;PDE-V:磷酸二酯酶-V;CGK-1:cGMP依赖的蛋白激酶1;IBMX:磷酸二酯酶(PDE)的抑制剂;dipyridamole:双嘧达莫,一种特异性的磷酸二酯酶-V抑制剂
啉,可溶性鸟苷酸环化酶抑制剂;sGC:可溶性鸟苷酸环化酶;GTP:三磷酸鸟苷;cGMP:环磷酸鸟苷;PDE-V:磷酸二酯酶-V;CGK-1:cGMP依赖的蛋白激酶1;IBMX:磷酸二酯酶(PDE)的抑制剂;dipyridamole:双嘧达莫,一种特异性的磷酸二酯酶-V抑制剂
(三)ATP/Ca2+-NO/cGMP途径
ATP和NO/cGMP途径在耳蜗中的关系,对于调节耳蜗的生理功能具有重要意义。如前所述在耳蜗中Hensen细胞之间有丰富的缝隙连接。缝隙连接对于离子在耳蜗中的循环具有重要意义,使得信息可以在细胞之间进行快速的交换。编码缝隙连接蛋白的Connexin 26基因的突变与50%以上的重度遗传性感音神经性聋有关,这说明缝隙连接对于正常听觉功能非常重要。ATP引起Hensen细胞内的Ca2+浓度升高可以阻断缝隙连接之间的耦联,并引起耳蜗功能的变化。研究表明NO/cGMP途径可以减低在离体状态下由ATP引起的Hensen细胞内的Ca2+浓度升高,从而解除由ATP引起的Hensen细胞之间缝隙连接通讯的抑制,这无疑有利于维持耳蜗正常的功能。可见,Hensen细胞不仅仅是维持耳蜗Corti器的三维结构,它在调节耳蜗功能方面还有更重要的作用。cGMP引起细胞内Ca2+浓度下降的原因还不完全明确,一个可能的机制是:抑制细胞内磷脂酶C,降低磷酸肌醇IP3的含量。另一方面,ATP在耳蜗的多种细胞引起胞内Ca2+浓度升高,这样的胞内高Ca2+状态如果维持下去,将导致细胞的凋亡,而由Ca2+激活的NO/cGMP途径则可以降低细胞内的Ca2+浓度,有利于维持细胞的生理状态。从这个角度来看,NO/cGMP途径对ATP升高细胞内Ca2+浓度具有负反馈调节作用。
Fessenden和Schacht的研究表明,耳蜗中可溶性鸟苷酸环化酶(sGC)表达在Corti器的Hensen细胞和Deiters细胞以及血管纹的血管周细胞中,在内毛细胞、外毛细胞上则没有sGC表达,而NOS的表达部位是在柱细胞和与毛细胞形成突触的神经纤维。其他的研究显示NOS在内外毛细胞上也有表达,可见,NOS的表达部位与sGC的表达部位是不同的,也就是说,NO可以从柱细胞和支配毛细胞的神经纤维以及内外毛细胞合成并释放,弥散到支持细胞和血管纹血管周细胞,激活sGC而发挥作用。因此,他们认为NO/cGMP途径参与调节耳蜗的血流和支持细胞的生理和兴奋性。后来Tian以及Fessenden,Schacht又进一步对依赖cGMP的蛋白激酶-Ⅰ(cGK-Ⅰ)在耳蜗中的定位进行研究,发现在Corti器的Hensen细胞和Deiters细胞、柱细胞上检测到cGK-Ⅰ,这与sGC的表达部位一致。由于cGK-Ⅰ是cGMP的靶酶,因此,他们认为这一结果是对NO/cGMP途径参与调节耳蜗的血流和支持细胞的生理和兴奋性的理论的有力支持。
结合上述文献和实验结果,我们认为,ATP在耳蜗中可以引起多种细胞内的Ca2+浓度升高,被激活的NO/cGMP途径可以通过CGK-1的作用使其他的蛋白磷酸化,降低细胞内的Ca2+浓度,从而对ATP起到负反馈调节的作用。ATP和NO/cGMP途径在内耳中一方面调节细胞内的Ca2+浓度,另一方面也对整个的耳蜗功能共同起到调节作用,因此在耳蜗中存在ATP/Ca2+-NO/cGMP通路(图16-10)。当然,这一结果还需要进一步作载体试验加以证实,以便对耳蜗的生理调节网络有更深刻的认识。
在临床治疗突发性聋时,经常使用ATP、辅酶A等进行静脉滴注,认为这样可以改善耳蜗毛细胞的代谢。其实这样做缺乏循证医学的依据,在治疗效果上也不能证实使用了ATP和辅酶A的突发性聋患者的治愈率比不经任何治疗而自愈的患者比例更高。通过我们的研究,就大概可以理解这种现象。ATP和NO/cGMP途径除了调节耳蜗细胞内的Ca2+浓度外,当在体应用时,他们都会影响到耳蜗的电位和功能。当把高浓度的ATP(1 000μmol/L)灌注到耳蜗的外淋巴时,耳蜗的各种电位以及听神经的电活动均受到抑制。Kujawa等发现在使用不同强度的声音刺激时,ATP对耳蜗电位有着不同的影响。当把ATP灌注到豚鼠耳蜗的内淋巴液时,它能增强电诱发的耳声发射,同时对耳蜗内电位(EP)和耳蜗微音器电位(CM)产生显著的剂量依赖性的抑制作用,其起作用的阈值大约在2×10-14 mol,这种反应是可逆的,并且可被ATP的拮抗药苏拉明(suramin)和反应蓝(reactive blue)所阻断。ATP在耳蜗中的作用机制主要是与其P2U 和P2X受体结合从而影响到耳蜗内的淋巴液的离子平衡以及各种细胞的离子代谢的变化。可见,静脉滴注ATP和辅酶A对突发性聋的治疗作用和效果还有待进一步研究。

图16-10 耳蜗中的ATP/Ca2+-NO/cGMP通路
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















