蛋白质可根据基本结构形状将其分为纤维状蛋白、水溶性球形蛋白和膜蛋白,尽管每一种蛋白质的结构都是特异的,但各种蛋白质的结构具有一些普遍性特征。
(一)纤维状蛋白的结构与纤维状蛋白功能
纤维状蛋白(fibrous protein)的命名是因为它们组成了许多身体内的“纤维”。纤维状蛋白的一个共同作用是使相应结构具有强度和坚固性,并将它们维系在一起。大多数纤维状蛋白质的共同特点是具有伸长、拉长或丝状结构,这些蛋白质倾向于形成“杆状”结构,它们沿3个可能方向中的两个伸展,缺少球状蛋白质的紧凑性,这就使纤维状蛋白质的构建倾向于规则的、单一的、重复的二级结构,很少或根本没有由大范围相互作用引起的折叠。换句话说,它们缺少真正的三级结构,只有少数纤维蛋白如肌球蛋白和血纤维素蛋白是可溶的。
典型的纤维状蛋白质氨基酸组成分析表明(表8-2),这些蛋白质的氨基酸组成与球状蛋白质差异非常大,尤其是各种纤维状蛋白质之间氨基酸的组成都有差异。例如,胶原的脯氨酸含量在20%以上,而丝心蛋白的脯氨酸含量在1%以下;根据所含二级结构成分的情况,α-角蛋白的半胱氨酸含量在11.2%,而胶原和丝心蛋白中的半胱氨酸基本检测不到。每种纤维状蛋白的氨基酸组成都会影响到其二级结构的形成。在胶原中存在大量的羟化赖氨酸和脯氨酸。
表8-2 三类最常见的纤维状蛋白质的氨基酸组成(以摩尔百分比表示)
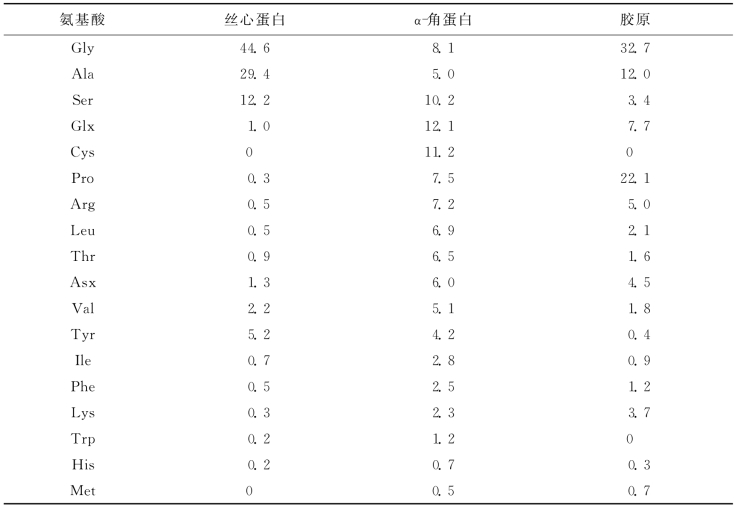
在纤维状蛋白的结构中可以看到三类不同类型:①以α螺旋为主,由2或3股α螺旋相互缠绕而成的超螺旋性质的所谓盘绕圈结构,这类结构在氨基酸序列上表现为由7个残基组成的周期性重复,其中的第一和第四个残基一般为疏水性残基,如纤维蛋白原、肌球蛋白、血影蛋白、α-角蛋白、神经丝等;②反向平行的β片层结构,如淀粉样纤维、蜘蛛或蚕产生的丝心蛋白;③以多肽链三股螺旋的排列为基础的结构,如胶原蛋白。
纤维状蛋白质广泛分布于所有动物细胞,所以纤维状蛋白质,如角蛋白或胶原的病变将引起严重的疾病,现在已知很多疾病的产生都是因为遗传性紊乱破坏了这些蛋白质的结构完整性。如Marfan综合征是结缔组织的遗传性疾病,它影响多种器官系统,包括骨骼、肺、眼、心脏和血管。Marfan综合征是由编码原纤蛋白基因的分子缺陷引起的。原纤蛋白是存在于结缔组织中的细胞外基质,在结缔组织中,原纤蛋白是伸展的原纤维的必要组分。微原纤维在皮肤、血管、软骨膜、肌腱以及眼的睫状小带中含量十分丰富,以弹性蛋白为基础的纤维形成了细胞外基质结构的一部分,使组织具有了弹性。对该纤维形态学和生化性质的分析表明,它含有一个主要由弹性蛋白构成的内部核心,以及一个主要由原纤蛋白构成的外周微原纤维层。人类具有两种高度同源的原纤蛋白——原纤蛋白-1和原纤蛋白-1的第一个突变体,在患有Marfan综合征的个体中陆续发现了50多种突变体。目前已知的大部分突变都是唯一的(即只存在于一个家庭中),从分子水平看,突变导致其中一个氨基酸残基被取代,扰乱了原纤蛋白表皮生长因子样(EGF)基序的结构组成。
美国著名排球运动员Flo Hyman就是一个Marfan综合征患者,一家报纸描述了看起来非常健康的运动员突然发病时的情景:“在第三场比赛中,Hyman被例行地换出场外,她坐在长凳上。几秒钟之后,她静静地滑落到地板上,躺在那里不动。她死了!”。很多Marfan综合征患者都比一般人高,四肢长,脊柱弯曲,近视以及特征性的胸廓畸形导致“鸡胸”,诸如这些表现不被重视,就会在某一天出现早死。从外貌上看,人们猜测Abraham Lincoln(美国第16任总统,1809-1865)和小提琴家Niccolo Paganini(1782-1840)均患有结缔组织病。
(二)水溶性球形蛋白
水溶性蛋白主要是一些球状蛋白(globular protein),形状近球形或椭球形,常含有几种类型的二级结构,并折叠成具有特定构象的三级结构,其多肽链折叠紧密,疏水的氨基酸侧链位于分子内部、亲水的侧链暴露在外部,因此在水中溶解性好。
1.肌红蛋白结构 肌红蛋白在蛋白质科学的历史上占据了一个关键的位置,它是于1958年第一个结构被确定的蛋白质,对肌红蛋白详细的晶体学研究提供了蛋白质的第一张三维结构图,并建立了许多决定二级和三级结构的基本规则(本科教材已有描述)。肌红蛋白折叠成一个极其紧凑的单条多肽链,大小约为4.5nm×3.5nm×2.5nm,是含有153个氨基酸的椭球形蛋白质。多肽链通过改变方向,有效折叠成一个紧凑的结构,使分子内部没有剩余空间,其中80%残基都处于α螺旋的构象。肌红蛋白的结构提供了蛋白质中α螺旋的第一个实验证据,并证实肽链是平面的、处于一个反式构象,且尺寸与Pauling预计的一样(图8-4)。肌红蛋白含有8个螺旋,标记为A,B,C,…,H。螺旋遇脯氨酸结构被破坏,如脯氨酸存在于B、C螺旋之间,E、F螺旋之间时。血红蛋白基团被包围在一个几乎全由非极性残基组成的狭缝中,有两个血红蛋白丙酸盐伸出分子表面与溶剂接触;两个组氨酸残基一个与铁接触即近侧组氨酸(F8),另一个为远侧组氨酸(E7)与铁中心的距离大一些。这种排列的结果是:铁不对称的构象使铁被拽出血红蛋白平面,朝向近侧组氨酸。

图8-4 肌红蛋白的结构
表示了α螺旋和血红蛋白基团。螺旋A及蛋白质的N端位于最显著的位置。肌红蛋白的命名:将螺旋标记为A~H,螺旋内的残基标记为F8、A2等
肌红蛋白的结构证实了蛋白质分子疏水侧链和亲水侧链的分配。蛋白质内部即血红蛋白基团周围的区域几乎全由疏水性残基组成,如亮氨酸、苯丙氨酸和缬氨酸等;而亲水性侧链则位于外部或与溶剂接触的表面。
2.血红蛋白结构 血红蛋白与肌红蛋白最明显的不同点在于它存在四级结构。成人Hb为α2β2四聚体。而胚胎早期时Hb为ζ2ε2四聚体,其中ζ和ε在结构上分别类同于α和β亚基;8周时为α2γ2四聚体,其中的γ类同于β亚基,其间还存在α2ε2和ζ2γ2两种类型。α2γ2四聚体直至胎儿出生前数周才由α2β2四聚体替代。通常成人血α中的Hb97%为HbA,2%为HbA2和1%HbF。现已知晓,所有Hbα和β类亚基基因都含有相同的外显子-内含子结构。即每一Hb亚基含有3个外显子,被两个内含子分隔。
Mb和Hbα、β亚基一级结构序列不同,但二级及三级结构十分相似,两者功能的不同与Hb四级结构关系密切,在Hb形成四级结构时,α1和β1之间、α2和β2之间分别有35个和19个残基参与非共价的连接,大部分是疏水作用力,但也有若干氢键和离子键。而α1-α2和β1-β2之间的接触很少,但是大部分是离子键参与。这些离子键在Hb和O2结合时全部断裂,与Hb运输氧的功能密切相关。
Mb或Hb每个亚基分别以非共价键方式结合一分子血红蛋白,它是使血液呈现红色的物质,也存在于细胞色素、某些氧化还原酶类如过氧化氢酶等其他蛋白质中。血红蛋白由原卟啉Ⅳ与Fe2+络合而成。Fe2+的最外层3d轨道上有6个电子,4个分别与4个吡咯环中的N原子相连,使Fe2+处于卟啉环同一平面,另2个3d层电子则可在卟啉环平面两侧,分别与Mb的F8的93位氨基酸咪唑基N配位和O2可逆结合(图8-5)。此时O2位置接近于E7节段的组氨酸残基,可见O2是处在Fe2+和远位组氨酸之间。某些小分子如CO、NO和H2S也能与Mb和Hb分子中的血红蛋白Fe2+第6个配位键结合,其亲和力较O2强。Mb和Hb中血红蛋白Fe2+也可被氧化为Fe3+,使之成为高铁Mb和高铁Hb,失去与氧结合的能力。
在体内Mb与O2结合的方式与Hb不同,前者的氧解离曲线为矩形双曲线形状,而后者为S性曲线,这是Mb和Hb不同分子结构所决定的。
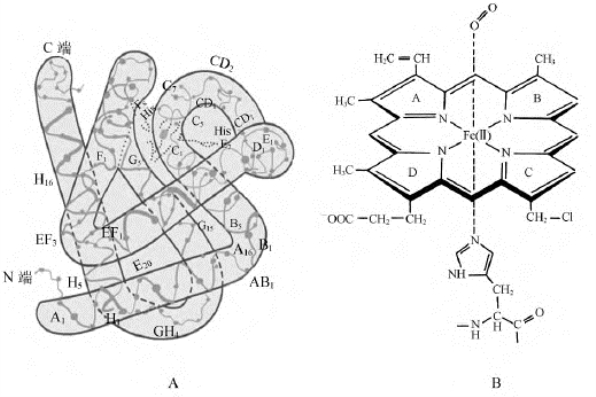
图8-5 Mb与氧的结合
A.氧合Mb;B.Fe2+-血红蛋白与氧结合
图8-6可见,当Y=0.5时,PO2等于P50,直线斜率n成Hill系数。Mb与O2结合时,呈直线,n=1,说明无协同作用。而Hb与O2结合时,呈S形曲线。当PO2很低时,曲线最初段的斜率接近1,其P50较高,提示与O2结合力较弱;随着PO2增加,中段曲线陡直上升,跨越Mb的直线后,形成与之平行的与O2高结合状态的末段直线,其斜率近等于1,但P50较起始段为小,说明Hb与O2的亲和力升高,有效数据表明第四个O2与Hb结合式的亲和力比第一个O2结合时高100倍。从S形曲线可见,随PO2由低到高改变,O2与Hb的结合也由低亲和力向高亲和力转变,加之一分子Hb可结合4分子O2,提示O2对Hb的结合有协同效应。
当Hb在生理pH条件下与O2结合时,引起构象变化,只是Hb的酸性增加,释出质子;同样,介质的pH降低或PCO2升高时也可使Hb对O2的亲和力下降,氧离曲线右移,这一现象Christian Bohr于1904年首次报道,被称为Bohr效应。Bohr效应主要是由于Hb与O2结合时某些基团的pKa值改变而释出H+所致。已知参与Bohr效应的有关基团是末端氨基、组氨酸和半胱氨酸残基的侧链,它们的pKa值接近于7,稍有变动即可改变其对H+的结合力。
此外,在Hb与O2结合时引起构象变化中,α链氨基末端缬氨酸的氨基与另一α链羧基末端精氨酸的羧基所形成的盐键断裂,以致末端氨基游离,结合H+的能力减弱,释放出H+,此种作用为Bohr效应提供25%的H+。PCO2增高时,CO2在红细胞中经碳酸酐酶催化,形成碳酸,而解离出H+,使pH降低,为Bohr效应提供H+。Hb还有运输CO2的作用,CO2与Hb亚基的氨基末端结合形成氨基甲酸Hb,此时也可是放出H+,从而影响对氧的亲和力。
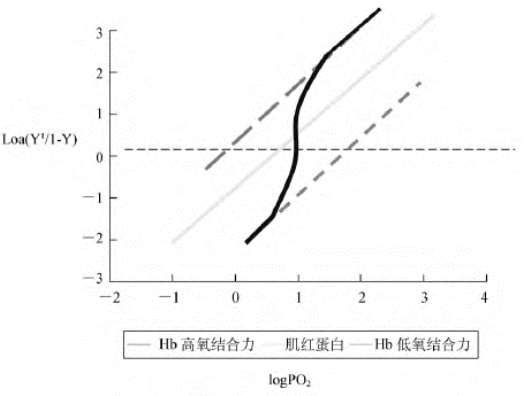
图8-6 Mb与Hb与氧结合的Hill
1921年,Joseph Barcroft观察到纯化的Hb对O2的亲和力远高于全血中的Hb,推测血液中存在某一物质可下调Hb与O2的亲和力。1967年Reinhold和Ruth Bensch证实了这一下调Hb与O2的亲和力的物质是2,3-二磷酸甘油酸(2,3-BPG)。2,3-BPG能与脱氧Hb 1∶1地结合,结合很亲密,降低了与O2的亲和力,使氧解离曲线右移,其中P50增大至3.5kPa,相比无BPG存在时的P50仅为0.13kPa要大的多。2,3-BPG主要结合在Hb四聚体的两个β亚基之间,通过BPG分子中的负电荷与Hb1位缬氨酸的氨基、2位组氨酸的咪唑基、92位赖氨酸残基的侧链氨基以及14位组氨酸的咪唑基相互作用,构成盐键使其构象稳定与紧张型的T态,从而降低了与O2的亲和力。
2,3-BPG具有体内不可缺少的生理作用,在动脉血中,PO2高达13.2kPa,此时的Hb的氧饱和度达95%,在静脉血中,PO2仅为4kPa,Hb的氧饱和度仅为55%。当Hb经由组织可卸下40%的O2。BPG是红细胞内糖酵解的BPG支路的产物,在缺氧或相对缺氧时,BPG的产生增加,当BPG与氧结合后,可使氧离曲线右移,增加氧合Hb的氧释放,为氧供不足的组织提供更多的氧。
BPG还可以起到帮助胎儿从母体血循环中获得更多氧的作用,胎儿的氧经胎盘来自母体血液,胎儿的Hb为α2γ2,其中γ链143位为不带电荷的丝氨酸,而β链的143位为带正电荷的组氨酸残基,使BPG与成人Hb的结合比胎儿Hb更紧密,同时胎儿和母体血液中的BPG浓度相仿,这样胎儿Hb与O2的亲和力比成人Hb为高,从而使胎儿从母体血液中取得更多的氧。
在体内Hb与O2或CO2可逆结合,起到运输O2和CO2的作用。除O2和CO2作为配体外,今年又发现NO可与Hb的血红蛋白铁或β链第93位半胱氨酸残基结合。在体内NO可迅速地与脱氧Hb结合形成复合物,也可与氧合Hb结合产生高铁Hb和硝酸盐。以往发现的Hb与O2结合时发生构象改变从而增加Cysβ93对试剂的反应性,其生理意义并不清楚,现已了解Hb的S-亚硝基化速率严格依赖于构象状态。处于R态的氧合Hb其Cysβ93的S-亚硝基化远快于T态的脱氧Hb。此外,在碱性条件下Cysβ93残基暴露,无论R态或T态,Hb的S-亚硝基化速率均增加。Hb的Cysβ93是很保守的氨基酸残基,在哺乳动物和鸟类中均存在,它不仅影响了与O2的亲和力和血红蛋白铁的氧还潜能,又可以转导NO信号至血管壁。
体内存在S-亚硝基化Hb和血红蛋白铁亚硝基化Hb两种形式,前者仅存在于动脉血,后者存在于动脉血和静脉血。当Hb在肺部进行氧合作用的同时也被S-亚硝基化形成SNOHb,通过体循环运输至静脉时释放出NO,起到舒张外周动脉调节血压的作用。
3.血红蛋白病 绝大多数Hb基因结构变异是单个碱基突变。
(1)单个碱基替代导致单个氨基酸替代,如镰刀状红细胞贫血。
(2)密码子的缺失和插入,如Hb Grady,即在α链第119位后插入苯丙-苏-脯3个氨基酸。
(3)移码突变,如Hb Wayne,即缺失一个碱基后导致后续的阅读框因此位移而产生异常肽链。
(4)终止密码突变,如Hb Constant Spring,即α基因第142位终止密码子突变导致α肽链延长为172个氨基酸。
(5)融合基因,如Hb Lepore,其非α链是由于δ与β基因融合而产生δβ链替代。
4.血红蛋白变构调节的作用机制 变构调节是指一个配体与蛋白质某一位点结合影响另一配体与另一位点的结合。若配体相同为同促效应;若配体不相同成为异促效应。根据产生协同效应为促进还是减退,又可分为同促正协同效应、同促负协同效应。Hb既有同促效应又有异促效应。
(1)共变模式:释放蛋白质变构机制的共变模式是Monod等于1965年提出的,因而也成为MWC模式。此模式的要点为:①变构蛋白应是由对称的原聚体组成;②每一原聚体至少有两种构象即T(紧张)态和R(松弛)态,不管有否配体与蛋白质结合,此两种构象处于动态平衡中;③配体与两种构象均能结合,只有构象变化才能改变原聚体与配体的结合能力;④在构象变化过程中蛋白质分子的对称性始终保持,也即在一个蛋白质分子中不可能同时存在T和R态的两种原聚体,它们是“有和无”的关系。
(2)序变模式:上述共变模式基本上能为许多蛋白质与配体结合性质提供最为合理的解释。但是对于共变模式的所有蛋白质都保持单体的对称性这一点难以置信。特别是已证实的负同促效应很难用单体来解释,当然正同促效应是完全能够解释的。其实共变模式是雷同于“锁—钥学说”,将配体与蛋白质的结合视为强硬的结构互补关系。Daniel Koshland将诱导契合学说用于揭示变构效应,提出了序变模式。序变模式认为,配体的结合诱导了一个亚基构象的变化,随之影响邻近亚基的构象而引起结合配体的协同效应,也即亚基的构象改变是逐一发生的。
(三)膜蛋白
细胞中有大量蛋白(包括与能量产生有关的蛋白、跨膜物质转运蛋白和信号转导蛋白等)整合在外表面亲水、内部疏水的磷脂双层膜(包括细胞质膜和细胞内膜系统)中,即膜蛋白(membrane protein),它们的结构不同于存在于水溶液中的球形蛋白,1984年德国科学家Deisenhofer等成功地测定了从红假单胞菌细胞质膜上获得的光合作用反应中心复合体的晶体衍射结构,该工作使我们第一次看到了一个来自细胞膜的蛋白质分子的空间结构,此研究使结构生物学取得了巨大成就。因此,Deisenhofer、Hubert、Michael三位科学家获得了1988年的诺贝尔化学奖。在过去的20年里,膜蛋白已经被广泛地作为一种模型系统,来研究能量转换、内在膜蛋白的结构与组装,以及支配生物学电子传递速率和效率的因子等。
膜蛋白的插膜部分的表面带有较多的疏水残基(而水溶性球状蛋白的表面却带有较多的亲水残基),其跨膜主要是通过一个或多个螺旋或β片层进行的。图8-7示典型的细胞膜的组织结构。研究细胞膜的结构最好的模型是红细胞膜,因为血液中能够获取较大量的红细胞(也就是细胞膜);这些细胞膜可以很容易通过离心获得;它们还可重新合成不含血红蛋白的无色颗粒。使用这个模型鉴定出了两类主要的膜蛋白:第一类与膜结合较弱,通过提高盐浓度等粗略的洗涤处理就能将其与膜分离,即外在或周边蛋白;第二类需要用去污剂、有机溶剂、酶或者机械分级分离等非常极端手段才能将其分离,即内在蛋白。关于膜蛋白还有很多待深入研究的问题,表中列举了一些膜蛋白(表8-3)。
表8-3 在PDB中一些膜蛋白的结构(大部分结构是由X射线晶体学获得的)
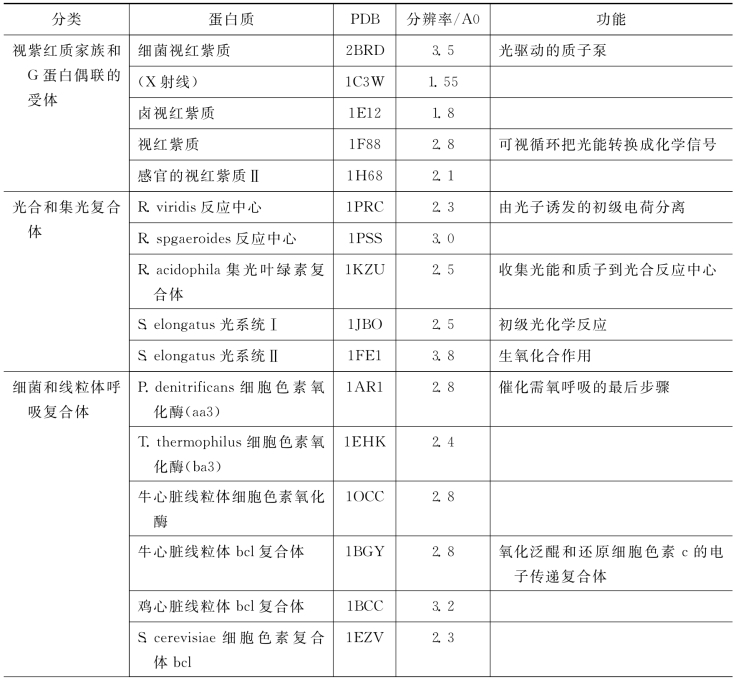
(续 表)
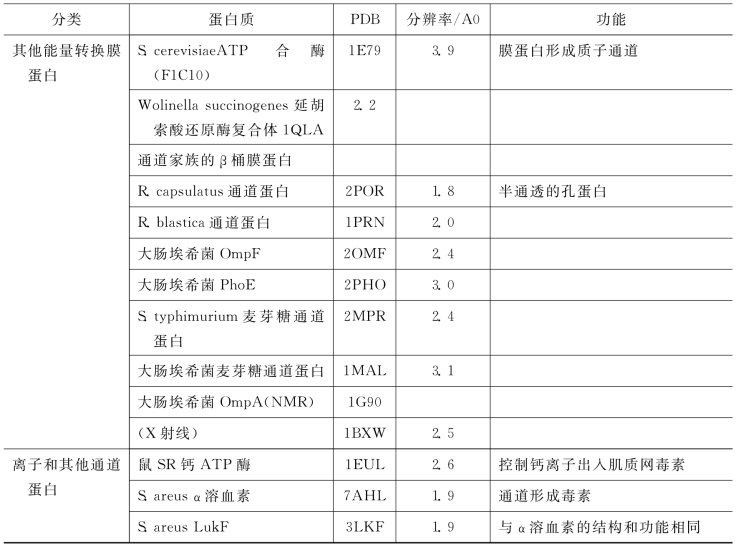
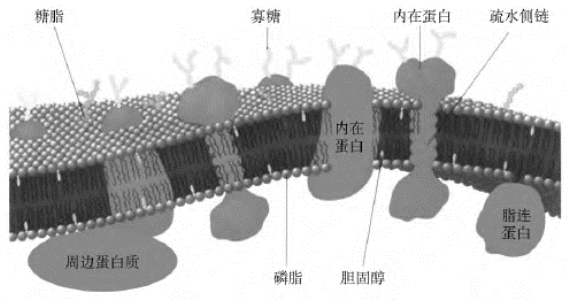
图8-7 典型的细胞膜组织结构
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















