任务5 动物细胞的大规模培养
近数十年来,由于人类对生长激素、干扰素、单克隆抗体、疫苗及白细胞介素等生物制品的需求猛增,以传统的生物化学技术从动物组织获取生物制品,因产量少、质量不均且不易控制稳定,已远远不能满足这一需求。
随着细胞培养的原理与方法日臻完善,能进行大规模细胞培养用的生物反应器种类越来越多,规模也越来越大。人工条件下(pH值、温度、溶解氧等),在细胞生物反应器中高密度大量培养动物细胞用于生产生物制品的技术称为动物细胞大规模培养技术。
一、动物细胞大规模培养应用简介
动物细胞是一种无细胞壁的真核细胞,生长缓慢,对培养环境十分敏感。采用传统的生物化工技术进行动物细胞大量培养,除了要满足培养过程必需的营养要求外,有必要建立合理的控制模型,进行pH值和溶解氧(DO)的最佳控制。
细胞生物反应器就是可以大规模体外培养哺乳类动物细胞的装置。通过微机有序地定量地控制加入动物细胞培养罐内的空气、氧气、氮气和二氧化碳四种气体的流量,使其保持最佳的比例来控制细胞培养液中的pH值和溶解氧水平,使系统始终处于最佳状态,以满足动物细胞的生长对pH值和溶解氧的需要。如主要采用改变通入培养罐内气体中氧气和氮气的比例来实现控制DO值的目的,提高或达到一定的溶解氧水平,采用二氧化碳-碳酸氢钠(CO2-NaHCO3)缓冲液来控制培养液的pH值。
20世纪60—70年代,可用于大规模培养动物细胞的微载体培养系统和中空纤维细胞培养技术诞生了。几十年来,大规模体外培养技术已经有了很大发展,从使用转瓶、贴壁细胞培养,发展为利用生物反应器进行大规模细胞培养,彻底解决了第一代细胞培养技术的核心问题——难以产业化(规模化)生产,不但工艺上能满足大规模制备产品的要求,还能保证产品质量的均一性,质量控制简便易行。
由于动物细胞培养技术在规模和可靠性方面都不断发展,且从中得到的蛋白质也被证明是安全、有效的,因此人们对动物细胞培养的态度已经发生了改变。许多人用和兽用的重要蛋白质药物和疫苗,尤其是对那些相对较大、较复杂或糖基化的蛋白质来说,动物细胞培养是首选的生产方式。20世纪60年代初,英国AVRI研究所在贴壁细胞系BHK21中将口蹄疫病毒培养成功后,从最初的200mL和800mL玻璃容器开始,很快就放大到30L和100L不锈钢罐的培养规模。1967年以后,英国Wellcome集团分布于欧洲、非洲和南美洲8个国家的生产厂,应用此项技术工业化生产口蹄疫疫苗和兽用狂犬病疫苗,Wellcome公司目前不仅掌握了5000L罐的细胞大规模培养技术,还采用8000L Namalwa细胞生产了α干扰素。此外,英国Celltech公司可以用气升式生物反应器生产α干扰素、β干扰素和γ干扰素,用无血清培养液在10000L气升式生物反应器中培养杂交瘤细胞生产单克隆抗体。美国Endotronic公司用中空纤维生物反应器大规模培养动物细胞,生产出免疫球蛋白G、A、M和尿激酶、人生长激素等。
目前大规模体外培养技术已实现商业化的产品有口蹄疫疫苗、狂犬病疫苗、牛白血病病毒疫苗、脊髓灰质炎病毒疫苗、乙型肝炎疫苗、疱疹病毒疫苗、巨细胞病毒疫苗、α干扰素、β干扰素、γ干扰素、血纤维蛋白溶酶原激活剂、凝血因子Ⅷ和Ⅸ、促红细胞素、松弛素、生长激素、蛋白C、免疫球蛋白、尿激酶、激肽释放酶及200种单克隆抗体等。
二、动物细胞大规模培养常用方法
动物细胞大规模培养的生物反应器要求控制条件精确、方便可行,因此了解在生物反应器中动物细胞的生长特性、不同细胞类型所需的生存条件与工艺控制参量等,对于大规模培养操作非常重要,下面先介绍动物细胞大规模培养的基础知识。
(一)动物细胞培养基础知识
1.生长特性
在动物细胞大规模培养中,绝大多数细胞所具有的生长特性如下:
(1)细胞生长缓慢,易污染,培养需用抗生素;
(2)细胞大,无细胞壁,机械强度低,环境适应性差;
(3)需氧少,不耐受强力通风与搅拌;
(4)群体生长效应,贴壁生长;
(5)培养产品分布于细胞内外,分离纯化成本高;
(6)原代培养细胞一般繁殖50代即退化死亡。
2.细胞培养类型
依据在体外培养时对生长基质依赖性的差异,动物细胞可分为以下两类。
(1)贴壁依赖性细胞:需要附着于带适量电荷的固体或半固体表面才能生长的细胞。大多数动物细胞,包括非淋巴组织细胞和许多异倍体细胞均属于这一类。
(2)非贴壁依赖性细胞:无须附着于固相表面即可生长的细胞。包括血液、淋巴组织细胞、许多肿瘤细胞及某些转化细胞。
3.培养需要的温度
培养细胞的最适温度相当于各种细胞或组织取材时机体的正常温度。人和哺乳动物细胞培养的最适温度为35~37℃。偏离这一温度,细胞正常的代谢和生长将会受到影响,甚至导致细胞死亡。总的来说,培养细胞对低温的耐受力比对高温的高。温度不超过39℃时,细胞代谢强度与温度成正比;细胞培养若置于39~40℃环境中1h,即受到一定损伤,但仍能恢复,当培养物恢复到初始的培养温度时,细胞原有的形态和代谢也随之恢复到原有水平;当温度达43℃以上时,许多细胞将死亡。
(二)大规模培养方法
根据动物细胞的类型和需要的条件,可采用贴壁培养、悬浮培养和固定化培养等三种培养方法进行大规模培养。
1.贴壁培养
贴壁培养为细胞贴附在一定的固相表面进行的培养。
(1)生长特性。
贴壁依赖性细胞在培养时要贴附于培养器皿(瓶)壁上,细胞一经贴壁就迅速铺展,然后开始有丝分裂,并很快进入对数生长期。一般数天后就铺满培养表面,并形成致密的细胞单层。
(2)贴壁培养的优点。
①容易更换培养液。细胞紧密黏附于固相表面,可直接倾去旧培养液,清洗后直接加入新培养液。
②容易采用灌注培养,从而达到提高细胞密度的目的。因细胞固定于表面,不需过滤系统。
③当细胞贴附于生长基质时,很多细胞将更有效地表达一种产品。
④同一设备可采用不同的培养液与细胞比。
⑤适用于所有类型的细胞。
(3)贴壁培养的缺点。
与悬浮培养相比,贴壁培养也具有一些缺点:
①扩大培养比较困难,投资大;
②占地面积大;
③不能有效监测细胞的生长。
(4)细胞贴壁表面。
要求细胞贴壁表面具有净阳电荷和高度表面活性,对微载体而言还要求具有一定电荷密度;若为有机物表面,必须具有亲水性,并带阳电荷。
(5)贴壁培养系统。
贴壁培养系统主要有转瓶、中空纤维、玻璃珠、微载体系统等。
①转瓶培养系统:转瓶培养一般用于少量培养到大规模培养的过渡阶段,或作为生物反应器接种细胞准备的一条途径。细胞接种在旋转的圆筒形培养器——转瓶中,培养过程中转瓶不断旋转,使细胞交替接触培养液和空气,从而提供较好的传质和传热条件。转瓶培养具有结构简单,投资少,技术成熟,重复性好,放大只需简单地增加转瓶数量等优点。但转瓶培养也有其缺点:劳动强度大,占地面积大,单位体积提供细胞生长的表面积小,细胞生长密度低,培养时不便于监测和控制环境条件等。现在使用的转瓶培养系统包括CO2培养箱和转瓶机两类。
②贴壁培养式生物反应器:细胞贴附于固定的表面生长,不因为搅拌而跟随培养液一起流动,因此比较容易更换培养液,不需要特殊的分离细胞和培养液的设备,可以采用灌流培养获得高细胞密度,能有效地获得一种产品,但扩大规模较难,不能直接监控细胞的生长情况,故多用于制备用量较小、价值高的生物药品。
CelliGen、CelliGen PlusTM和Bioflo3000反应器是常用的贴壁培养式生物反应器,用于细胞贴壁培养时可用篮式搅拌系统和圆盘状载体。圆盘状载体是直径为6mm的无纺聚酯纤维圆片,具有很高的表面积与体积比,有利于获得高细胞密度。篮式搅拌系统和载体培养是目前贴壁细胞培养使用最多的方式,可用于杂交瘤细胞、HeLa细胞、293细胞、CHO细胞及其他细胞的培养。用此种方式培养细胞,细胞接种后贴壁快。
2.悬浮培养
悬浮培养为细胞在反应器中自由悬浮生长的培养,主要用于非贴壁依赖性细胞(如杂交瘤细胞等)的培养,它是在微生物发酵的基础上发展起来的。
无血清悬浮培养是用已知人源或动物来源的蛋白质或激素代替动物血清的一种细胞培养方式,它能减少后期纯化工作,提高产品质量,正逐渐成为动物细胞大规模培养研究的新方向。
3.固定化培养
固定化培养是将动物细胞与水不溶性载体结合起来,再进行培养。它对于上述两大类细胞都适用,具有细胞生长密度高、抗剪切力和抗污染能力强等优点,细胞易于与产物分开,有利于产物分离纯化。制备方法很多,包括吸附法、共价贴附法、离子/共价交联法、包埋法、微囊法等。
(1)吸附法。
吸附法是用固体吸附剂将细胞吸附在其表面而使细胞固定化的方法。此法操作简便、条件温和,是动物细胞固定化中最早研究使用的方法。其缺点是载体的负荷能力低,细胞易脱落。微载体培养和中空纤维培养是该方法的代表。
(2)共价贴附法。
共价贴附法是利用共价键将动物细胞与固相载体结合的固定化方法。此法可减少细胞的泄漏,但须引入化学试剂,对细胞活性有影响,且贴附导致扩散限制小,细胞得不到保护。
(3)离子/共价交联法。
用双功能试剂处理细胞悬浮液,会在细胞间形成桥而产生交联作用,此固定化细胞的方法称为离子/共价交联法。交联试剂会使一些细胞死亡,也会产生扩散限制。
(4)包埋法。
包埋法是将细胞包埋在多孔载体内部制成固定化细胞的方法。其优点是步骤简单、条件温和、负荷量大、细胞泄漏少、抗机械剪切。其缺点是产生扩散限制,并非所有细胞都处于最佳基质浓度,且大分子基质不能渗透到高聚物网络内部。一般适用于非贴壁依赖性细胞的固定化,常用载体为多孔凝胶,如琼脂糖凝胶、海藻酸钙凝胶和血纤维蛋白。
(5)微囊法。
微囊法是用一层亲水的半透膜将细胞包围在珠状的微囊里,使细胞不能逸出,但小分子物质及营养物质可自由出入半透膜的方法。囊内是一种微小的培养环境,与液体培养相似,能保护细胞少受损伤,故细胞生长好、密度高。微囊直径以200~400μm为宜。制备微囊时注意以下几个方面:
①应温和、快速、不损伤细胞,尽量在液体和生理条件下操作;
②所用试剂和膜材料对细胞无毒害;
③膜的孔径可控制,必须让营养物和代谢物自由通过;
④膜应有足够的机械强度以抵抗培养中的搅拌作用。
(三)抗凋亡策略在细胞大规模培养中的应用
在动物细胞大规模培养过程中,细胞凋亡在细胞死亡中占主要部分。最近研究显示,在大规模培养生物反应器中,细胞的死亡中80%是由凋亡所导致的,而不是以前所认为的坏死。在动物细胞大规模培养中,细胞死亡是维持细胞高活性和高密度的最大障碍,因此从理论上讲减少凋亡,防止死亡或延长细胞寿命,可以极大提高生物反应器生产重组蛋白的产量和经济效益。
细胞凋亡由一系列基因精确地调控,是多细胞生物发育和维持稳态所必需的生理活动。已知凋亡的最终执行者是Caspase家族,它们均为半胱氨酸蛋白酶,各识别一个4氨基酸序列,并在识别序列C端天冬氨酸残基处将底物切断。Caspase含有可被自身识别的序列,可以切割活化自身而导致信号放大,并作用于下游Caspase成员,从而形成Caspase家族的级联放大,最终作用于效应蛋白,引起细胞凋亡。所以在大规模培养时干扰细胞在培养中的凋亡,提高细胞特异性抵抗压力的能力,有利于提高细胞的培养密度、延长细胞的培养周期,从而可使目标产品的产量提高2~3倍。
(1)营养物质抗凋亡。
在常规生物反应器中,营养物质耗竭或缺乏培养基中特殊的生长因子可引起凋亡,例如血清、糖或特殊氨基酸耗竭。在培养基中添加氨基酸或其他关键营养物质可抑制凋亡,延长培养时间从而提高产品的产量。大规模培养中细胞凋亡主要由于营养物质的耗竭或代谢产物的堆积,如谷氨酰胺的耗竭是最常见的凋亡原因,而且凋亡一旦发生,补加谷氨酰胺已不能逆转。另外,动物细胞在无血清、无蛋白培养基中进行培养时,细胞变得更为脆弱,更容易发生凋亡。
(2)基因抗凋亡。
可对与凋亡相关的一系列基因产物进行正、负向的调控,因此可通过导入相应基因来调节细胞凋亡。Bcl-2基因是目前最为有效的抗凋亡基因,在多种细胞系中均表现出很强的抗凋亡活性。
(3)化学方法抗凋亡。
凋亡发生时细胞许多部位发生生化物质的改变,有些变化(如改变细胞氧化还原条件产生活性氧)发生在凋亡信号阶段,其他的(如破坏线粒体膜电位、激活Caspase)则发生在凋亡效应阶段,这在绝大多数细胞死亡中是相同的。因此,阻止这些生化物质的改变可能阻止、至少延迟细胞凋亡的发生,运用化学物质抑制信号、效应阶段的发生,被认为是抗调亡策略之一。
三、细胞大规模培养的操作方式
细胞大规模培养的操作方式可分为分批式培养、流加式培养、半连续式培养、连续式培养、灌注式培养和细胞工厂培养六种。
(一)分批式培养
1.分批式培养的概念
分批式培养是细胞大规模培养发展进程中较早采用的方式,也是其他操作方式的基础。该方式是采用机械搅拌式生物反应器,将细胞扩大培养后,一次性转入生物反应器内进行培养,在培养过程中其体积不变,不添加其他成分,待细胞增长、产物形成和积累到适当的时期,一次性收获细胞、产物、培养基的操作方式。在分批培养过程中,细胞的生长分为五个阶段:延滞期、对数生长期、减速期、平台期和衰退期。培养周期多为3~5d,细胞生长动力学表现为细胞先经历对数生长期(48~72h),细胞密度达到最高值后,由于营养物质耗竭或代谢毒副产物的积累,细胞生长进入衰退期进而死亡,表现出典型的周期性。收获产物通常是在细胞快要死亡时或已经死亡后进行。
2.分批式培养的特点
分批式培养具有以下特点。
(1)操作简单。培养周期短,染菌和细胞突变的风险小。反应器系统属于封闭式,培养过程中与外部环境没有物料交换,除了控制温度、pH值和通气外,不进行其他任何控制,因此操作简单,容易掌握。
(2)可直观地反映细胞生长代谢的过程。因培养期间细胞生长代谢是在一个相对固定的营养环境内,不添加任何营养成分,因此可直观地反映细胞生长代谢的过程,是确定工艺基础条件或“小试”研究常用的手段。
(3)可直接放大。由于培养过程工艺简单,对设备和控制的要求较低,设备的通用性强,反应器参数的放大原理和过程控制较其他培养系统的较易理解和掌握。在工业化生产中,分批式培养操作是传统的、常用的方法,Genetech公司采用的此类工业反应器规模可达12000L。
(二)流加式培养
1.流加式培养的概念
流加式培养是在分批式培养的基础上,采用机械搅拌式生物反应器悬浮培养细胞或以悬浮微载体培养贴壁细胞。细胞初始接种的培养基体积一般为终体积的1/3~1/2,在培养过程中根据细胞对营养物质的不断消耗和需求,流加浓缩的营养物或培养基,从而使细胞持续生长至较高的密度,目标产品浓度达到较高的水平,整个培养过程没有流出或回收,通常在细胞进入衰退期或衰退期后终止、回收整个反应体系,分离细胞和细胞碎片,浓缩、纯化目标蛋白质。
2.流加式培养的特点
流加式培养具有以下特点。
(1)流加式培养需根据细胞生长速率、营养物消耗和代谢产物抑制情况,流加浓缩的营养培养基。流加的速率与消耗的速率应相等,按底物浓度控制相应的流加过程,保证合理的培养环境与较低的代谢产物抑制水平。
(2)培养过程以低稀释率流加,细胞在培养系统中停留时间较长,总细胞密度较高,产物浓度较高。
(3)研究流加式培养过程须掌握细胞生长动力学、能量代谢动力学,研究细胞环境变化时的瞬间行为。流加式培养细胞培养基的设计和培养条件与环境的优化,是整个培养工艺中的主要内容。
(4)在工业化生产中,悬浮式流加培养工艺参数的放大原理和过程控制,比其他培养系统的较易理解和掌握,可采用工艺参数直接放大。
流加式培养是当前动物细胞培养中主要的培养工艺,也是近年来动物细胞大规模培养研究的热点。流加式培养中的关键技术是基础培养基和流加浓缩的营养培养基。通常进行流加的时间多在对数生长后期,在细胞进入衰退期之前,添加高浓度的营养物质。可以添加一次,也可添加多次,为了追求更高的细胞密度往往需要添加一次以上,直至细胞密度不再提高;可进行脉冲式添加,也可以较低的速率缓慢添加,但为了尽可能地维持相对稳定的营养物质环境,后者采用得较多;添加的成分比较多,凡是促细胞生长的物质均可以进行添加。流加的总体原则是维持细胞生长相对稳定的培养环境,营养成分既不会过剩而产生大量的代谢副产物,造成营养利用效率下降,也不会缺乏而导致细胞生长受到抑制或死亡。
3.流加工艺中的营养成分
(1)葡萄糖。
葡萄糖是细胞的供能物质和主要的碳源物质,但当其浓度较高时会产生大量的代谢产物乳酸,因而需要对其浓度进行控制,以足够维持细胞生长而不至于产生大量的副产物的浓度为佳。
(2)谷氨酰胺。
谷氨酰胺是细胞的供能物质和主要的氮源物质,但当其浓度较高时会产生大量的代谢产物氨,因而也需要对其浓度进行控制,以足够维持细胞生长而不至于产生大量的副产物的浓度为佳。如果谷氨酰胺耗竭,也会产生细胞凋亡,而且凋亡一旦发生,补加谷氨酰胺已不能逆转。
(3)氨基酸、维生素及其他营养成分。
主要包括营养必需氨基酸、营养非必需氨基酸、一些特殊的氨基酸(如羟脯氨酸、羧基谷氨酸和磷酸丝氨酸),此外还包括其他营养成分如胆碱、生长因子。添加的氨基酸多为左旋氨基酸,因而多以盐或前体的形式代替单分子氨基酸,或者以四肽或短肽的形式添加。在进行添加时,不溶性氨基酸(如胱氨酸、酪氨酸和色氨酸)只在中性时部分溶解,可采用浆液的形式进行脉冲式添加;其他的可溶性氨基酸以溶液的形式用蠕动泵缓慢流加。
4.流加式培养的类型
流加式培养分为以下两种类型。
(1)单一补料分批式培养。
单一补料分批式培养是在培养开始时投入一定量的基础培养液,培养到一定时期,开始连续补加浓缩营养物质,直到培养液体积达到生物反应器的最大操作容积,停止补加,最后将细胞培养液一次性全部放出。该操作方式受到生物反应器操作容积的限制,培养周期只能控制在较短的时间内。
(2)反复补料分批式培养。
反复补料分批式培养是在单一补料分批式培养操作的基础上,每隔一定时间按一定比例放出一部分培养液,使培养液体积始终不超过生物反应器的最大操作容积,从而在理论上可以延长培养周期,直至培养效率下降,才将培养液全部放出。
(三)半连续式培养
1.半连续式培养的概念
半连续式培养又称为重复分批式培养或换液培养。它采用机械搅拌式生物反应器的悬浮培养形式。在细胞增长和产物形成过程中,每隔一段时间,从中取出部分培养物,再用新的培养液补足到原有体积,使生物反应器内的总体积不变。
这种类型的操作是将细胞接种于一定体积的培养基,让其生长至一定的密度,在细胞生长至最大密度之前,用新鲜的培养基稀释培养物,每次稀释至生物反应器培养体积的1/2~3/4,以维持细胞的指数生长状态,随着稀释率的增加培养体积逐步增加。或者在细胞增长和产物形成过程中,每隔一定时间,定期取出部分培养物或条件培养基,或是连同细胞、载体一起取出,并补加细胞、载体或新鲜的培养基,然后继续进行培养的一种操作模式。剩余的培养物可作为种子继续培养,从而可维持反复培养,而不需反应器的清洗、消毒等一系列复杂的操作。在半连续式培养操作中,由于细胞适应了生物反应器的培养环境和相当高的接种量,经过几次的稀释、换液培养过程,细胞密度常常会提高。
2.半连续式培养的特点
半连续式培养具有以下特点:
(1)培养物的体积逐步增加;
(2)可进行多次收获;
(3)细胞可持续指数生长,并可保持产物和细胞浓度在一较高的水平,培养过程可延续很长时间。
该操作方式操作简便,生产效率高,可长时期进行生产,反复收获产品,可使细胞密度和产品产量一直保持在较高的水平,因而在动物细胞培养和药品生产中被广泛应用。
(四)连续式培养
1.连续式培养的概念
连续式培养是一种常见的悬浮培养模式,所使用的生物反应器多数是搅拌式生物反应器,也可以是管式生物反应器。连续式培养是将细胞接种于一定体积的培养基后,为了防止衰退期的出现,在细胞达到最大密度之前,以一定速度向生物反应器中连续添加新鲜培养基,含有细胞的培养物同时以相同的速度连续从生物反应器流出,以保持培养体积的恒定。从理论上讲,该过程可无限延续下去。
2.连续式培养的优点
连续式培养具有以下优点:
(1)细胞维持指数增长;
(2)产物体积不断增长;
(3)可控制衰退期与下降期。
连续式培养的优点是生物反应器的培养状态可以达到恒定,细胞在稳定状态下生长,可有效地延长分批培养中的对数生长期。在稳定状态下,细胞所处的环境条件如营养物质浓度、产物浓度、pH值可保持恒定,细胞浓度以及细胞比生长速率可保持不变。细胞很少受到培养环境变化带来的生理影响,特别是生物反应器内主要营养物质葡萄糖和谷氨酰胺维持在一个较低的水平,从而使它们的利用效率提高,有害产物积累有所减少。然而在高的稀释率下,虽然死细胞和细胞碎片被及时清除,可是细胞和产物被不断地稀释,造成营养物质利用率、细胞增长速率和产物生成速率低下。
3.连续式培养的缺点
连续式培养的缺点如下:
(1)由于是开放式操作,加上培养周期较长,容易造成污染;
(2)在长周期的连续式培养中,细胞的生长特性以及分泌产物容易变异;
(3)对设备、仪器的控制技术要求较高。
(五)灌流式培养
1.灌流式培养的概念
灌流式培养是把细胞和培养基一起加入生物反应器后,在细胞增长和产物形成过程中,不断地将部分条件培养基取出,同时又连续不断地灌注新的培养基。它与半连续式培养操作的不同之处在于取出部分条件培养基时,绝大部分细胞均保留在生物反应器内,而半连续式培养在取出培养物的同时也取出了部分细胞。
灌流式培养使用的生物反应器主要有两种。一种是用搅拌式生物反应器悬浮培养细胞,这种生物反应器必须具有细胞截留装置,细胞截留系统开始多采用微孔膜过滤或旋转膜系统,最近开发的有各种形式的沉降系统或透析系统。中空纤维生物反应器是连续灌流操作常用的一种。它采用的中空纤维半透膜可透过相对分子质量较小的产物和底物,截留细胞和相对分子质量较大的产物,在连续灌流过程中将绝大部分细胞截留在生物反应器内。近年来中空纤维生物反应器被广泛应用于产物分泌性动物细胞的生产,主要用于培养杂交瘤细胞生产单克隆抗体。
另一种是固定床或流化床生物反应器。固定床生物反应器是在反应器中装配固定的篮筐,中间装填聚酯纤维载体,细胞可附着在载体上生长,也可固定在载体纤维之间,靠搅拌中产生的负压迫使培养基不断流经填料,有利于营养成分和氧的传递,这种形式的灌流速度较大,细胞在载体中可高密度生长。流化床生物反应器是通过流体的上升运动使固体颗粒维持在悬浮状态进行反应,适合于固定化细胞的培养。
2.灌流式培养的优点
灌流式培养具有以下优点:
(1)细胞截留系统可使细胞或酶保留在生物反应器内,维持较高的细胞密度,一般可达每毫升107~109个,从而较大地提高了产品的产量;
(2)连续灌流系统使细胞稳定地处在较好的营养环境中,有害代谢产物浓度较低;
(3)反应速率容易控制,培养周期较长,可提高生产率,目标产品回收率高;
(4)产品在罐内停留时间短,可及时回收到低温下保存,有利于保持产品的活性。
灌流式培养是近年用于动物细胞培养生产分泌型重组治疗性药物和嵌合抗体及人源化抗体等基因工程抗体较为推崇的一种方式。应用灌流工艺的公司有Genzyme、Genetic Institute、Bayer公司等。这种方法最大的困难是污染概率较大,还存在长期培养中细胞分泌产品的稳定性问题、规模放大过程中的工程问题。
(六)细胞工厂培养
细胞工厂(cell factory)是一种设计精巧的细胞培养装置。它在有限的空间内最大限度地利用了培养表面,从而节省了大量的生产空间,并可节省贵重的培养液。更重要的是,它可有效地保证操作的无菌性,从而避免因污染而带来的原料、劳务和时间损失。它是对传统转瓶培养的革命。
丹麦NUNC公司生产的NUNC细胞工厂是目前应用较多的细胞工厂系统,可用于疫苗、单克隆抗体等的工业化生产,特别适合于贴壁细胞的培养,也可用于悬浮培养,在从实验室规模进行放大时不会改变细胞生长的动力学条件,可提供1盘、2盘、10盘和40盘的规格,使放大变得简单易行,污染风险低,节省空间,培养表面经测试保证最有利于细胞贴附和生长。同时,与NUNC细胞工厂操作仪结合使用,可全面实现细胞培养的自动化,从而大大地降低劳动强度。这套系统使用很方便;由组织培养级聚苯乙烯制成,使用后处理也很方便。
细胞工厂最大的缺点是经胰蛋白酶消化后,很难将细胞完全洗出。
四、微载体培养技术
(一)微载体培养技术应用简介
微载体培养技术于1967年被用于动物细胞大规模培养。经过三十余年的发展,该技术已经成熟,并广泛应用于生产疫苗、基因工程产品等。微载体培养是目前公认的最有发展前途的一种动物细胞大规模培养技术,兼具悬浮培养和贴壁培养的优点,容易放大。目前微载体培养广泛用于培养各种类型的细胞,生产疫苗、蛋白质产品,如293细胞、成肌细胞、Vero细胞、CHO细胞等。
使用较多的反应器有两种:贝朗公司的BIOSTAT Cplus反应器,使用双桨叶无气泡通气搅拌系统;NBS公司的CelliGen、CelliGen PlusTM和Bioflo3000反应器,使用Cell-lift双筛网搅拌系统。两种系统都能实现培养细胞和产物的有效分离。微载体培养设备如图1-54所示。
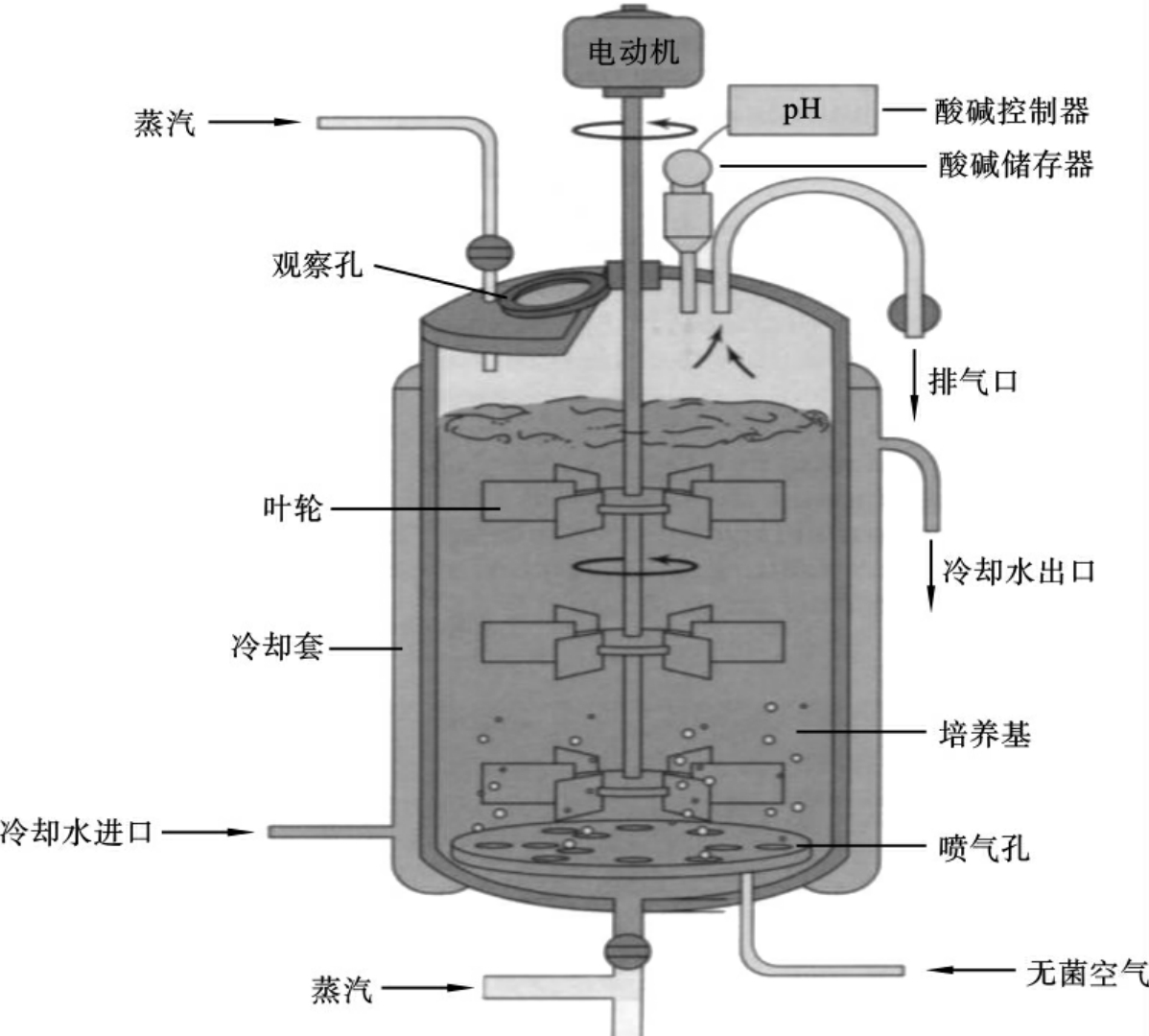
图1-54 微载体培养设备
(二)微载体理论
微载体是指直径在60~250μm,能适用于贴壁细胞生长的微珠,一般由天然葡聚糖或者各种人工聚合物组成。自van Wezel用DEAE-Sephadex A50研制的第一种微载体问世以来,国际市场上出售的微载体商品的类型已经达十几种,包括液体微载体、大孔明胶微载体、聚苯乙烯微载体、PHEMA微载体、甲壳质微载体、聚氨酯泡沫微载体、藻酸盐凝胶微载体以及磁性微载体等。常用商品化微载体有以下几种:Cytodex1、Cytodex2、Cytodex3,Cytopore和Cytoline。
(1)微载体的大小:增大单位体积内的表面积对细胞的生长非常有利。应使微载体直径尽可能小,最好控制在200μm以下。
(2)微载体的密度:一般为1.03~1.05g/cm3,随着细胞的贴附及生长,密度可逐渐增大。
(3)微载体的表面电荷:据研究,控制细胞贴壁的基本因素是电荷密度而不是电荷性质。若电荷密度太低,细胞贴附不充分,但电荷密度过大,反而会产生“毒性”效应。
(三)微载体培养的原理与操作
1.原理
微载体培养的原理是将对细胞无害的颗粒——微载体(图1-55)加入培养容器的培养液中,作为载体,使细胞在微载体表面附着生长,同时通过持续搅动使微载体始终保持悬浮状态。
贴壁依赖性细胞在微载体表面上的增殖要经历黏附贴壁、生长和扩展成单层三个阶段。细胞只有贴附在固体基质表面才能增殖,故细胞在微载体表面的贴附是进一步铺展和生长的关键。贴附主要是靠静电引力和范德华力。细胞在微载体表面贴附主要取决于细胞与微载体的接触概率和相融性。

图1-55 微载体
2.搅拌转速
由于动物细胞无细胞壁,对剪切力敏感,因而无法靠提高搅拌转速来增加接触概率。通常的操作方式是在贴壁期采用低搅拌转速,时搅时停;数小时后,待细胞附着于微载体表面时,维持设定的低转速,进入培养阶段。微载体培养的搅拌非常慢,最大转速为75r/min。
3.细胞与微载体的相融性
细胞与微载体的相融性与微载体表面理化性质有关。一般细胞在进入生理pH值环境时,表面带负电荷。若微载体带正电荷,则利用静电引力可加快细胞贴壁速度。若微载体带负电荷,静电斥力使细胞难于黏附贴壁,但当培养液中溶有或微载体表面吸附着二价阳离子作为媒介时,则带负电荷的细胞也能贴附。
4.细胞在微载体表面的生长
影响细胞在微载体表面生长的因素很多,主要有以下三个方面。
(1)细胞方面,如细胞群体、状态和类型。
(2)微载体方面,如微载体表面状态、吸附的大分子和离子。微载体表面光滑时细胞扩展快,表面多孔则扩展慢。
(3)培养环境方面,如培养基组成、温度、pH值以及代谢废物等均明显影响细胞在微载体上的生长。如果所处条件最优,则细胞生长快;反之,则细胞生长慢。
5.微载体培养操作的要点
(1)培养初期:保证培养基与微载体处于稳定的pH值与温度水平,接种细胞(对数生长期,而非稳定期)至终体积1/3的培养液中,以增加细胞与微载体接触的机会。不同的微载体所用浓度及接种细胞密度是不同的,常采用2~3g/L的微载体含量,微载体浓度更高时需要控制环境或经常换液。
(2)贴壁阶段(3~8d)后,缓慢加入培养液至工作体积,并且增大搅拌速度保证完全均质混合。
(3)培养维持期:进行细胞计数(胞核计数)、葡萄糖测定及细胞形态镜检。随着细胞增殖,微珠会变得越来越重,需增大搅拌速度。经过3d左右,培养液开始呈酸性,需换液。停止搅拌,让微载体沉淀5min,弃掉适宜体积的培养液,缓慢加入新鲜培养液(37℃),重新开始搅拌。
(4)收获细胞:首先排干培养液,至少用缓冲液漂洗一遍,然后加入相应的酶,搅拌(75~125r/min)20~30min,然后收集细胞及其产品。
(5)微载体培养的放大:可以通过增加微载体的含量或培养体积进行放大。使用异倍体或原代细胞培养生产疫苗、干扰素,已被放大至4000L以上。
(四)微载体大规模细胞培养的生物反应器系统
微载体大规模细胞培养技术中细胞扩增的效率受到诸多因素的影响和限制,其中主要的限制性因素包括细胞对剪切力的敏感性、氧的传递以及传代和扩大培养等。而研制的各种类型生物反应器系统则可针对上述限制性因素,为微载体细胞培养与扩增提供低剪切力、高氧传递效率、易于细胞传代等适宜的外部环境。已较多使用的微载体培养系统生物反应器,其操作可以实行计算机控制,搅拌速度及悬浮均匀程度、温度、pH值、溶解氧供应(O2、N2、CO2、空气四种纯化气体按比例调节)、罐压、培养体积和通气量等参数全部由计算机自动控制。因此,应用生物反应器系统进行微载体细胞大规模扩增具有明显优势,目前国外相继研制了数种适合进行微载体大规模细胞培养的生物反应器系统,如搅拌式生物反应器系统、灌注式生物反应器系统以及旋转式生物反应器系统等。
1.搅拌式生物反应器系统
搅拌式生物反应器系统在微载体细胞大规模扩增研究领域已有较长的研究历史,但因该细胞培养系统容易产生过大的剪切力,从而限制了其应用范围。尽管如此,由于该系统具有简单、实用及价格低廉等特点,国内外仍有不少应用该系统成功进行细胞大规模扩增的研究报道。
2.灌注式生物反应器系统
灌流式培养是目前的研究热点之一。它的特点是不断地加入新鲜培养基并不断地抽走含细胞代谢废物的消耗培养基,使细胞得以在一个相对稳定的生长环境内增殖,既省时省力,又减少了细胞发生污染的机会,且可以提高细胞密度10倍以上。
3.旋转式生物反应器系统
近年来,旋转式生物反应器系统(RCCS)已经成为应用微载体技术进行细胞大规模扩增的一种较常用的细胞培养系统。该系统是基于美国航空航天局为模拟空间微重力效应而设计的一种生物反应器。RCCS既可以用于微载体大规模细胞培养,又能用于培育细胞与支架形成的三维空间复合体。至今,已有近百种组织细胞在该系统内成功进行了大规模扩增。
(五)微载体培养的优点
微载体培养具有以下优点:
(1)表面积与体积比(S/V)大,因此单位体积培养液的细胞产率高;
(2)把悬浮培养和贴壁培养融合在一起,兼有两者的优点;
(3)可用简单的显微镜观察细胞在微载体表面的生长情况;
(4)简化了细胞生长各种环境因素的检测和控制,重现性好;
(5)培养基利用率较高;
(6)容易放大;
(7)细胞收获过程不复杂;
(8)劳动强度小;
(9)培养系统占地面积和空间小。
知识拓展
CytodexTM细胞培养微载体技术
在微载体细胞培养技术中,贴壁动物细胞在悬浮于生物反应器培养液内的球形微载体表面上贴壁生长。与转瓶和细胞工厂等传统方法相比,微载体可以提供极高的表面积与体积比,因此成为一种极具吸引力的新型替代技术,用于各种规模的细胞培养研究和工艺放大。
Cytodex1是通过用遍布于整个基质的带正电荷的DEAE基团取代交联葡聚糖而形成的,是一种通用的微载体。它适合于大多数已经建立的细胞株,并可用于原代细胞和正常的二倍体细胞株中病毒或细胞产物的生产。图1-56所示为在Cytodex1上生长的猪肾细胞。
Cytodex3是通过化学交联一个薄层的变性胶原蛋白到交联葡聚糖基质而形成的,它对于体外难以培养的细胞是首选的微载体,且特别适合于具有类表皮细胞形态的细胞。胶原表面层能够被多种水解蛋白酶所消化,从而为微载体表面收获细胞,同时保持最大的细胞活力和细胞膜完整性提供了可能性。这对于大规模细胞培养工艺所需要的连续传代步骤是非常关键的。
微载体培养技术可以用于几乎任何类型的无菌细胞培养容器中。然而,为了从常规的微载体培养中获得最大的细胞产量和生产率,最好使用具有有效的混合系统的培养设备,以提供均匀的培养环境、均一的微载体悬浮培养液和充足的氧气供应。此外,应该避免高剪切力对动物细胞的伤害。图1-57所示为1000 L发酵罐中脊髓灰质炎病毒疫苗的生产设备。
对于常规的、小规模微载体培养(几升工作体积),一些供应商已经改良了含有磁力驱动的搅拌棒或叶轮的玻璃旋转容器,可以用于微载体实验室小规模培养。
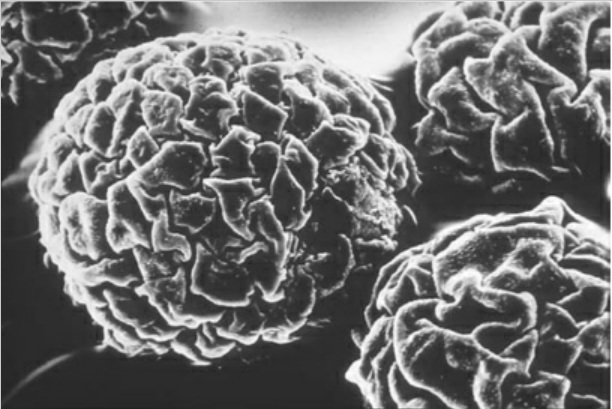
图1-56 在Cytodex1上生长的猪肾细胞

图1-57 1000L发酵罐中脊髓灰质炎病毒疫苗的生产设备
New Brunswick推出一次性搅拌式生物反应器

图1-58 一次性搅拌式生物反应器
提起生物反应器,大家脑海中浮现出的肯定是那种又大又重的罐子。其实,在最近几年,一次性生物反应器的应用也越来越广,逐渐被研发人员所接受。与重复使用的转瓶或不锈钢生物反应器相比,这类生物反应器有着明显的优势,包括节省劳动力和成本、运行中可快速转换等。为此,New Brunswick Scientific(Eppendorf旗下公司)也推出了一次性的CelliGen BLU搅拌式生物反应器(图1-58)。这种全新的反应器综合了一次性技术以及传统搅拌罐的可靠性能和扩展性。CelliGen BLU使用了5.0L和14.0L的可替换的一次性搅拌罐体,能用于高密度动物细胞培养。罐体包括搅拌桨、管道和过滤器。罐体的顶板上还带有RTD温度传感器、pH和溶解氧探头。控制套件具有符合cGMP生产要求的高级系统控制功能。
一次性罐体与传统生物反应器相比最大的优点就是避免了灭菌、清洗和组装,减少了污染风险,也减少了验证的需求,节省了时间和成本。
思考题
1.大规模培养时,动物细胞的生长特性有哪些?
2.简述微载体培养的原理。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















