单元一 抗原的制备
抗原(免疫原)是能诱导机体产生抗体又能与抗体在体内外发生特异性结合反应的物质。合格抗原是制备高质量抗体的先决条件。自然界中众多抗原物质,绝少是单一成分,所以要想获得具有单一特异性的纯化抗原,必须从复杂的物质组分中提取目的抗原成分,制备成合格的纯抗原。抗原按其物理性状可分为颗粒性抗原及可溶性抗原,根据化学性质又可分为蛋白质抗原、多糖抗原和核酸抗原等。因此,不同性质的抗原其制备方法也不尽相同。
一、颗粒性抗原的制备
颗粒性抗原主要是指细胞抗原、细菌抗原和寄生虫虫体抗原等。常用的颗粒性免疫原有绵羊红细胞和细菌抗原。
(一)绵羊红细胞的制备
绵羊红细胞是最常用的细胞抗原,用于溶血素的制备。细胞抗原制备比较简单,方法是:自健康绵羊颈静脉采血,立即注入无菌的装有Alsever液(抗凝,保存RBC)或玻璃珠的三角烧瓶内,充分摇动15~20min,除去纤维蛋白。使用前取适量的抗凝血,以2000rpm离心5min,弃上清液,再加2~3倍的无菌生理盐水,用毛细滴管轻轻地反复混匀,再以2000r/min离心5min,弃上清液,如此反复洗涤红细胞三次,最后一次可适当延长离心时间至10min。弃上清液,取压积红细胞,用无菌盐水最后配成1×106/mL的细胞悬液,即可应用。
制备中应注意无菌操作,有溶血现象者应弃去。红细胞洗涤次数不宜太多,以3次为宜,否则红细胞脆性增加,将会影响实验结果。
(二)细菌抗原的制备
细菌抗原可作为诊断菌液来检测相应抗体,如肥达试验用的伤寒“O”、“H”诊断菌液。细菌抗原也可用来免疫动物制得相应免疫血清或诊断血清,如沙门菌属诊断血清、霍乱弧菌诊断血清、抗毒素血清等。
1.制备方法 各种细菌含有不同性质的抗原成分,主要是菌体抗原(O抗原)、鞭毛抗原(H抗原)和表面抗原(K抗原或Vi抗原),但菌液制备程序基本相似(图6-1),只需在制备步骤中根据要求作某些处理后,即可得到所需的细菌抗原。

图6-1 细菌悬液制备的一般流程
O抗原是脂多糖,耐热,100℃加热2~3h不失去抗原性。若制备O抗原所用无鞭毛的变种,则经甲醛杀菌后即成。若为有鞭毛菌株,则在集菌后,将菌液置于水浴中2~2.5 h,既可破坏H抗原,又可杀菌,同时得到O抗原。
H抗原为蛋白质,不耐热。如用单相菌制备H抗原时,只需将该菌株接种至软琼脂或肉汤中,经培养后制成适当浓度的菌液,用0.3%~0.5%甲醛灭菌即成。如用双相菌制备H抗原时,需先用人工变异方法抑制某些位相抗原(如在软琼脂中加入相应的抗血清,以抑制相关抗原的发育),从而得到所需的位相抗原。
Vi抗原存在于菌体表面,制备时,可选用含丰富Vi抗原的V型菌变种,按常规培养后制成菌液,经甲醛杀菌即可,再加0.5%~1%氯化钙(终含量为0.25%)可保护Vi抗原。K抗原的制备方法与Vi抗原相同。
制备好各种细菌抗原后,常需按不同要求配制不同浓度,即测定每毫升菌液中所含细菌数量,可用麦克法兰(Mc Farland)标准比浊法(目测比浊法)或光度计比浊法测之。后者可减少目测的误差。
细菌抗原经检定合格者,小量分装,于2~8℃暗处保存。
2.细菌抗原的检定 各类细菌抗原制成后,均需作有关检定,其主要项目如下。①一般性状检定:制备细菌抗原所用菌种,应具有典型的生物学特性;细菌抗原应为乳白色悬液,100℃水浴30min应仍为均匀悬液。不应有摇不散的菌块或琼脂等异物,在盐水中无自凝现象。②无菌试验:细菌悬液经甲醛处理后,置37℃培养2~3天应无菌生长。③纯度检查:将菌悬液作革兰染色镜检至少10个视野,应无杂菌。④特异性试验:与相应诊断血清作玻片凝集试验,呈强阳性反应。⑤定量凝集试验,其凝集效价不低于原血清凝集效价的50%。⑥浓度测定:应达到所需要求。
二、可溶性抗原的制备
可溶性抗原包括蛋白质、多糖、脂多糖、核酸等,它们存在于生物体液或组织细胞中,如膜蛋白抗原、细胞质抗原、细胞核和核膜抗原等,所以这些可溶性抗原的制备需先将细胞破碎,再使用一定的方法提取纯化。制备的基本过程包括材料的选取与预处理、细胞裂解、纯化抗原的提取、抗原的鉴定、抗原的浓缩或冷冻干燥保存五个步骤(图6-2)。
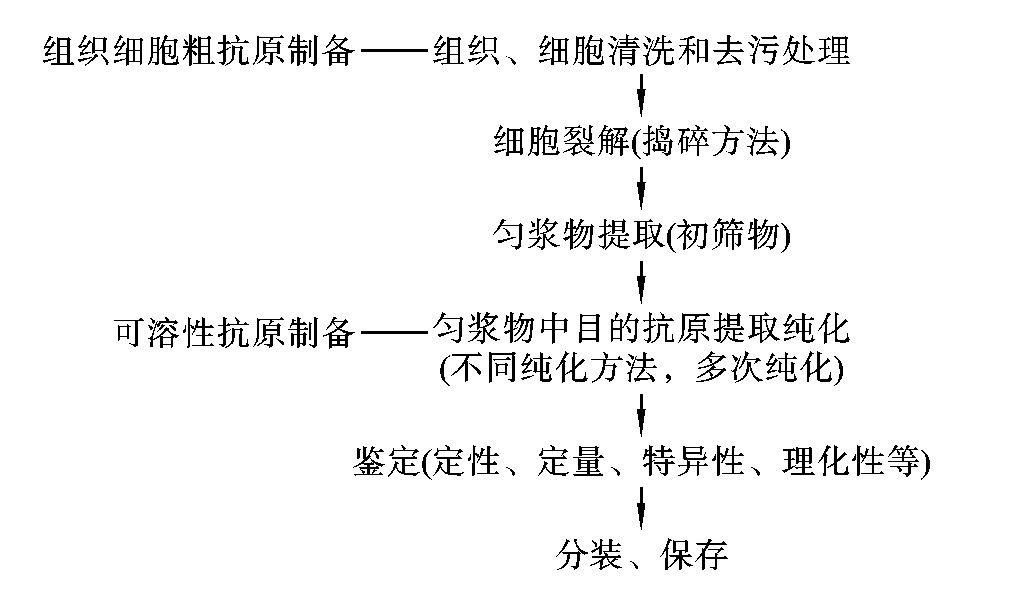
图6-2 可溶性抗原制备的一般流程
(一)材料的选取与预处理
所用组织必须是新鲜或低温(<-40℃)保存的。器官或组织材料得到后立即去除包膜或结缔组织以及一些大血管。脏器应进行灌洗,除去血管内残留的血液。处理好的组织用含0.5g/L NaN3的生理盐水或缓冲盐液洗去残留血液和污物。将洗净的组织剪成小块,进行捣碎。所用细胞(包括正常细胞、传代细胞或病理细胞如肿瘤细胞)通常用缓冲盐液混悬后离心,除去残留培养液,然后进行捣碎。
(二)细胞裂解
捣碎细胞的方法有很多,按照作用的原理可分为机械法和非机械法两大类。机械法一般包括匀浆、研磨、压榨、超声破碎等方法;非机械法常有渗透、酶溶、冻融裂解和表面活性剂溶解等方法。此外,一些新的方法也在不断完善和发展,如激光破碎法等。该步骤是目的抗原初级分离纯化的重要环节,它直接影响产物的回收率,也可影响产物的纯度。
1.细胞匀浆 匀浆是破碎生物体组织细胞最常用的方法之一。其原理是将组织剪切成小块,再加入3~5倍体积的预冷匀浆缓冲液,通过固体剪切力破碎组织和细胞,释放抗原至溶液中。常用的有两种。①高速组织匀浆器法:将4℃预冷的组织碎块或细胞悬液加入匀浆器玻璃杯中,约为玻璃杯体积1/3的量即可。通过匀浆器高速旋转的刀片破碎组织细胞。由于机器高速转动时可产生热量,使细胞抗原降解,故使用时应注意时间不能过长或间断进行,以500~1500r/min匀浆3~6次,每次5~10s,每次间暂停几秒为宜。②研磨法:将组织碎块或细胞悬液加入玻璃匀浆器中,通过玻璃杵的旋转、挤压等产生的机械切力使细胞破碎。这种方法对抗原破坏小,是目前广泛使用的一种细胞破碎法。匀浆效果可用相差显微镜观察组织细胞状况来进行评估。
2.超声波破碎法 利用超声波的机械振荡产生压力使细胞破碎。使用超声波破碎时,超声频率为1~20kHz,每次1~2min,间歇进行,避免长时间作用产热破坏抗原,总时间为10~15min。因产生泡沫会导致蛋白质变性,故应控制超声强度刚好低于溶液产生泡沫的水平。组织细胞与微生物细胞的破碎均可采用此法。
3.酶处理法 溶菌酶在碱性条件下能溶解革兰阳性菌的细胞壁,若有乙二胺四乙酸(EDTA)存在时,还能溶解革兰阴性菌的细胞壁;纤维素酶主要溶解真菌细胞壁;蜗牛酶能溶解酵母菌细胞壁和植物细胞壁。酶处理法的优点是作用条件温和,不易损坏细胞内含物成分,可有效控制细胞壁的破坏程度。适用于多种微生物细胞的溶解。
4.反复冻融法 将待破碎细胞置-20℃冰箱内完全冻结,然后在室温融化,如此反复多次,大部分组织细胞及组织细胞内的颗粒可被融破。此法适用于对培养细胞的处理。如要提取细菌或病毒中的蛋白质或核酸,可用类似的冷热交替法,即将细胞置于沸水浴中,90℃左右维持数分钟后,立即移至冰浴或更低的温度环境迅速冷却,可使大部分微生物细胞膜破坏。
5.表面活性剂处理法 在适当的温度、pH值及低离子强度的条件下,表面活性剂与脂蛋白形成微泡,使细胞膜通透性改变致细胞溶解。常用的表面活性剂有十二烷基磺酸钠(SDS)、二乙胺十六烷基溴、苯扎溴铵、吐温等。本法作用较温和,多用于细菌和培养细胞的破碎。
细胞破碎后获得的抽提物为细胞裂解液,根据需要可在12000r/min离心10~60 min,弃去沉淀物,上清液中含有所需的可溶性抗原。
(三)可溶性抗原纯化
1.蛋白质抗原的纯化 细胞裂解液中含有复杂的蛋白质成分,其中的糖蛋白、脂蛋白、酶等蛋白质都是良好的可溶性抗原,所以免疫前必须进行纯化。常用的纯化蛋白质方法有如下。
(1)超速离心法 超速离心法是利用蛋白质的比重特点进行分离,分为差速离心法和密度梯度离心法两种。前者是低速离心与高速离心交替进行,分离大小差异较大的抗原蛋白颗粒;梯度离心法是利用样品中各颗粒在一定密度梯度介质(如蔗糖、甘油、氯化铯等)中沉降速度或漂浮速度不同,使具有不同沉降速度的物质位于不同密度的梯度层内,以达到分离的目的。超速离心法常用于分离亚细胞成分和大分子蛋白质,不适合分离中、小相对分子质量蛋白质。
(2)选择性沉淀法 选择性沉淀法是根据不同蛋白质理化特性上的差异,使用各种沉淀剂或改变某些外界条件促使蛋白质抗原成分沉淀,从而实现分离和纯化。常见的有盐析沉淀法、有机溶剂沉淀法、聚合物沉淀法等。盐析沉淀法为经典的蛋白质纯化分离技术,是利用各种蛋白质在不同盐浓度中有不同溶解度进行分离提取的方法。常用的盐析剂为33%~50%饱和度的硫酸铵。33%~40%饱和度的硫酸铵可沉淀丙种球蛋白,主要为IgG(95%以上),去盐后可直接用作检测抗体试剂。该法简单、有效,不影响抗原活性,但分辨力差、纯化倍数低、有盐分混杂。本方法可用于蛋白质和酶的分级沉淀。
(3)凝胶过滤法 凝胶过滤法又名分子筛层析法,是利用凝胶的分子筛作用,分离不同相对分子质量的蛋白质。凝胶是具有三维空间多孔网状结构的物质,如葡聚糖凝胶(sephadex)、琼脂糖凝胶(sepharose)等,经适当的溶液平衡后装入层析柱。当含有不同相对分子质量蛋白质的样品液缓慢流经凝胶层析柱时,大分子蛋白质因直径大不易进入凝胶微孔中,只能留在凝胶颗粒之间的空隙,洗脱时很快由上至下通过,首先被洗脱出来;小分子蛋白质则因进入凝胶微孔内,需反复洗脱才缓慢地流出。通过凝胶的分子筛作用,蛋白质分子按分子由大到小被依次分离。该法分辨力高,但处理量局限。可应用于相对分子质量差异明显的可溶性生物大分子的分离纯化。
(4)离子交换层析法 利用一些带电离子基团的纤维素或凝胶作为离子交换剂,吸附交换带有相反电荷的蛋白质抗原,因各种蛋白质的等电点不同,所带电荷量不同,与纤维素或凝胶结合的能力有差别。当梯度洗脱时,逐渐增加流动相的离子强度,加入的离子与蛋白质竞争纤维素上的电荷位点,使吸附的蛋白质与离子交换剂解离,从而使不同等电点的蛋白质被分别分离。该法分辨力高,分离量大,可应用于带电荷的生物大分子的分离。
(5)亲和层析法 亲和层析是利用生物大分子间的专一性亲和力而设计的层析技术,如抗原和抗体、酶与配体、酶和酶抑制剂、激素与受体之间具有专一亲和力,在一定条件下,两者能紧密结合成复合物。若将具有专一亲和性的一方固定在固相载体上,当样品通过层析柱时,则可特异性地吸附结合样品的另一方,实现分离。该方法特异性强、操作简单、提取物纯度高,是纯化抗原常用而有效的方法。
2.核酸抗原的制备 核酸分子多数是半抗原物质,只有与适当载体结合才具有免疫原性,用作抗原制备抗体。提取核酸的主要步骤:先破碎细胞,使核酸从细胞中游离出来,再用酚和氯仿抽提去除蛋白质,最后用乙醇沉淀核酸。
3.脂多糖抗原的制备 脂多糖(LPS)是革兰阴性菌细胞壁的重要成分,有多种生物学效应,常用苯酚法提取LPS。主要步骤:将2g干燥的菌体(或菌量相当的湿菌体)在35mL水中混匀,加温到65~68℃,加入等体积预温的90%苯酚并激烈搅匀,再加热5min,用冰水立即冷却至10℃以下,5000r/min离心20~30min后,分为上、下两层。上层为水层(含LPS),下层为酚层,菌体碎片沉于底部。吸取水层,透析除酚、浓缩、超速离心后,上层沉淀的透明胶质部分为脂多糖,取出悬于水中,再离心,可获得纯化的LPS样品。
4.免疫球蛋白片段的制备 免疫球蛋白作为抗原,可用于免疫动物制备相应的抗体。五类免疫球蛋白可用蛋白纯化方法提取。如将免疫球蛋白分解成片段,如Fab段、Fc段、轻链和重链等作为抗原制备抗血清,可获得分辨力更高的特异性抗体。片段制备方法如下。①非共价键解离法:免疫球蛋白肽链亚单位之间以非共价键连接,这些键结合力较弱,在强变形剂(如盐酸胍)作用下可使其断开,分开亚单位。②共价键解离法:二硫键是连接免疫球蛋白肽链的共价键,利用氧化法或还原法将其解离,从而将重链和轻链分开。③酶解法:酶解法有极好的专一性,不同的酶将免疫球蛋白裂解成不同片段。如木瓜蛋白酶将IgG裂解成一个Fc段和两个Fab段;胃蛋白酶将IgG水解成一个F(ab′)2片段和数个结晶小片段。
(四)纯化抗原的鉴定、浓缩与保存
1.定量测定 运用生物化学技术如紫外光吸收法、双缩脲法、酚试剂法等,可进行相对分子质量、含量测定。
2.纯度鉴定 常用醋酸纤维膜或聚丙烯酰胺凝胶(PAGE)电泳法、免疫电泳法、免疫双向琼脂扩散法等进行鉴定。应注意一条电泳带或一条沉淀带也可能会有其他成分;几条带中,也可能是同一物质的聚合物或降解物,所以常需几种方法联合应用,结果才比较可靠。
3.免疫活性鉴定 可用免疫电泳法、双向免疫扩散法和ELISA法等方法测定。
4.浓缩与保存 纯化的抗原常需要浓缩,浓缩的方法可用吸收浓缩法、蒸发浓缩法与超滤浓缩法。浓缩后的抗原可以在液态或干燥状态低温保存。液态保存时须加入防腐剂,如氯仿、叠氮钠、硫柳汞等。干燥状态保存较稳定,在0~4℃条件下可保存数年。
三、半抗原的制备
半抗原是仅有抗原性而无免疫原性的物质,如多肽、甾体激素、核苷、某些药物等小分子物质均属于半抗原。
(一)载体
能作为半抗原载体的有蛋白质、多肽聚合物、大分子聚合物等。
1.蛋白质 蛋白质是结构复杂的大分子胶体物质,是一种良好的载体。常用的有牛血清白蛋白、人血清白蛋白、卵白蛋白和血蓝蛋白等。其中牛血清白蛋白最常用。蛋白质与半抗原的结合是通过游离氨基、羧基、酚基、巯基和胍基等活性基团的缩合实现的。
2.多肽聚合物 常用的有多聚赖氨酸、二软脂酰赖氨酸、多聚混合氨基酸等。这些人工合成的载体与半抗原结合后,可诱导机体产生针对半抗原的高效价、高亲和力的抗体。
3.大分子聚合物 羧甲基纤维素、聚乙烯吡咯烷酮及活性炭等大分子聚合物皆可与半抗原结合,加入弗氏完全佐剂可诱导动物产生良好的抗体。
(二)半抗原与载体的连接方法
半抗原与载体的连接方法有物理法和化学法。物理法是通过电荷和微孔吸附半抗原,吸附的载体有淀粉、聚乙烯吡咯烷酮、硫酸葡聚糖和羧甲基纤维素等。化学法是利用某些功能基团把半抗原交联在载体上。半抗原带有的化学基团不同,其化学连接方法也不同,带有游离氨基或游离羧基以及两种基团均有的半抗原,可直接与载体连接,连接方法有碳化二亚胺法、戊二醛法等;无氨基与羧基的半抗原不能直接与载体连接,需先用化学方法使其转变为带有游离氨基或游离羧基的衍生物后才能与载体连接,方法有琥珀酸酐法、一氯醋钠法等。
(三)半抗原的鉴定
半抗原与载体结合的数目与免疫原性密切相关,一般认为一个载体分子上至少要连接20个以上的半抗原分子,才能有效地刺激免疫动物产生抗体。因此,在半抗原与载体连接后,应测定连接到载体上的半抗原分子数。测定方法有吸收光谱分析法和放射性核素标记半抗原掺入法。
四、免疫佐剂
免疫佐剂,简称佐剂,是先于抗原或与抗原一起注入机体,可增强机体对该抗原的特异性免疫应答或改变免疫应答类型的物质。免疫佐剂为一类非特异性的免疫增强剂,可具有免疫原性,也可无免疫原性。
(一)佐剂的种类与制备
1.种类 佐剂的种类很多,按其理化性质进行分类,分为以下四类,见表6-1。
表6-1 佐剂的种类
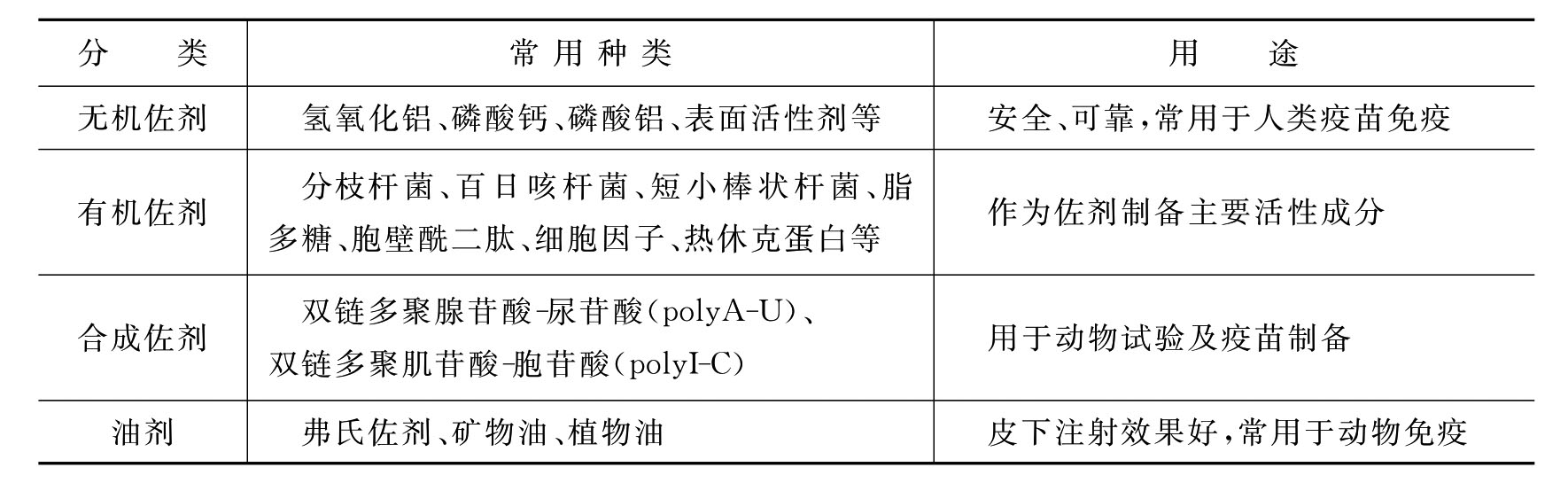
目前可安全用于人体的佐剂只有氢氧化铝、明矾、polyI-C、胞壁酰二肽、细胞因子等。
2.制备 最常用于免疫动物的佐剂是弗氏佐剂。弗氏佐剂包括弗氏不完全佐剂和弗氏完全佐剂两种。弗氏不完全佐剂是由油剂(花生油或液体石蜡)和乳化剂(羊毛脂或吐温-80)制成,在弗氏不完全佐剂中加入卡介苗即为弗氏完全佐剂(图6-3)。
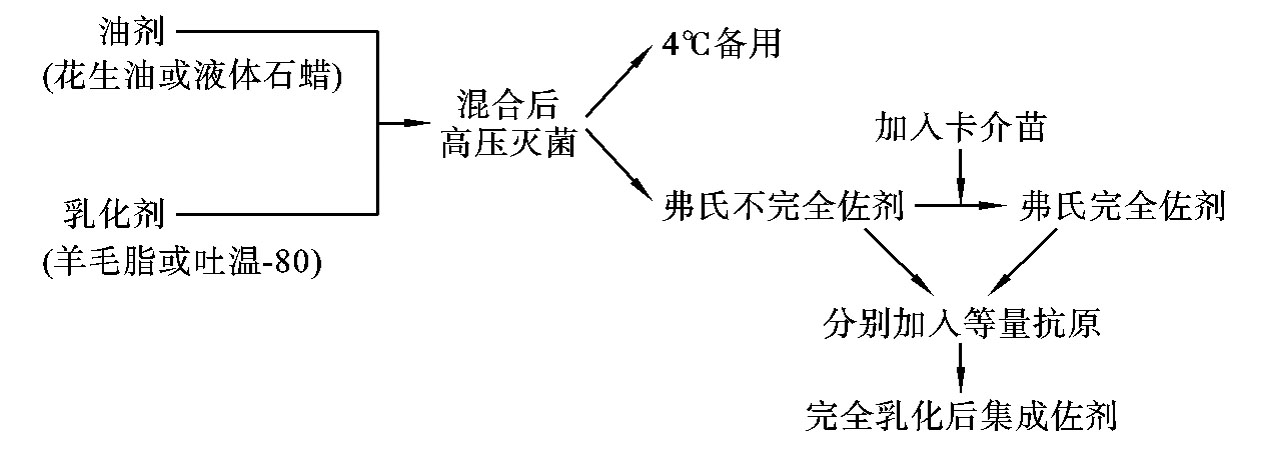
图6-3 弗氏佐剂制备基本流程
使用弗氏佐剂时,首先需按1∶1比例将可溶性抗原加入弗氏佐剂中并充分乳化,形成油包水乳剂。乳化的方法有以下两种。①研磨法:将加热佐剂倾入无菌乳钵,冷却后缓缓滴入卡介苗,边滴边按同一方向研磨,使菌体完全分散,再用同法加入抗原,直到完全变成乳剂,此法乳化完全,但抗原损失量较大;②搅拌混合法:用两个5mL注射器,在针头处用尼龙管连接,一侧为佐剂,另一侧为抗原,装好后来回推注,经多次混合逐渐变为乳剂。此法具有无菌操作、节省抗原与佐剂等优点,但不易乳化完全。鉴定是否乳化完全的方法是将一滴乳剂滴入水中,若立即散开,则未完全乳化;若不散开,则乳化完全。
(二)佐剂的作用机制
佐剂的作用机制主要为:①改变抗原的物理性状,延长抗原在体内的存留时间,从而有效地刺激免疫系统;②活化抗原提呈细胞,增强其抗原处理和提呈能力;③刺激淋巴细胞增殖和分化,扩大和增强免疫应答的效应。
(三)佐剂的应用原则
应用佐剂的目的是为了提高抗原的免疫原性,以增强体液免疫和细胞免疫应答。有些抗原如可溶性蛋白抗原经高度纯化后,免疫原性往往降低,因而,这些抗原在免疫动物时需加入佐剂,增加抗体产生量。在某种情况下,为改变抗原免疫应答类型,延长抗原在体内存留的时间,或改变抗原的分布,或增强局部对变应原的超敏反应等情况,都可考虑应用佐剂。
佐剂也可引起局部形成肉芽肿、无菌性脓肿、持久溃疡,反复注射佐剂易发生过敏反应,故多用于动物实验。对于可预见的免疫损伤,应慎重使用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















