第四节 细胞内蛋白质的加工和分泌
由ER合成并输送到GC、溶酶体、细胞膜以及细胞外的蛋白质大多是糖蛋白,它们的糖基化是从ER开始的,最后在GC中完成。分泌性蛋白质在成熟之前要经过很多加工和修饰,主要有糖基化、硫酸盐化以及蛋白原的蛋白水解作用等。
一、蛋白质在ER的糖基化
蛋白质进入ER腔后立即被糖基化,蛋白质的糖基化不是把单糖一个一个加到多肽链上,而是通过一种寡糖供体把整个寡糖转移到多肽链上。这种寡糖供体是什么呢?在RER膜上有一种带有高能键的特殊脂质分子多萜醇(dolichol),在它上面连接着一种寡糖。当多肽链中的某些天冬酰胺(Asn-X-Ser或Asn-X-Thr)残基露出ER腔面时,寡糖在糖基转移酶的催化作用下,从多萜醇转移到多肽链的Asn上,形成N-连接寡糖(图4-15)。N-连接寡糖是糖蛋白中最普遍的一种糖基,催化这一过程的酶是一种活性部位暴露在ER腔面的膜结合蛋白。实际上,这种糖基化是在ER的腔侧面进行的,也可以理解为什么在细胞质中游离核糖体合成的可溶性蛋白质不被糖基化的原因。
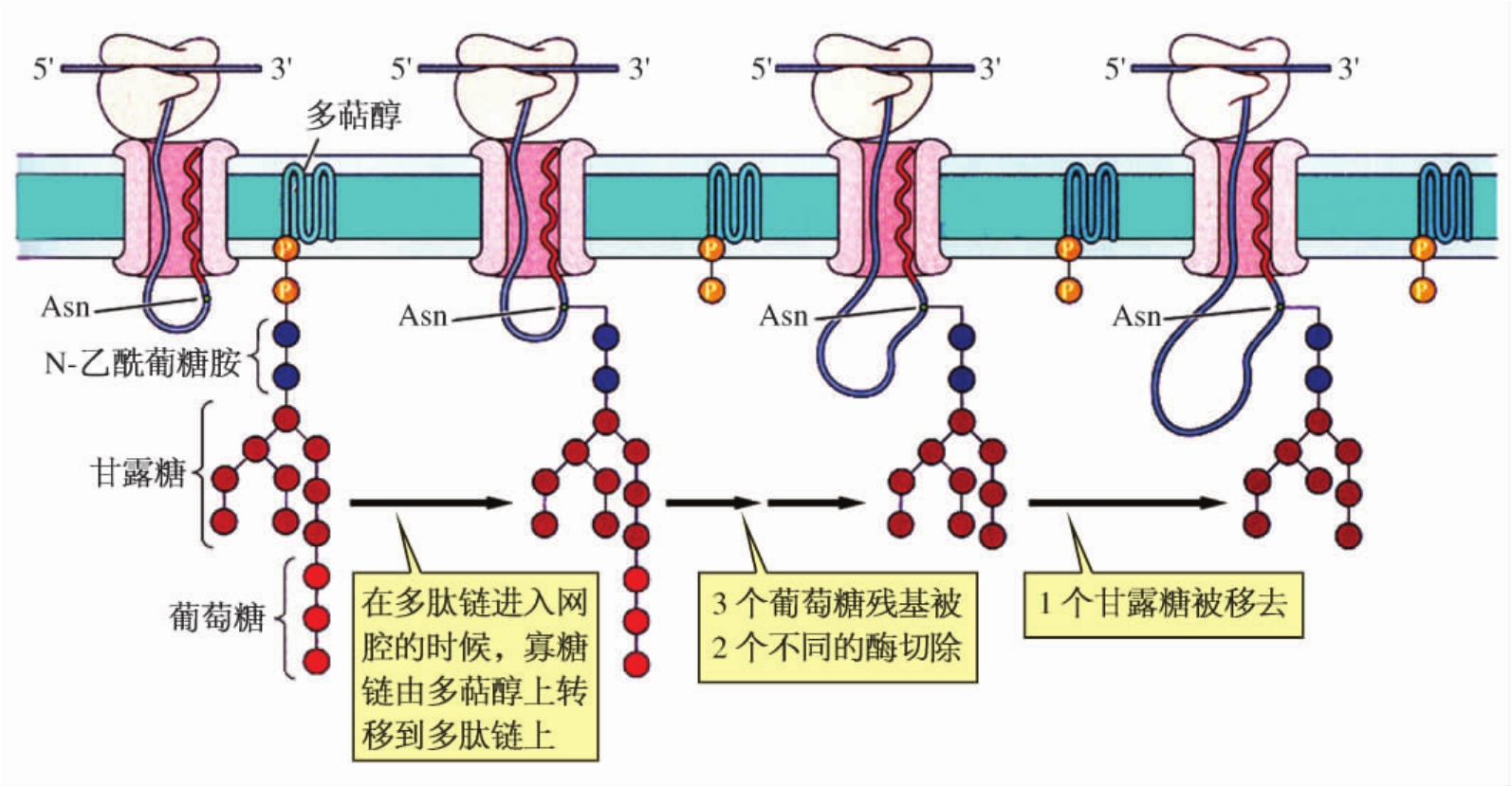
图4-15 蛋白质在ER膜的糖基化作用
由多萜醇提供连接到多肽链上的寡糖具有2分子N-乙酰葡糖胺、9分子甘露糖和3分子葡萄糖,与最终形成糖蛋白中的寡糖有较大的差别,因此需要进行修饰和加工。初步的修饰和加工在RER中进行,把3个葡萄糖切除;进一步的修饰和加工则在GC中进行。
多肽链在ER腔中还进行其他的修饰,如二硫键的修饰和正确的折叠装配。ER腔中有协助蛋白质亚基正确适时装配的分子伴侣蛋白。
二、蛋白质在GC中的糖基化
在ER中已经过初步糖基化的蛋白质到达GC后,要进行进一步糖基化和糖链修饰,即切除多余甘露糖,加上其他必要的糖基,这一过程使蛋白质具有更加丰富的多样性。糖蛋白中的N-连接寡糖有两类:一类是高甘露糖型,另一类是复合型。高甘露糖型寡糖只含2分子N-乙酰葡糖胺和6分子甘露糖残基,其中在GC中进一步切除3分子甘露糖残基。复合型寡糖除在ER已切除3分子葡萄糖外,在GC中再切除6分子甘露糖,还要加上3分子N-乙酰葡糖胺、3分子半乳糖、3分子唾液酸,必要时还加上岩藻糖。这些修饰作用需要一系列特殊的酶,如切除甘露糖需要甘露糖苷酶,加上新的糖基需要各种糖基转移酶。这些酶都存在于GC不同区室的扁平囊中,蛋白质在经过这些区室逐步转运过程中被特定的酶按次序切除或连接上糖基(图4-16),完成加工修饰。
此外,许多糖蛋白还以O-连接的方式进行糖基化修饰。这种修饰主要或全部发生在GC内,糖基有选择性地连接到如丝氨酸(Ser)或苏氨酸(Thr)残基的侧链-OH基上,通常先连接N-乙酰葡糖胺,然后再连接其他的糖基,糖基可多达10个以上。
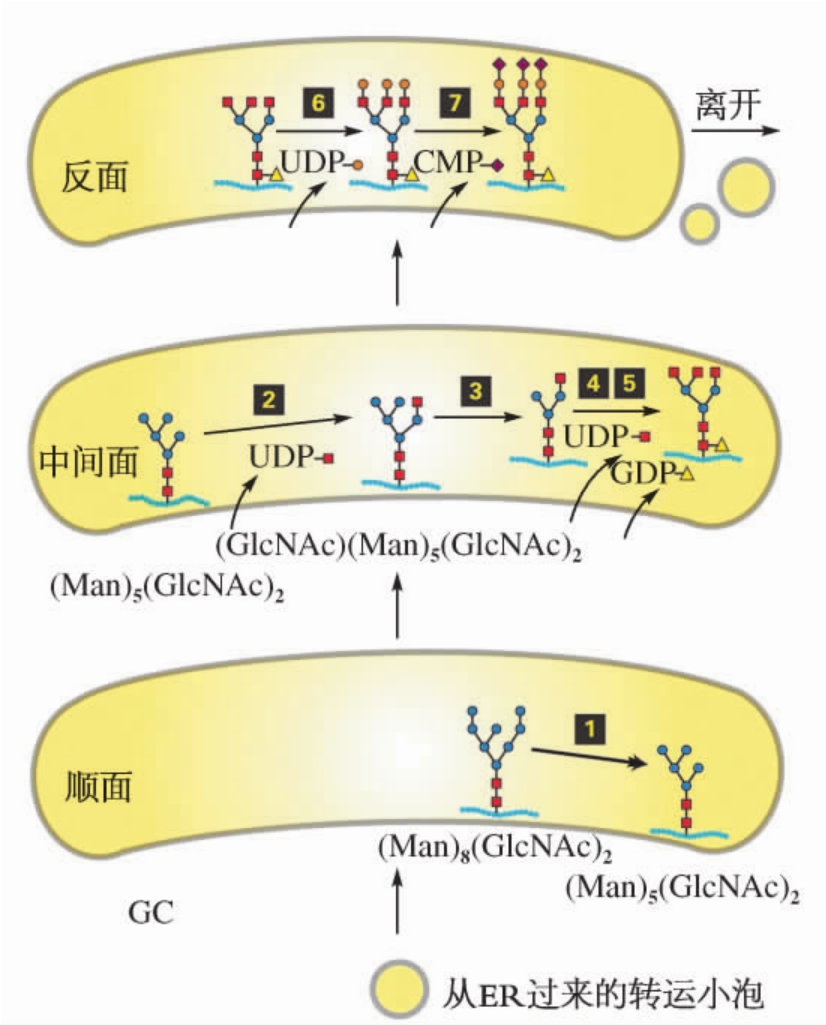
图4-16 GC糖基化功能示意图

三、蛋白原的水解
许多蛋白质产物刚刚从ER合成时是相对分子质量较大的蛋白原,它们必须在GC中水解切除部分肽段或修饰才能成为成熟的分泌蛋白。例如胰岛素(insulin)在胰岛β细胞的RER刚合成时,新生多肽在N端带有信号肽,称为前胰岛素原(preproinsulin),相对分子质量为12000。随后在ER腔中信号肽被切除,成为胰岛素原(proinsulin),相对分子质量为9000,由A、B、C3个肽段组成。当胰岛素原被运送到GC后,特异的蛋白酶水解切除C肽段,A、B肽链通过二硫键相连并折叠,成为成熟的胰岛素,相对分子质量约6000。胰岛素、C肽及部分未经水解的胰岛素原经过GC反面区室的包装和浓缩进入分泌颗粒,最后通过胞吐作用释放到细胞外。
四、蛋白质的分拣和分泌
在ER合成的蛋白质,通过转运小泡运输到GC,这种转运小泡被COPⅡ所包绕;蛋白质在GC内进行加工和修饰,再被分拣送往细胞的相关部位。执行分拣功能的部位是反面GC网络(TGN)。经GC内的物质运输主要有3条途径:有关物质运送到内体,参与溶酶体的形成;分泌物质运送到分泌颗粒,再通过分泌活动释放到细胞外;有关物质被直接运送到细胞膜或细胞外。这3条途径均以小泡(外被网格蛋白)形式进行转运(图4-17)。
(一)溶酶体酶的运输
溶酶体的膜蛋白、膜脂和各种酸性水解酶都是先在ER合成,然后在GC加工修饰而成的。它们从GC到溶酶体的运输通过运输小泡来完成。溶酶体酶带有分拣信号,GC膜上有识别分拣信号的受体。溶酶体水解酶的分拣信号是6-磷酸甘露糖(M6P)。
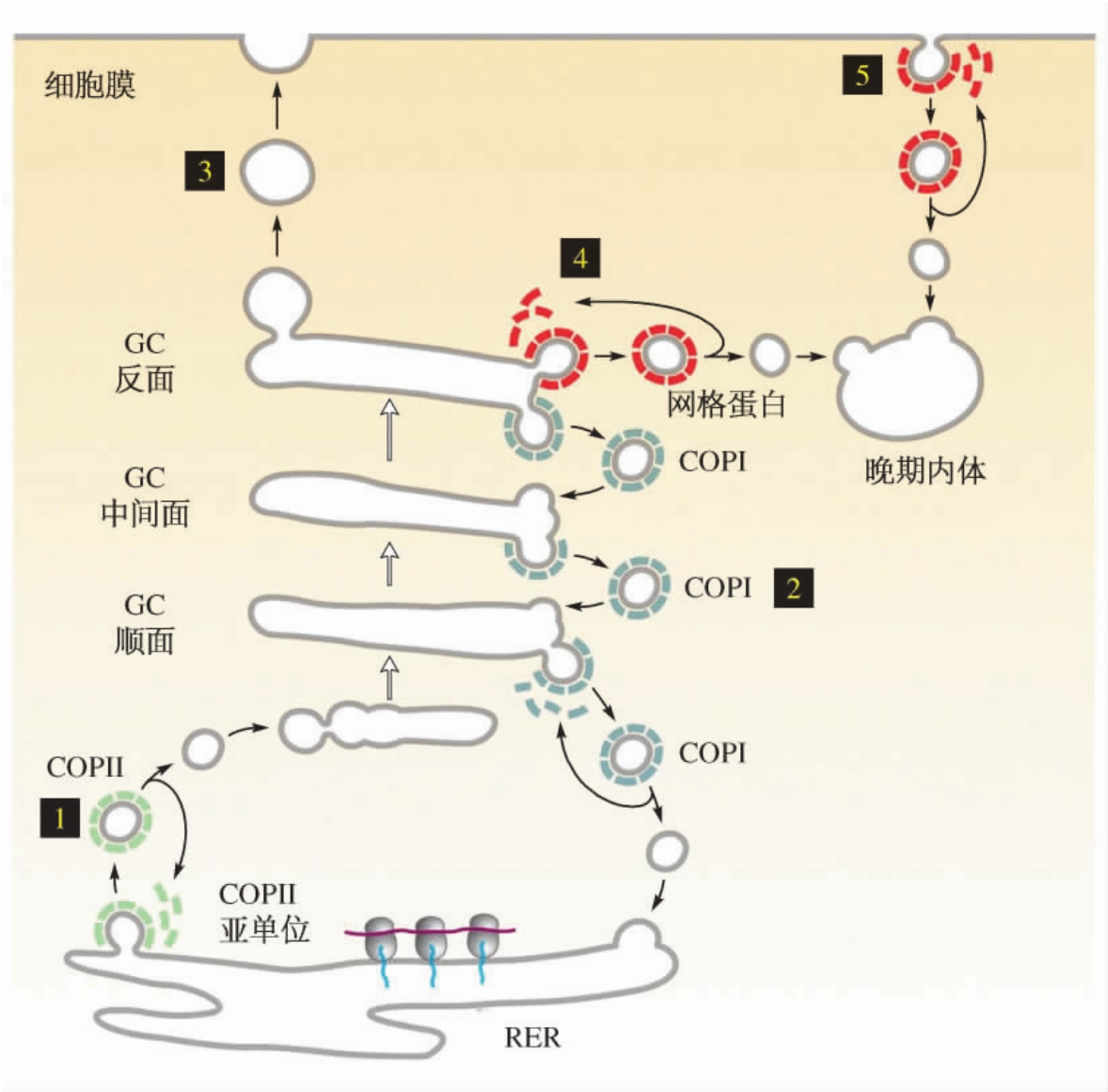
图4-17 新合成蛋白质的分拣运输
溶酶体酶蛋白在ER合成并经部分糖基化,然后运送到GC,在GC的顺面扁平囊,溶酶体酶蛋白上的部分甘露糖残基受磷酸转移酶催化,被磷酸化为M6P。由于M6P的存在,溶酶体酶在GC的运输过程中不会被切除。在GC反面扁平囊,M6P作为一种化学信号,被反面GC网膜上的M6P受体识别而结合,从而使溶酶体水解酶被选择性富集,并以出芽方式形成有网格蛋白外衣的运输小泡。运输小泡离开GC后很快失去网格蛋白并与内体融合,形成内溶酶体。在内溶酶体的酸性环境下,M6P与受体分离,M6P受体通过芽生小泡被转运回GC膜上。M6P与受体分离后,脱去磷酸根成为甘露糖,完成了溶酶体酶蛋白从GC向溶酶体的运输。
(二)蛋白质的分泌
从GC到细胞外和细胞表面的运输也是通过转运小泡来进行的。从GC芽生出的转运小泡,运送到细胞表面与细胞膜融合,一方面把小泡的内容物分泌到细胞外,同时为细胞膜提供新的膜蛋白和膜脂。蛋白质的分泌有两条途径,即结构性分泌途径和调节性分泌途径。
对有关分泌过程的认识,大多数来自对胰腺腺泡细胞的放射自显影研究。这种细胞合成的蛋白质大约85%是分泌型的,包括胰蛋白酶原、糜蛋白酶原、淀粉酶、脂肪酶和DNA酶等,为了解细胞的分泌活动提供了一个很好的模型。用3H-亮氨酸脉冲标记胰腺腺泡细胞,然后在无放射性的培养液中通过不同时间的追踪观察,3min后,放射自显影银粒主要集中于RER;20min后出现在GC;90min后则位于分泌泡。
五、膜流
细胞的各种膜相结构虽然有各自的空间位置,但它们之间的关系极为密切,彼此按一定的方式相互联系,构成一个统一的整体。伴随着蛋白质在细胞内的运输和排出过程,可观察到细胞的膜流(membrane flow)现象。例如,由ER芽生出的小泡,不断转移到GC的顺面扁平囊,形成新的膜囊。与此同时,在GC反面末端膨大形成分泌泡,分泌泡向细胞表面移动,最后与细胞膜融合,将内容物排出细胞外。以上过程,GC的扁平囊不仅接受来自ER的内容物,也使扁平囊膜不断更新增添;分泌泡不但自扁平囊带走了分泌物,而且也使扁平囊膜不断消耗,使细胞膜得到不断补充。另一方面,细胞通过胞吞作用,又使细胞膜的一部分转移到细胞内,与内溶酶体融合。
由于细胞的胞吞、胞吐作用,以及ER和GC的物质合成、加工、运输,使细胞膜发生移位、融合或重组,细胞内各种膜性结构相互联系和转移(图4-18)。这种膜流现象表明活细胞是处于活跃的生命运动状态,并与内外环境相互联系,维持着一个活细胞的动态平衡。
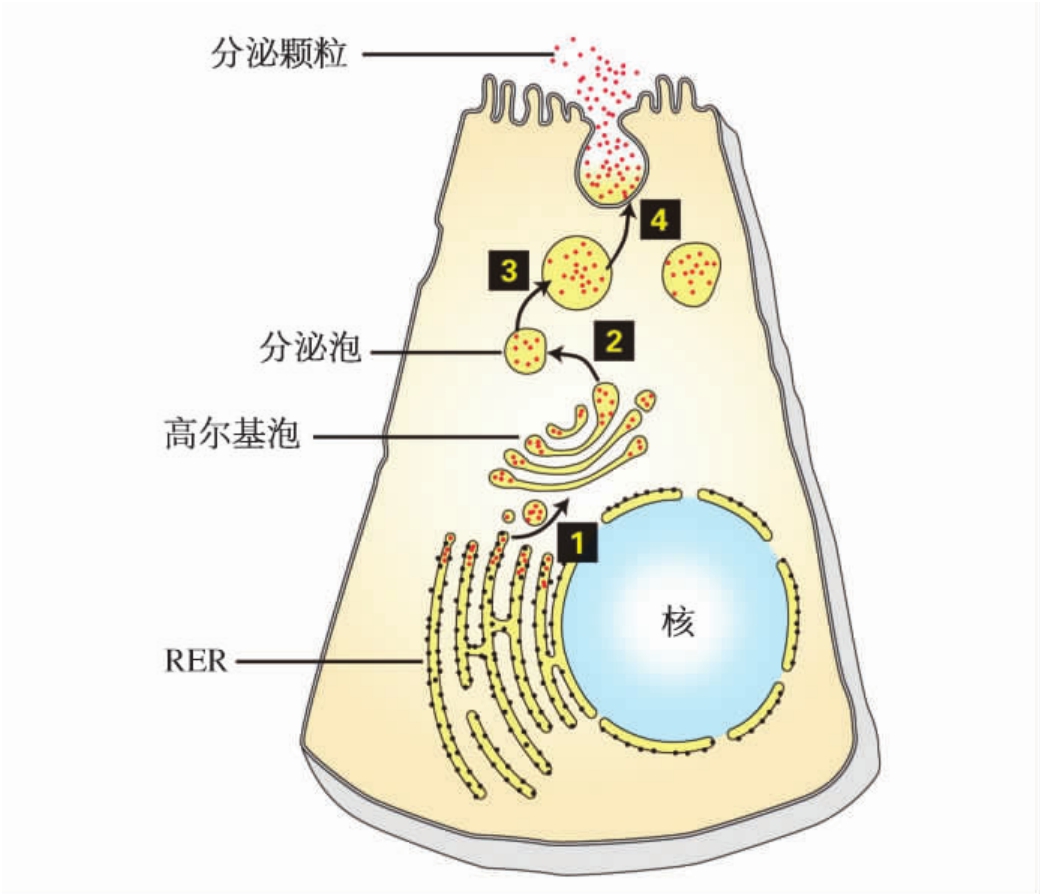
图4-18 分泌性上皮细胞的膜转移示意图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















