(一)一般治疗
1.去除或缓解基本病因 心脏疾病是发生心力衰竭的最基本原因。因此,首先应对导致心力衰竭的基本病因进行评价和干预,去除或缓解这些基本病因是治疗心力衰竭的根本手段。如瓣膜病患者的手术瓣膜置换;冠心病相关心力衰竭的冠状动脉血管血运重建术;甲状腺功能亢进性心脏病的抗甲状腺治疗等。
2.去除诱发因素 心力衰竭的发生还有许多诱发因素,积极防治这些诱发因素也是心力衰竭治疗的关键。包括控制感染、治疗快速性心律失常、纠正水电解质及酸碱紊乱等。
3.改善生活方式 改善生活方式可降低新的心脏损害的危险性。生活中应注意戒烟、戒酒、劳逸结合、适量运动、减轻体重。低脂饮食、适当限制钠水摄入。积极控制危险因素,如高血压、高脂血症、糖尿病等。
4.吸氧 主要适用于急性心力衰竭和慢性心力衰竭急性加重期。高流量鼻导管、面罩给氧,尽快使缺氧患者氧饱和度≥95%,慢性阻塞性肺疾病患者>90%。防治肺水肿可在湿化瓶内加入20%~40%乙醇,有消除泡沫的作用。如经鼻导管,面罩吸氧仍不能维持氧饱和度,可用无创通气(NIV),经呼吸器用面罩给氧。NIV目前常用CPAP或双向正压通气(BIPAP)。NIV带呼吸末正压(PEEP)功能可以减轻肺水肿,PEEP也可减少左心室后负荷,改善左心室功能。但心源性休克和右心衰竭患者为相对禁忌。吸氧浓度应≥40%,PEEP开始为5~7.5cmH2O,逐渐加到10cmH2O。
(二)药物治疗
心力衰竭的药物治疗主要包括两大类,一类是缓解症状药物,包括利尿药、血管扩张药、正性肌力药等;另一类是提高生存率和生活质量,改善预后的药物,包括血管紧张素转化酶抑制药(ACEI)、血管紧张素Ⅱ受体拮抗药(ARB)、β受体拮抗药、醛固酮受体拮抗药等。
1.利尿药 利尿药在心力衰竭治疗中起关键作用。多项指南指出,所有伴有体液潴留或原先有过液体潴留、有症状的心力衰竭患者,均应给予利尿药,直至肺部啰音消失、水肿消退、体重稳定,然后用最小剂量维持,一般需要长期使用,据液体潴留情况随时调整剂量,防止再次出现液体潴留。
常用的药物有髓襻利尿药(呋塞米、布美他尼、托拉塞米)、噻嗪类利尿药(氢氯噻嗪、美托拉宗)。指南强调,利尿药必须最早应用,以髓襻利尿药为首选,噻嗪类仅适用于轻度液体潴留、伴高血压和肾功能正常者。
2.血管扩张药 主要用于急性心力衰竭和慢性心力衰竭急性加重期,常用药物有硝酸酯类药物、重组人脑钠肽、硝普钠、某些α受体拮抗药(如乌拉地尔)。而哌唑嗪、肼屈嗪、酚妥拉明因降压作用明显和反射性心动过速不适合于心力衰竭患者。
对于慢性心力衰竭,血管扩张药未发现明确的作用。硝酸酯类药物直接作用于血管平滑肌,扩张小静脉和小动脉,并有较强的扩张冠状动脉的作用,可降低心脏的前后负荷,减低左心室充盈压、增加心排血量,解除肺淤血,可用于缓解心绞痛和呼吸困难症状,适用于缺血性心脏病的心力衰竭,但也不宜用于慢性心力衰竭的长期治疗。
重组人脑钠肽是一种新型血管扩张药,静脉输注对静脉、动脉和冠状动脉均有扩张作用,降低前、后负荷,增加心排血量,但无直接正性肌力作用。本品还有中度的利钠、利尿作用,促进钠外排,抑制肾素-血管紧张素-醛固酮系统和交感神经系统。改善血流动力学效果优于硝酸甘油,且不良反应更小,但可致低血压,不能改善预后。应避免与其他静脉用血管扩张药联合应用。
非洲-美洲心力衰竭试验显示,非洲裔美国心力衰竭患者在标准药物治疗的基础上,加用异山梨酯(ISDN)与肼屈嗪的固定复方制剂可以显著提高疗效、降低死亡率和其他重要临床事件的发生。但随后进行的血管扩张药治疗心力衰竭研究的Post-hoc分析中,使用血管扩张药者并未获得更多的临床益处。因此,肼屈嗪与异山梨酯联合应用仅适用于有心力衰竭症状和LVEF<40%而且ACEI和ARB不能耐受的患者,或用ACEI、β受体拮抗药、ARB或醛固酮受体拮抗药后仍有症状的心力衰竭患者。
3.强心苷与非强心苷正性肌力药 强心苷作为传统的正性肌力药,已应用于心力衰竭的治疗200余年,地高辛是唯一经过安慰剂对照临床试验评估的洋地黄制剂,也是唯一被美国食品药品管理局确认能有效治疗慢性心力衰竭的洋地黄制剂。1977—1997年,16个双盲、随机、安慰剂对照试验证实地高辛在治疗浓度时,具有良好正性肌力、血管扩张、降低神经内分泌活性的作用。
对于有症状的心力衰竭合并心房颤动的患者,地高辛可以减慢心室率。对于窦性心律、LVEF<40%的有症状心力衰竭患者,地高辛可以提高左心室功能和患者的生活质量,减少因心力衰竭恶化住院的概率,但对生存率无影响。在急性心力衰竭时,可选用毛花苷C静脉注射。
非强心苷正性肌力药主要包括β肾上腺素能受体激动药(多巴胺、多巴酚丁胺)、磷酸二酯酶抑制药(米力农)、细胞内钙离子增敏剂(左西孟旦)。
虽然非强心苷正性肌力药可以快速地改善急性心力衰竭患者的血流动力学和临床状况,但是它们可以促进和加速一些不良病理生理因素发展,造成进一步的心肌损伤,并导致近期和远期的死亡率上升。在某些心源性休克情况下,正性肌力药物可避免血流动力学逐步衰退或恶化,维持生命,有助于进行目标更明确的治疗,如机械循环支持,心室辅助装置或心脏移植。
非强心苷正性肌力药只用于收缩压低或心脏指数低伴有血流灌注不足或有充血体征的患者,这类患者多伴有酸中毒、肾功能受损、肝功能异常或心理状态不佳。正性肌力药应尽早使用,当器官灌注量恢复正常和(或)充血减轻时应尽快停药。大多数正性肌力药输注时伴有房性和室性心律失常的发病率增加,心房颤动患者使用多巴酚丁胺/多巴胺可能导致室性心动过速,故应用正性肌力药时,应加强临床和心电图监测。
左西孟旦是新一代的钙增敏剂,可通过在心肌细胞与肌钙蛋白C结合而改善心肌收缩力。它通过介导腺苷三磷酸(ATP)敏感性钾通道发挥血管舒张作用,并有轻度磷酸二酯酶抑制作用。左西孟旦注射治疗急性左心衰竭,可以增加心排血量和每搏量,并降低肺动脉楔压、全身血管阻力和肺血管阻力。从左西孟旦的临床应用看来,能改善失代偿性急性心力衰竭症状及血流动力学,不增加死亡率,可用于低心排血量、左心室充盈压升高、对其他治疗反应差的患者,但需注意低血压及心率增快。
4.血管紧张素转化酶抑制药 ACEI治疗心力衰竭的机制包括两方面:①抑制肾素-血管紧张素-醛固酮系统,改善和延缓心室重塑;②作用于激肽酶,抑制缓激肽的降解,使扩张血管的前列腺素生成增加、并具有抗增生作用。ACEI治疗数周(月)后才有症状改善,虽然有时治疗症状无明显改善,但可以降低心力衰竭进展的危险。ACEI应用的基本原则是:从小剂量开始,如能耐受则逐渐增加剂量。一般每隔3~7d剂量倍增1次。剂量调整的快慢取决于患者的临床情况,有低血压史、低钠血症、糖尿病、氮质血症及服用留钾利尿药者,递增速度宜慢。增加剂量不取决于患者的症状是否改变,只要患者能耐受,可一直增加到最大耐受量。剂量达到目标剂量或最大耐受量后,应长期维持应用。各种ACEI对心力衰竭患者症状、临床状况、死亡率或疾病进展未发现明显差别。
5.血管紧张素Ⅱ受体拮抗药 ARB与ACEI作用机制相似,也是通过抑制肾素-血管紧张素-醛固酮系统发挥作用。因缺少抑制缓激肽降解作用,因而极少引起干咳。ARB可用于阶段A患者以预防心力衰竭发生;亦可用于不能耐受ACEI的阶段B、C、D的患者,替代ACEI作为一线治疗,以降低死亡率和并发症发生率。ARB的应用原则与ACEI相似,应小剂量起用,在患者耐受的基础上逐渐将剂量增至推荐剂量或可耐受的最大剂量。在开始应用ARB及改变剂量的1~2周内,应监测血压(包括直立位血压)、肾功能和血钾,如出现肾功能恶化或血钾升高就不能调整剂量。
ARB治疗心力衰竭有效,但其效应是否相当于或胜于ACEI尚无定论,当前仍不宜以ARB取代ACEI广泛用于心力衰竭患者的治疗,未应用过ACEI和能够耐受ACEI的心力衰竭患者,仍以ACEI为首选。
ARB和ACEI合用治疗慢性心力衰竭是否优于单用ACEI是一个有争议的问题。由于ARB在受体水平上阻断血管紧张素Ⅱ的不利作用,而ACEI可通过增高缓激肽水平获取部分效应,因此,两类药物在作用机制上存在互补性,联合应用有其理论基础。但临床试验的结果明显不同,Val-HeFT试验和CHARM-Added研究显示,在ACEI基础上加用ARB有增量效益,能显著降低病残率;而VALIANT和DNTARGET试验则表明,ACEI与ARB合用不能进一步获益,反而增加不良反应。Lakhdar等汇总分析9项随机临床试验共18 160例心力衰竭或左心室功能异常患者的资料,结果显示ACEI与ARB合用使需停药的不良反应事件增加2.3%(危险比1.27,P<0.0001﹚。对于常规治疗(包括ACEI和β受体拮抗药)后症状持续存在且LVEF低下的心力衰竭患者,欧洲心力衰竭指南(2008)强烈推荐加用ARB治疗(Ⅰ类,A级),而我国心力衰竭指南(2007)推荐级别较低(Ⅱa或Ⅱb,B级),美国心力衰竭指南(2009)则推荐级别更低(Ⅱb,B级)。我们认为,根据现有证据,ACEI与ARB合用不宜普遍提倡。
6.β受体拮抗药 β受体拮抗药可以有效拮抗交感神经系统、肾素-血管紧张素系统及过度激活的神经体液因子,在心血管疾病恶性循环链中起到重要的阻断作用,不仅通过降低血压、减慢心率、降低心肌耗氧量来保护心肌,而且通过对儿茶酚胺的抑制,使儿茶酚胺引起的心脏和外周恶性循环导致的不良后果降至最低。另外,β受体拮抗药独特的抗心律失常作用,在预防心脏性猝死方面发挥重要作用。因此,除非有禁忌证或不能耐受,有症状和LVEF≤40%的所有患者均应使用β受体拮抗药,β受体拮抗药可以改善左心室功能,减少因心力衰竭恶化住院的概率,提高生存率。
β受体拮抗药是一种很强的负性肌力药,治疗初期对心功能有抑制作用,但长期治疗(≥3个月)则改善心功能,使LVEF增加,因此只适用于慢性心力衰竭的长期治疗。对急性失代偿性心力衰竭患者、难治性心力衰竭需静脉应用正性肌力药的患者和因大量体液潴留而需强力利尿者不宜应用β受体拮抗药。
目前有证据支持用于心力衰竭的β受体拮抗药有:选择性β1受体拮抗药(如美托洛尔、比索洛尔);兼有β1、β2和α1受体拮抗药(如卡维地洛、布新洛尔)。必须从极低剂量开始,如美托洛尔缓释片12.5mg,每日1次;比索洛尔1.25mg,每日1次;卡维地洛3.125mg,每日2次。如患者能耐受前一剂量,可每隔2~4周将剂量加倍,如前一剂量出现不良反应,可延迟加量计划直至不良反应消失。剂量的调整不以治疗反应确定,应达到设定的目标剂量或最大耐受量并长期维持。
7.醛固酮受体拮抗药 心力衰竭患者应用ACEI,短期可降低醛固酮水平,但长期应用血中醛固酮水平并不能维持稳定持续地降低,出现醛固酮的逃逸现象。因此,心力衰竭患者在使用ACEI或ARB基础上联合应用醛固酮受体拮抗药是合理的。除非有禁忌或不能耐受,所有LVEF≤35%和有严重心力衰竭症状(如NYHA心功能Ⅲ级、Ⅳ级)的患者,如无高钾血症、明显的肾功能不全,均可考虑用小剂量的醛固酮受体拮抗药。在ACEI或ARB治疗基础上加用醛固酮受体拮抗药可减少因心力衰竭恶化住院的概率和提高生存率。心力衰竭患者应用此类药物的目的是“生物学治疗”而不是作为利尿药应用,剂量不宜过大,一般认为每日10~20mg。2007年中国慢性心力衰竭诊断和治疗指南强调:必须与髓襻利尿药合用、停用钾盐及减低ACEI剂量。
8.其他药物
(1)窦房结抑制药——伊伐布雷定:伊伐布雷定是一种选择性窦房结If通道阻滞药,它可特异性阻断If通道,以剂量依赖性方式抑制If电流,从而控制连续动作电位的间隔,降低窦房结节律,最终减慢心率。与传统减慢心率药物β受体拮抗药、非二氢吡啶类钙通道阻滞药相比,伊伐布雷定的作用有以下特点:①无负性传导和负性肌力作用;②对血压无影响;③对糖脂代谢无影响;④进一步延长心室舒张期充盈时间;⑤对冠状动脉及外周动脉无收缩作用。
2010年颁布的窦房结抑制药伊伐布雷定治疗收缩期心力衰竭试验(SHIFT)不仅使伊伐布雷定这种新药一鸣惊人,广受关注,而且也是心力衰竭药物研究领域的一个重大突破。SHIFT亚组分析显示,伊伐布雷定可降低因心力衰竭的住院率(减少25%,P=0.000 2)和再住院率。随心率持续下降,伊伐布雷定可降低因心力衰竭恶化的总住院率、再发心力衰竭住院率,减少首次和再住院的时间。这一研究表明,窦性心律、心率≥70/min的慢性心力衰竭患者,应用伊伐布雷定可持续降低临床恶化的风险,改善患者的生活质量。其适应证为:①窦性心律,左心室射血分数(LVEF)≤35%,NYHA心功能分级Ⅱ—Ⅳ级,已应用β受体拮抗药、ACEI或ARB、醛固酮受体拮抗药后,仍有心力衰竭症状、心率≥70/min者,应考虑加用伊伐布雷定,以降低因心力衰竭的住院风险(ⅡaB);②对症状性心力衰竭(NYHA心功能分级Ⅱ—Ⅳ级)、左心室收缩功能不全患者、稳定性心绞痛不能耐受β受体拮抗药的窦性心律患者,应考虑用伊伐布雷定缓解心绞痛(ⅡaA);③对窦性心律、LVEF≤35%、心率≥70/min且不能耐受β受体拮抗药的患者,可使用伊伐布雷定降低心力衰竭住院风险(ⅡbC)。
(2)内皮素受体拮抗药:内皮素(ET)不仅是一种血管收缩因子,还是一种具有细胞因子样活性的多功能肽,具有广泛的病理生理作用。心力衰竭患者,血浆ET-1水平明显升高。而且,血浆ET-1水平升高程度与患者心力衰竭症状、血流动力学恶化程度及心功能NYHA分级呈正相关。因此,ET-1受体成为心力衰竭治疗的靶点之一。动物实验显示,内皮素受体拮抗药可以改善心力衰竭动物模型的血流动力学,防止左心室肥厚和扩张,增加心排血量,甚至可延长生存期。在人类中进行的短期临床试验也显示,对于有症状的心力衰竭患者,在标准三联药物治疗基础上,短期(2周)加用波生坦(1.0g,每日2次)可以降低肺动脉压、肺毛细血管楔压和右心房压,降低肺循环和体循环阻力,提高心排血量,而不改变心率,也不激活其他神经激素系统。随后的HEAT试验显示,在分别给予达芦生坦每日30mg、100mg、300mg,共治疗157名心力衰竭患者也取得良好疗效,但与低剂量组相比,高剂量组有导致更多不良事件(包括死亡)的趋势,尤其是早期心力衰竭恶化。在REACH-1研究中,随机接受波生坦,500mg每日2次的患者肝毒性发生率增加,而在波生坦125mg每日2次的患者,耐受性好,疗效与高剂量相似。然而,也有ENABLE及EARTH等临床试验表明,波生坦和达芦生坦并不能有效降低慢性心力衰竭的住院率、病死率和病残率,相反治疗早期有加重心力衰竭导致住院的倾向。
(3)精氨酸加压素受体拮抗药:精氨酸加压素(AVP)又称抗利尿激素(ADH),是一种有重要心血管和肾作用的神经肽类激素,在维持机体体液和电解质平衡中发挥重要作用,其过度不适当分泌是导致顽固性液体潴留和低钠血症的常见原因。研究发现,慢性心力衰竭患者体内高水平的AVP是导致低钠血症和死亡率居高的原因之一。目前,尚没有药物可以直接抑制AVP的产生,临床上降低AVP活性主要是通过阻断AVP受体起作用。临床上现有的AVP受体拮抗药包括选择性的V2受体拮抗药托伐普坦、利赛伐坦、沙他伐坦、莫扎伐坦,均为口服制剂,以及非选择性的V1A/V2受体拮抗药,均可有效纠正心力衰竭患者的低钠血症,显著减轻患者的体重,改善患者的液体潴留症状。目前,AVP受体拮抗药临床应用的唯一指证是心力衰竭合并低钠血症。但AVP受体拮抗药长期应用的有效性、安全性有待更进一步的临床证实。
(4)他汀类药物:他汀类药物是一种多效性药物,它可以通过抗炎、抗氧化、抗自由基损伤,升高血管及心肌组织中NO的合成、抑制心肌局部ACE的活性、降低局部血管紧张素Ⅱ受体水平、抑制基质金属蛋白酶的产生等作用达到抑制心肌纤维化,改善心肌重构,对心肌细胞具有保护作用,可能有益于慢性心力衰竭的治疗。
在早期的北欧辛伐他汀生存研究(4S)中,其亚组分析显示,辛伐他汀治疗组因心力衰竭而死亡的发生率为25.2%,明显低于未服辛伐他汀组(31.9%,P<0.05)。随后发表的冠心病二级预防的临床研究如胆固醇和冠心病复发事件研究(CARE)等也证实,他汀类药物治疗可以降低心力衰竭的发生率和住院率。此后,有许多新的证据支持他汀类药物对心力衰竭治疗的临床益处。从心力衰竭队列中选取24 598例患者,平均随访2.4年,探讨他汀类药物使用对慢性心力衰竭死亡风险和住院率的影响。结果发现,他汀类药物治疗可使心力衰竭患者死亡相对风险降低24%,住院风险减少21%。在一项对更大人群(N=54 960)的回顾性观察分析中,研究者发现,他汀类药物可显著降低心力衰竭患者的长期死亡率,且这种临床益处独立于血浆胆固醇水平和冠状动脉疾病状态。一项对缬沙坦心力衰竭研究(Val-HeFT)的回顾性事后分析,探讨5 010例轻至中度的心力衰竭患者在基线时使用他汀类药物对终点事件的影响。结果表明,使用他汀类药物可以在2年内显著降低心力衰竭死亡风险,并且缺血性心力衰竭患者较非缺血性心力衰竭患者更多地从他汀类药物治疗中受益。另一项评估他汀类药物对缺血性和非缺血性收缩性心力衰竭患者治疗疗效的队列研究显示,在入选时服用了他汀类药物的患者具有更低的急性心脏移植率和死亡率,并且在调整了基线胆固醇水平和心功能分级后,他汀类药物治疗是患者预后改善的独立预测因素。心力衰竭心脏猝死研究(SCD-HeFT)亚组分析显示,他汀类药物治疗在缺血性和非缺血性心力衰竭患者中均可显著降低全因死亡率,由此更进一步支持他汀类药物对缺血性和非缺血性心力衰竭患者相似的临床益处。Fukuta等观察了他汀类药物对舒张性心力衰竭患者死亡率的影响,137例射血分数≥50%的心力衰竭患者入选,随访(21±12)个月,他汀类药物可降低舒张性心力衰竭的死亡率及患者患病率。他汀类药物治疗伴随存活率实质改善(相对死亡危险0.22;95% CI为0.07~0.6,P=0.006)。但最近公布的UNIVERSE和GISSI心力衰竭研究(GISSI-HF)研究却让人开始质疑他汀类药物对心力衰竭治疗的疗效,在左心室射血分数、左心室容积、炎症标记物等方面并无显著差异。因此,临床上将他汀类药物应用于慢性心力衰竭患者仍需谨慎。因为现有的阳性临床试验,因样本量太小或是仅为回顾性研究,所提供的信息非常有限,并且大规模前瞻性的CORONA研究和GISSI心力衰竭研究(GISSI-HF)研究因其出乎意料的阴性结果更让人质疑他汀类药物对心力衰竭患者的临床益处。此外,有研究表明,他汀类药物对心力衰竭患者还可能存在潜在的不利影响。
他汀类药物可抑制甲羟戊酸-异戊二烯合成途径,而使辅酶Q10合成减少。因此,他汀类药物有可能影响线粒体功能,损伤患者心肌和骨骼肌功能。并且,目前已有研究证实辅酶Q10缺乏与心力衰竭严重程度相关,而补充辅酶Q10则可明显改善患者的症状和体征。因此,有学者推荐,接受他汀类药物治疗的慢性心力衰竭患者,可考虑同时服用泛癸利酮,以防止他汀类药物所产生的不良反应。
已知慢性心力衰竭时,内毒素(细菌脂多糖)增加,并刺激炎性细胞因子产生增多,而血浆中富含胆固醇或三酰甘油的脂蛋白可能具有凝固或中和内毒素的作用。因此,有人推测,由于他汀类药物的调脂作用减少了血浆脂蛋白水平,从而可增加内毒素的作用。这就有可能导致炎性细胞因子水平升高,从而对慢性心力衰竭的预后产生不利的影响。
将他汀类药物应用于治疗慢性心力衰竭,不仅具有以上所提到的顾虑,将患者的胆固醇水平降至何种程度也是尚待解决的问题,这也将大大阻碍他汀类药物在心力衰竭治疗中的应用。
(5)心肌能量药物:2004年Bilsea等首次提出了心肌“代谢重构”(metabolic remodeling)的概念,即心力衰竭时,心肌糖类和脂肪的物质代谢紊乱引起心脏能量代谢途径改变,导致细胞结构和功能异常的现象。衰竭心肌对葡萄糖的利用增加,而对脂肪酸的利用减少。在心力衰竭早期,脂肪酸的氧化代谢率保持正常或轻微增加,而在晚期或终末期心力衰竭时,脂肪酸的氧化代谢显著下调。心力衰竭时线粒体功能障碍除了产生ATP减少外,还导致活性氧类(ROS)的大量产生,这不但加重线粒体DNA结构和功能损害,还将触发线粒体所诱发的心肌细胞凋亡,如此形成恶性循环。衰竭心肌中ATP产生和利用均降低。现已研制出曲美他嗪、泛癸利酮、乙莫克舍、哌克昔林等数种药物,可以使心肌能量代谢底物,由非酯化脂肪酸转化为葡萄糖和乳酸,提高心肌氧化利用率,在细胞水平发挥心肌保护作用。但目前这类药物疗效尚不确定,并不推荐作为常规使用。
(6)非类固醇类盐皮质激素受体拮抗药:现有醛固酮受体拮抗药治疗慢性收缩性心力衰竭效果良好,包括降低全因死亡率,但其作用有局限性,如可引起高钾血症、肾功能障碍和男性乳腺发育(螺内酯的孕激素作用),这与其类固醇基本特性有关。寻找既有醛固酮拮抗作用,又非类固醇的盐皮质激素受体拮抗药是抗心力衰竭药开发与研究的重要方向。
BAY94-8862已证实其盐皮质激素受体选择性优于螺内酯,又较依普利酮有更强的盐皮质激素受体亲和性。动物实验表明,该药在大鼠冠状动脉结扎模型中改善等容收缩期左心室内压力上升的最大速率(dp/dt max)和最小速率(dp/dt min),降低左心室舒张末压(LVEDP)、N末端脑钠肽前体(NT-proBNP)水平,降低心、肺的骨桥蛋白;对有卒中倾向的自发性高血压大鼠模型,可改善生存率,减少蛋白尿/肌酐比例,减少肾损害和骨桥蛋白尿。
(7)其他:用于心力衰竭的药物还有血管肽酶抑制药(如奥马曲拉)、肾上腺髓质素、肾素抑制药(如阿利吉仑)、松弛素、肿瘤坏死因子抑制药(如依拉西普)等。这些药物在心力衰竭治疗中的有效性和安全性均缺乏有说服力的临床试验证据支持。
(三)非药物治疗
1.心脏再同步化治疗(CRT) 心力衰竭患者往往合并传导异常,引起房室、室间和(或)室内运动不同步。CRT就是通过置入右心室及左心室电极,同时起搏左、右心室,通过这种多部位起搏恢复心室同步收缩。对于心力衰竭伴心室失同步的患者,这种治疗可以改善左心室整体功能,增加左心室充盈时间,改善患者的心脏功能,提高运动耐量及生活质量;同时还可逆转左心室重构。CRT治疗心力衰竭的机制为:调整房-室间期,纠正舒张功能障碍;调整室-室间期,获得最佳的心室收缩功能;纠正后乳头肌功能不全,减少二尖瓣反流;减少室内分流,逆转左心室重构;纠正电和机械功能延迟偶联现象。2008年AHA/ACC/HRS指南推荐的CRT治疗适应证见表1-3。
表1-3 2008年AHA/ACC/HRS指南推荐CRT的适应证
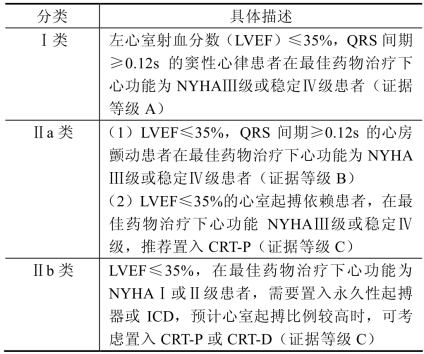
近期的一些临床试验证实,CRT的适应证进一步扩大如下:①缺血性心肌病NYHAⅠ或Ⅱ级,QRS时间≥130ms且LVEF≤35%患者;②非缺血性心肌病NYHAⅡ级,QRS时间≥130ms且LVEF<35%患者;③长期依赖心室起搏的永久起搏器置入患者。当然,这些新的适应证还需要进一步的临床研究确认其价值。
近几年来,更加重视心力衰竭患者猝死的预防,主张对符合CRT适应证且为猝死高危人群,尤其是心肌梗死后或缺血性心肌病心功能不全患者,有条件应尽量置入双心室起搏和除颤器(CRT-D)。
总之,CRT是治疗慢性心力衰竭的新方法,越来越多的大规模多中心临床试验证明了CRT的重要性、有效性,患者的近期疗效显著,生活质量明显提高。但是远期疗效如何,能否降低患者的死亡率,延长患者的寿命,尚需长期观察。CRT置入成功的关键是左心室起搏导线的置入;CRT起搏器置入后需选择最佳参数,保证100%的心室起搏、优化房室间期等。
2.心脏复律除颤器(ICD) 心力衰竭患者约半数死于心脏猝死,其原因为室性心动过速或心室颤动,ICD则可预防心血管事件的发生。
ICD二级预防效果的临床试验AVID、CASH、CIDS显示对于高危严重心力衰竭患者(如心脏停搏、心室颤动、血流动力学不稳定室性心动过速患者),置入ICD可降低总死亡率和心律失常所致死亡。ICD一级预防效果的MADIT和心力衰竭心脏性猝死试验SCD-HeFT,结果显示中度心力衰竭(NYHAⅡ—Ⅲ级)患者,LVEF≤30%,接受常规治疗加ICD治疗的病死率明显低于未置入ICD者。COMPANION研究也显示CRT加ICD治疗组死亡率明显低于药物治疗组和单用CRT治疗组。
2005年ESC、ACC/AHA慢性心力衰竭诊断与治疗指南建议,有心脏停搏、心室颤动或血流动力学不稳定室性心动过速病史,而预后相对较好的心力衰竭患者置入ICD作为二级预防(Ⅰ类)。2009年ACC/AHA成人心力衰竭指南,ICD置入的一级预防强调,经最佳治疗后及患者预期能以较好的心功能状态生存超过1年,并且有下列指征者:缺血性心脏病、心肌梗死后40d以上,NYHA心功能分级Ⅱ—Ⅲ级且LVEF≤35%的患者(Ⅰ类,A级);非缺血性扩张型心肌病,NYHA心功能分级Ⅱ—Ⅲ级且LVEF≤35%的患者(Ⅰ类,A级)。
总之,ICD可以有效改善心力衰竭患者的生存率,已被列入ICD应用的Ⅰ类适应证。
3.机械辅助循环(MCS) MCS装置是连接于心脏或置入心脏内,承担部分或全部心功能的多种装置的总称,广义上包括主动脉内球囊反搏(IABP)、心室辅助装置(VAD)、全人工心脏(TAH)及体外膜肺氧合(ECMO)等。
MCS装置的核心结构是驱动血液流动的血泵。按照血泵驱动方式,MCS装置可分为气动型、电动型及磁驱动型;按照血泵的放置部位可分为置入式和非置入式;按照血泵提供血流情况,可分为搏动泵和非搏动泵。另一种方法将血泵分为移位泵和旋转泵。一般而言,当患者的心脏无法为全身提供足够的氧供以维持终末器官的正常功能,且内科药物治疗无效时,就应考虑进行MCS。置入MCS装置的血流动力学指标包括收缩压<80mmHg,平均动脉压<65mmHg,心脏排血指数<33.34ml/(s·m2),左心房或肺毛细血管楔压>20mmHg和体循环阻力>210kPa/(s·L)。
按照MCS的用途,其适应证包括:①心脏恢复过渡,为短期辅助,时间短于1个月。用于治疗各种急性心源性休克,心室功能有可能恢复的患者,包括心脏术后低心排血量综合征、心肌梗死后心源性休克、急性心肌炎、顽固性室性心律失常及其他情况。可用装置有IABP、ECMO、离心泵、LVAD等。②心脏移植过渡,为中长期辅助,辅助时间30d至1年以上。用于适合心脏移植的各种终末期心力衰竭患者。③永久性置入,为长期置入MCS装置从而替代心脏移植。适用于患者不可逆性心力衰竭,但不适合心脏移植的患者。
目前临床应用的常见装置如下。
(1)主动脉内球囊反搏(IABP):IABP是当前最易置入、应用最广泛的MCS装置。包括球囊导管和反搏机器两部分。通过动脉系统在降主动脉内左锁骨下动脉开口远端置入一根带球囊的导管,用心电触发及控制形成同步反搏。心脏舒张期球囊充气,挤出与球囊容积相等的血液,使球囊近心端的主动脉舒张压升高,提高冠状动脉灌注压,增加心肌供血;心脏收缩期主动脉瓣开放的瞬间球囊排空,主动脉压力下降,降低心脏后负荷和心脏射血阻力,降低心肌耗氧量。适应证包括心脏手术高危患者的预防性应用(如严重瓣膜病术前NYHA心功能Ⅳ级、冠心病术前左心室射血分数<30%);心脏手术后脱离CPB困难或低心排血量综合征;心脏移植后辅助;急性心肌梗死合并心源性休克、顽固室性心律失常、顽固性心绞痛等。主动脉瓣和主动脉病变为禁忌证。
IABP的置入指征:①心脏排血指数<33.34ml/(s·m2)。②平均动脉压<50mmHg,左心房平均压>20mmHg,中心静脉压>15cmH2O。③尿量<0.5ml/(kg·h)。④末梢循环差,手足凉。⑤多巴胺用量>20μg/(kg·min)或者联用两种以上升压药物血压仍有下降趋势者。
IABP的撤离指征:①心脏排血指数>41.68ml/(s·m2)。②动脉收缩压>90mmHg,左心房平均压及中心静脉压恢复正常。③尿量>1ml/(kg·h)。④末梢循环好,手足暖。⑤多巴胺用量<5μg/(kg·min),血管活性药物可逐渐减少。⑥血气分析正常。⑦减低反搏频率时血流动力学状态稳定。
(2)体外膜肺氧合(ECMO):ECMO是将血流引流至体外,经膜肺氧合后,由血泵输入体内,通过长时间的转流,对呼吸和(或)循环衰竭患者进行支持,维持机体氧供,去除体内CO2以保证机体代谢。心脏直视手术后低心排血量综合征是ECMO的主要指征之一,儿科患者应用较多,成人应用经验较少。其他适应证包括心源性休克、原发性呼吸衰竭、败血症、肺炎、心肺移植围术期支持等。
(3)心室辅助装置:离心泵的应用广泛,易于操作,费用较低。用于心脏恢复过渡时,可提供左、右或双心室辅助。其缺点是需全身抗凝,有出血并发症,可引起组织间隙水肿,患者无法活动,因而不适宜长期应用。目前临床应用的各种离心泵的辅助效果相似,主要并发症包括出血、肾衰竭、感染和血栓栓塞。
(4)全人工心脏(TAH):TAH提供完全的循环支持,但必须切除患者的自体心脏。其最重要的用途是为急需双心室辅助及LVAD不能循环的患者提供心脏移植过渡。
4.血液超滤治疗 血液超滤是利用机械方式去除多余液体的一种治疗方式。与利尿药不同,该项技术不产生电解质变化,而且可以精细调节。是运用对流的原理,利用血泵式人体动静脉压力阶差,通过微孔过滤器清除血液中的水分、血浆和小分子溶质的治疗手段。悬浮的固体和大分子溶质不能被清除,电解质以相同的浓度被清除。因此,血液超滤不会导致电解质变化。
血液超滤与血液透析不同,血液透析通过配制的透析产生浓度梯度,可透析的物质从血液弥散至透析液,直到两种液体建立平衡为止,从而达到清除血液中不需要物质的目的。血液超滤不能清除有毒的物质。因而,血液超滤并不是血液透析的一种替代方式。血液超滤通过对流方式清除血浆多余水分,在治疗水肿中起了主要的作用。新一代的血液超滤仪,其设计只能执行超滤,而不能进行血液透析。但其体积小而且简单,适合于更多的临床情况。
血流超滤可以是单纯性、持续性或间断性的。随着适当的超滤速率,细胞外液逐渐充填至血管腔,从而保持一定的血容量。准确的体液清除量、恰当的体液清除速率及循环血容量的维持至关重要。
血液超滤是清除心力衰竭患者多余体液的安全有效的方法,能够改善充血症状,降低心室充盈压,提高心排血量,降低神经激素水平,纠正低钠血症,减少利尿药需求。美国心脏病学院/美国心脏学会指南将血液超滤用于对药物治疗无效的顽固性心力衰竭患者(Ⅱa,B级)。然而,血液超滤长期应用的安全性及能否降低死亡率没有结论,故心力衰竭患者的超滤治疗应慎重。
5.迷走神经刺激器 自主神经功能紊乱是心力衰竭的特征之一,主要表现为迷走神经活性减弱及交感神经活性增强,自主神经改变促使左心室功能紊乱及心肌重构。一种新型的迷走神经刺激器已应用于临床,其由三部分组成。①刺激迷走神经的电极:该电极在外科手术暴露颈迷走神经干后,袖式包绕其外部,刺激迷走神经干;②起搏器:置于右胸前区,可发现右心室起搏脉冲和迷走神经干刺激脉冲;③右心室电极:置于右心室心尖部。治疗时,脉冲刺激在QRS波感知70ms后发放,脉宽1ms,刺激频率与自身心率相同或55/min,呈间歇性发放,其发放的电脉冲可兴奋迷走神经,减慢心率,减弱心肌收缩力,降低交感神经活性。治疗适应证为:窄QRS波的中、重度心力衰竭,LVEF<35%的Ⅱ—Ⅳ级心功能者,舒张性心力衰竭、伴心房颤动的心力衰竭,CRT治疗无反应者。
此外,过去用于治疗慢性疼痛的胸段脊索刺激装置,现在也试用于治疗慢性心力衰竭。该装置可发射低强度电脉冲至硬膜下间隙的神经,其原理为刺激自主神经,恢复迷走神经兴奋性,可改善心力衰竭症状。
6.外科治疗
(1)同种异体心脏移植:心脏移植疗效最为明确且最优,是终末期心脏病的首选方案。但受限于供体的严重缺乏,仅有低于5%的终末期心力衰竭患者有机会接受心脏移植治疗。
(2)其他外科治疗:其他外科治疗方法如左心室减容术、动力性心肌成形术,激光心肌血运重建术,以及危重病例的瓣膜成形术等技术,均表现出一定程度的心功能改善作用,但长期疗效难以确定。
7.干细胞移植 干细胞移植包括骨骼肌干细胞、骨髓单个核细胞、内皮祖细胞、骨髓间充质干细胞和外周血干细胞等。一些临床试验证明,干细胞移植可以明显改善急性心肌梗死及心力衰竭患者的心功能。但目前干细胞治疗心力衰竭仍处于基础研究到临床应用的过渡期。
8.康复治疗 慢性心力衰竭的治疗不仅包括充分的药物治疗,积极的康复锻炼对减轻症状,改善预后同样有重要作用。运动是心力衰竭康复的核心部分,美国心脏病学院已将运动疗法作为慢性稳定性心力衰竭患者的常规疗法。有规律的运动训练能减小左心室收缩末期参数,改善心肌侧支循环,降低舒张期充盈压和拮抗心肌重塑。运动包括耐力锻炼、阻力锻炼和间歇性锻炼。运动的方式主要为床上活动、呼吸肌锻炼、医疗步行、跑步、游泳、蹬车和爬楼梯、气功、太极拳、医疗体操等。运动锻炼适用于所有的稳定心力衰竭患者,心功能Ⅱ—Ⅲ级心力衰竭患者进行运动治疗是安全可行的。而末得到很好控制的心力衰竭和心功能Ⅳ级的心力衰竭患者运动是禁忌的。
(王福军 罗亚雄 刘红霞)
参 考 文 献
[1] 吴彦.心力衰竭防治—从指南到实践.北京:北京大学医学出版社,2011:1-97
[2] 孙小强,李锦爽,郎玉洁,等.辽宁省农村心力衰竭流行病学及治疗状况调查.中国实用内科杂志,2009,29(11):1000-1002
[3] 顾东风,黄广勇,何江,等.中国心力衰竭流行病学调查及其患病率.中华心血管病杂志,2003,31(1):3-6
[4] 中华医学会心血管病学分会.中国部分地区1980、1990、2000年慢性心力衰竭住院病例回顾性调查.中华心血管病杂志,2002,30(8):450-454
[5] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.慢性心力衰竭诊断治疗指南.中华心血管病杂志,2007,35(12):1076-1095
[6] 黄峻.心力衰竭诊治新进展.北京:中国协和医科大学出版社,2011:1-155
[7] 张健,陈兰英.心力衰竭.北京:人民卫生出版社,2011:200-227
[8] 葛均波.现代心脏病学.上海:复旦大学出版社,2011:229-253
[9] 英俊岐,胡大一.心力衰竭循证治疗手册.北京:化学工业出版社,2008:1-18
[10] 龙广宇,张树龙.慢性心力衰竭治疗的新理念:迷走神经刺激疗法.中国心脏起搏与心电生理杂志,2012,26(3):193-195
[11] Calvert MJ, Shankar A, McManus RJ,et al. Evaluation of the management of heart failure in primary care. Fam Pracr, 2009,26(2):145-153
[12] Goldberg RJ, Darling C, Joseph B,et al. Epidemiology of decompensated heart failure in a single community in the northeastern United States. Am J Cardiol,2009,104(3):377-382
[13] De Berrazueta FernandezJR. Chronic heart failure treatment in the year 2006. An R Acad Nac Med(madr), 2006,123(3):617-630
[14] Triposkiadis F, Karayannis G, Giamouzis G, et al.The sympathetic nervous system in heart failure physiology, pathysiology, and clinical implications. J Am Coll Cardiol, 2009,54(19):1747-1762
[15] Dickstein K, Cohen-Solal A, Filippatos G,et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC(HFA) and endorsed by the European Society of Intensive Care Medicine(ESICM). Eur J Heart Fail, 2008,10(10):933-989
[16] Lee CH, Hsieh MJ, Chu CM, et al. Prognostic significance of diastolic dysfunction by tissue Doppler imaging in patients with chronic heart failure. Am J Med Sci, 2009,337(6):415-420
[17] Go AS, Lee WY, Yang J, et al. Statin therapy and risks for death and hospitalization in chronic heart failure. JAMA, 2006,296:2105-2111
[18] Foody JM, Shah R, Galusha D, et al. Statins and mortality among elderly patients hospitalized with heart failure. Circulation, 2006,113:1086-1092
[19] Krum H, Latini R, Maggioni AP, et al. Statins and symptomatic chronic systolic heart failure: a post-hoc analysis of 5010 patients enrolled in Val-HeFT. Int J Cardiol, 2007,119:48-53
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















