PHAs发酵生产及前景
夏邦 富曾方
(深圳市奥贝尔科技有限公司 深圳)
摘要:聚羟基烷酸酯(PHAs)以其优良的生物降解性、生物相容性、压电性、光学活性、抗凝血性以及在生物合成过程中利用可再生农产品的特性等,在食品、医药、农业、电子、包装材料等领域具有独特而广泛的应用,现在的生产技术已经能够使PHAs生产成本控制在2.0美元/公斤,接近以石油为来源的塑料价格。简要综述PHAs发酵生产、分离提取以及国内外PHAs生产现状,并对前景进行展望。
关键词: PHAs ; P3HB4HB;发酵;提取
聚羟基烷酸酯(polyhydroxyalkanoates,简称PHAs)通常是微生物在不平衡生长条件下在细胞内积累的用于储存碳源和能量的颗粒状物质,是一种物理性质类似于聚乙烯、聚丙烯等化学合成塑料的热塑性聚酯,但它具有一般合成塑料所不具备的特性:生物降解性、生物相容性、压电性、光学活性、透氧性低、抗紫外辐射、抗凝血性以及在生物合成过程中可利用再生原料的特性等,在食品、医药、农业、电子、包装材料等领域具有独特而广泛的应用前景,被认为是一种“新型生物可降解材料”而备受重视。
英国帝国化学工业公司( ICI)[1,2]早在20世纪80年代就率先用发酵法培养真养产碱杆菌(Alcaligeneseut rophus)生产PHB,之后又有许多公司利用发酵法生产不同组分PHAs (PHBV、PHBHHx、PHO、P3HB4HB) ,至今发酵法仍是PHAs最主要的生产方法。
由于在基因工程菌株构造方面的进展,尤其是在代谢工程方面的成功,PHAs的发酵技术已经有了很大的发展。目前的技术已经使PHAs这类可完全生物降解材料在生产成本方面接近以石油为来源的塑料,在性能方面能够满足其性能多样性的要求,PHAs部分甚至大部分取代不可降解塑料即将成为现实[3~8]。
1 发酵生产PHAs
1.1 生产菌株的选育
能产生PHA的微生物分布极广,已知能积累PHAs的生物包括有革兰氏阳性菌、革兰氏阴性菌、好气菌、厌气菌、化能菌、固氮菌和光合细菌等。如今已发现的可以合成PHAs的细菌,分布在90多个属,有300多种,后来人们在真菌和动植物体内也发现了作为结构物质、而非贮藏物质的低聚合物P3HB。
选育能利用廉价原料、稳定生产PHAs的高产菌株可以通过传统菌株选育方法发现新的天然菌,或对现有菌株进行改造,提高合成PHAs的能力,或利用重组DNA技术构建基因工程菌,将PHA合成酶的关键基因植入能利用廉价底物的菌株中,并且保持高拷贝数质粒的稳定性。重组DNA技术可用来修改或引入新的代谢途径,合成新型聚合物,拓宽底物利用范围,提高产量降低成本。合适底物的选择可以通过两种途径解决:一是将底物合成基因转入PHA生产菌株中,二是将PHA合成酶基因转人可以利用廉价底物的非PHA生产菌株中[9]。第二种方法可能更有希望。目前引入真养产碱菌PHA合成酶基因的重组大肠杆菌是最成功的基因工程菌,重组大肠杆菌已经显示了良好的发展前景。
Liu Shuangjiang等[10,11]利用Clostridium acetobutylicum的丁酸激酶基因(buk)和磷酸转丁酰基酶基因(ptb),以及Thiocapsa pfennigii的PHA合成酶基因,设计了一条能够合成多种聚羟基烷酸的代谢途径,用构建的质粒转化大肠杆菌,获得了重组大肠杆菌菌株,该重组大肠杆菌能够合成包括聚羟基丁酸、聚(羟基丁酸-戊酸)等多种生物聚酯,通过生物催化作用合成了3-巯基丙酸的同型共聚酯,同时利用该重组大肠杆菌还获得了含3-巯基丙酸单体的多种异型共聚物。
总之,使用重组大肠杆菌具有许多优点: (1)高密度培养,生长快,发酵周期短; (2)能利用多种碳源-葡萄糖、乳糖、蔗糖、木糖、糖蜜等; (3)胞内无聚合物分解酶; (4)胞内聚合物累积量大,PHAs含量可达细胞干重80%以上; (5)条件可控,能够根据需要合成不同组分聚合物。
1.2 发酵方式研究
目前,微生物生产PHAs的发酵方式有连续培养和流加培养(补料分批培养)[12~14]。
连续培养可以使微生物细胞的生长速度、代谢活性处于恒定状态,达到稳定高速培养微生物或产生大量代谢产物的目的。连续培养生产PHAs由于其过程控制难度大,发酵周期长,PHAs产率低而较少使用。堵国成等[15]采用二级连续发酵系统对不同稀释率下PHB的生产进行了研究,但其PHB产率很低。
补料分批培养是介于分批培养与连续培养之间的一种培养方式,以分批培养为基础,吸取了连续培养的优点,既可消除高浓度底物对细胞生长的抑制作用,又可弥补低浓度底物限制细胞生长的缺陷,从而有效控制菌体的生长过程[16]。补料分批培养是目前微生物生产PHAs的主要培养方式。杨金水等[17]利用动胶菌,采用补料分批培养,流加控制发酵液糖浓度维持在2.5%,发酵结束后PHAs含量提高到85.4%。 Kim等[18]用在线葡萄糖分析仪控制浓度高密度培养生产PHAs,保持葡萄糖浓度10~20g/L,限磷条件下,获得了3.14g/L/h的较高生产率。
1.3 发酵工艺的优化
1.3.1 环境条件的控制
影响细胞的PHAs含量的环境参数主要有温度、pH、溶解氧等。温度对菌休生长、酶活性都有直接的影响。目前,微生物生产PHAs都是采取低温发酵生产,低温发酵所需能耗高,生产成本相对较高。筛选、培养高温工程菌种,采用高温发酵生产PHAs将是微生物生产PHAs的发展趋势。
pH影响细胞对营养成分的吸收及代谢途径,从而影响细胞生长及PHAs积累。发酵过程中,一般采用恒pH控制方式,控制在中性范围。Kim等[18]首次报道了使用重组大肠杆菌恒pH值补料分批发酵生产PHB。PHAs发酵过程中氧的供应是个关键因素,溶氧浓度是微生物生长和PHAs形成率的重要参数之一,而通气量和搅拌转速将直接影响溶解氧浓度。杨金水等[17]利用动胶菌生产PHAs的研究表明,罐的通气量、转速是影响最终发酵结果的主要因素。
1.3.2 葡萄糖的流加策略
PHAs的生成与发酵液中葡萄糖的消耗密切相关。微生物生产PHAs一般采用两步法,第一步是微生物生长阶段,第二步是PHAs合成阶段。
这两个不同阶段所需葡萄糖的量不同,在微生物生长阶段,加入一定量的葡萄糖,称之为初糖,研究发现,当初糖浓度很低时,PHAs发酵的各项指标都较低,随着初糖浓度的增加,细胞干重和PHAs浓度都有所提高,但过高的初糖浓度对细胞生长有抑制作用,使终产值下降[19]。在PHAs合成阶段,葡萄糖浓度的控制对PHAs合成至关重要,葡萄糖浓度太低,其转化率不高,降低PHAs合成产率,且发酵过程中产生大量泡沫,严重影响溶氧;葡萄糖浓度太高,将会产生底物抑制,对微生物产生毒害作用,严重阻碍PHAs合成。所以,在PHAs合成阶段,葡萄糖一般采取流加策略,根据其转化率,控制其流加量,使之既能高产率合成PHAs,又不累积产生底物抑制。
2 PHAs的提取及分离纯化
目前能够得到大量PHAs的方式还是依靠微生物发酵生产,而PHAs是胞内物,要获得必须从微生物细胞中分离出来。
提取PHAs的基本原理为:一是利用提取液中的化学物质对PHB和细胞物质不同的溶解性,将PHAs和其他细胞物质分离;二是破坏细胞膜的稳定性,让胞内物质容易释放出来。
PHAs的提取技术主要涉及两个问题,一是方法的合理性,主要表现在提取率、纯度、提取过程是否对PHAs的结构产生影响、从实验室到工业生产放大的可行性、操作是否方便,预处理及后处理是否复杂、环境污染程度等;二是过程的经济性,表现在提取所用材料的费用、能量消耗以及设备投资等[20,21]。
PHAs分离提取的方法主要分为有机溶剂法和水相提取法(非有机溶剂提取法) 。水相提取法包括次氯酸钠法、表面活性剂—次氯酸钠法、酶—表面活性剂法等[22]。
水相提取法(非有机溶剂提取法)的缺点是: (1)对分子结构尤其是分子量破坏较大;(2)提取的总成本高,废水处理麻烦; (3)最为严重的是非溶剂提取方法所得到的高分子纯度很难达到97%以上,总是有少量的无机盐或蛋白质等杂质,这些杂质在后期加工中对产品的性能影响相当大,尤其是对成膜制品,这些少量的杂质影响了膜的机械强度,而且在加工条件下加速分子量的降解。
有机溶剂提取法:传统的观点是该方法要用大量的有机溶剂,而且传统的观点更认为只有少量的含卤的有机溶剂如氯仿、二氯甲烷才能溶解PHAs,而这些溶剂由于对环境危害较大而认为不宜作为提取溶剂;同时现有的方法都将发酵后的菌体进行干燥,再加入有机溶剂,由于菌体干燥过程中易成团成块,机械粉碎虽然可以得到较细的颗粒,但与单个的菌体相比其表面积要小得多。这样,提取效率很慢,而且由于菌体的干燥而增加了总成本。
深圳市奥贝尔科技有限公司发明一种从湿菌体中提取高纯度聚羟基烷酸酯的方法,该发明方法简单,不需对细胞进行预处理,反应条件温和;操作步骤少,能耗大大降低,收率提高,且减少了生产设备投资,缩短了生产时间;效率高,提取搅拌时间非常短,分离效果好,选用普通低速离心机即可很好的分离;高分子纯度高,PHAs纯度达到99.0%以上;成本低,所需有机溶剂和非溶剂及极性非溶剂价格便宜,且可回收循环利用。
3 国内外PHAs生产情况
目前,生产降解塑料的主要国家有美国、意大利、德国、加拿大、日本、中国等。近年来,在发达国家中如美国、日本、德国、意大利等以完全生物降解塑料的开发研究最为活跃,而为了降低成本,完全生物降解塑料与天然材料如淀粉、纤维素等共混又成为热点中的热点。上述材料在一定环境条件下,可在较短时间内降解成二氧化碳和水。
目前P3HB4HB在欧美等地的产业化技术已日臻成熟,其产业化的成本都能控制在2.0美元/kg左右,其中BASF、P&G、BP、ADM等世界著名高分子及农产品公司已在研发及后期应用方面都做了大量的工作。美国Metabolix与ADM现已建成年产5万吨P3HB4HB的工厂,这是目前世界上第一条年产5万吨PHAs的生产线。
国内现有多家学术单位及企业承担国家“八五” 、“九五” 、“八六三”计划,研究可完全生物降解材料PHAs这类新型材料的任务,有的甚至尝试了产业化生产,但是由于在基因菌株的表达、发酵控制及后期提取等方面没有新的突破,其产业化成本仍然太高,目前还没有企业能以2.0美元/kg的成本来生产P3HB4HB。
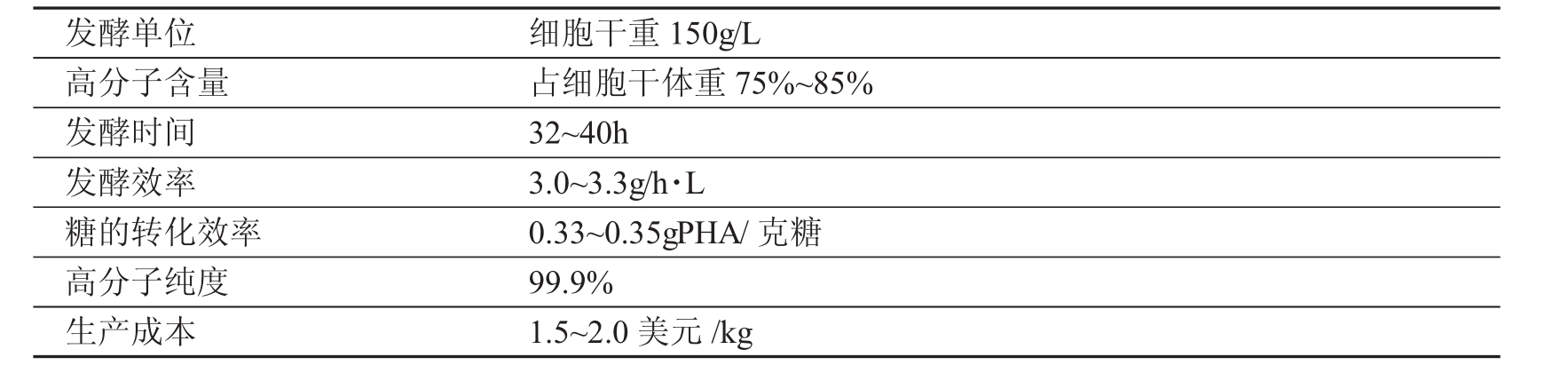
深圳市奥贝尔科技有限公司采用最新的酶提取法、最新的基因构造法,成功构建了适合产业化生产的稳定、高效的菌株;利用公司的专利提取技术,从湿菌体中提取高纯度聚羟基烷酸酯,整个生产成本控制在1.5~2.0美元/kg (奥贝尔发酵生产PHAs技术参数见表1) ,并将于2006年底建成年产5000吨PHAs的生产线。
表1 奥贝尔发酵生产PHAs技术参数
4 前景展望
目前,世界各国,特别是发达国家都非常注重环保,所以对完全降解材料的要求越来越高,需求量也越来越大。完全生物降解材料-聚羟基烷酸酯(PHAs)以其优良的生物降解性、生物相容性、压电性、光学活性、透氧性低、抗紫外辐射、抗凝血性以及在生物合成过程中利用可再生原料的特性等,在食品、医药、农业、电子、包装材料等领域具有独特而广泛的应用。
据专家统计,2005年全球塑料需求量已超过1.5亿吨,中国塑料需求量已接近3000万吨;预计到2010年,全球塑料需求量将达到2.5亿吨,中国塑料需求量也将超过4000万吨,达到4565.01万吨。到2010年,以PHAs需求量占总塑料需求量10%计算,全球PHAs需求量为2500万吨,中国PHAs需求量将超过400万吨。就中国市场而言,400万吨PHAs生产将需要建成10万吨级发酵工厂40个。PHAs生产线的顺利投产将有效带动相关工农业的快速发展,一个10万吨级的生产线每年需要30万吨淀粉,而30万吨淀粉则需要180万吨土豆(或42万吨玉米) 。
微生物发酵是一种相对较成熟的技术,利用微生物发酵生产PHAs具有光明的前景,随着可循环经济、绿色经济理念的不断深入,环保意识的不断加强,PHAs将成为塑料市场的生力军。
PHAs发酵生产技术已经成熟,万吨级生产线即将建成投产。但目前的任务还很艰巨:培养稳定且能利用更廉价原料的高产菌株;优化发酵工艺,提高细胞培养密度,缩短发酵周期,降低动力费用,充分发挥节能作用;革新PHAs分离提取工艺,提高聚合物纯度,将提取成本降到最低限度。
参考文献:
[1] Byrom D.TIBTECH,1987,5: 246
[2] Brandl H,Gross RA,Lenz RW er al.Advances in Biochemical Engineering,1990,41:77~91
[3]杨青,贺青.微生物发酵聚羟基烷酸的研究进展[ J ].工业微生物,1997,27(4): 44~47
[4]罗强,孙启玲.发酵法生产聚羟基脂肪酸酯(PHA)的研究进展.四川食品与发酵,2001
[5]黄海东.多聚羟基烷酸的发酵生产研究进展.山西化工,2002
[6]陈琦.微生物合成生物降解塑料研究现状与展望.微生物学通报,1994,21 (5)
[7]黄海东.可降解塑料-多聚羟基丁酸的高密度发酵研究.山西化工,2002
[8]杨幼慧.球衣菌合成聚羟基烷酸(PHA)的发酵研究.微生物学通报,2001
[9] Lee SY.Plastic bacteria Progress and prospects for polyhydroxyalkanoatc production in bacteria.Tibtech November,1996,(14) :431~438
[10] Liu Shuangjiang,Tina Lütke -Eversloh,Alexander Steinbüchel. Biosynthesis of Poly ( 3 -mercaptopropionate)and Poly ( 3-mercaptopropionate-co-3-hydroxybutyrate)with Recombinant Escherichia coli. Chinese Journal of Biotechnology,2003,19 (2)
[11] Liu and Steinbüchel. Appl Environ Microbiol,66 :739~743
[12]伍朝晖,杨幼慧,钟士清.生物可降解塑料的发酵生产研究进展[ J ].微生物学通报,2000,27 (30):
220 ~223
[13]陈坚,堵国成,李寅,等.细菌合成生物可降解塑料聚羟基烷酸(PHAs)的研究现状和未来.中国科学基金,1999
[14] Kim BS,Lee SY,Chang HN.Biorechnol Lett,1992,14:811~816
[15]堵国成,陈坚,陈银广,等.生物工程学报,1998,14 (2) :187~192
[16] Wang FL,Lee SY.Appl Environ Microbiol,1997,63:4765~4769
[17]杨金水,黄建新,倪晋仁.动胶菌发酵生产可降解塑料PHAs.化工进展,2005,24 (9)
[18] Kim BS,Lee SC,Lee SY et al.BiowchnolBioeng,1994,43:892~898
[19]杨金水,黄建新,倪晋仁.细菌发酵生产聚羟基烷酸的摇瓶条件优化.农业环境科学学报,2005,24(增刊):240~244
[20]李爱萍,李光吉.聚羟基脂肪酸酯生物合成的研究进展.高分子通报,2004
[21] Choi J,Lee SY.Bioproc Eng,1997,17: 335~342
[22]金大勇,顾国维,杨海真.生物降解塑料聚羟基烷酸( PHA)的研究进展[ J ].氨基酸和生物资源,2004,26(3) :30~32
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















