产L-亮氨酸营养缺陷型突变株黄色短杆菌SFL8-3的选育
刘建军 赵祥颖 李丕武 田延军 张家祥
(山东省食品发酵工程重点实验室 济南 250013)
摘要:氨基酸是构成蛋白质的基本单位,是生物体内不可缺少的营养成分,L-亮氨酸是人体八种必需氨基酸之一,也是三种支链氨基酸之一,在医药、食品、饲料、化妆品等行业具有重要的用途。以一株黄色短杆菌为出发菌株,经紫外线、盐酸羟胺和硫酸二乙酯等多次诱变处理,单菌落分离、摇瓶初筛和摇瓶复筛,获得了一株蛋氨酸和异亮氨酸双重缺陷型突变株SFL8-3 (Met-,Ile-) ,摇瓶发酵L-亮氨酸产量达18.98g/L。
关键词:黄色短杆菌,L-亮氨酸,营养缺陷型,发酵
氨基酸是构成蛋白质的基本单位,在生物体内具有特殊的生理功能,参与细胞中多种化合物的合成代谢,是生物体内不可缺少的营养成分。L-亮氨酸是8种必需氨基酸之一,从营养学的角度来讲,完全蛋白中L-亮氨酸所占份额最高,L-亮氨酸在医药、食品、饲料、化妆品等行业具有重要的用途[1]。目前国内外L-亮氨酸生产方法以蛋白水解提取法为主[2,3],由于天然蛋白质原料氨基酸组成复杂,提取工艺复杂,污染严重,收率较低,极大的刺激了生物发酵法生产L-亮氨酸工艺技术的研究热情[4~7]。目前发酵法生产L-亮氨酸存在的主要问题是菌种产酸偏低,生产周期长,发酵副产物多,分离纯化困难,收率低等。因此选育优良的L-亮氨酸生产菌仍然是L-亮氨酸发酵的研究重点。
笔者等人以一株黄色短杆菌SFL-8为出发菌株,经紫外线、盐酸羟胺和硫酸二乙酯等多次诱变处理,单菌落分离、摇瓶初筛和摇瓶复筛,获得了一株蛋氨酸和异亮氨酸双重缺陷型突变株SFL8-3(Met-,Ile-) ,L-亮氨酸产量达18.98g/L,本文报道了产L-亮氨酸黄色短杆菌蛋氨酸和异亮氨酸双重缺陷型突变株SFL8-3 (Met-,Ile-)的筛选过程和结果。
1 材料和方法
1.1 出发菌种
黄色短杆菌(Brevibacterium flavum SFL-8) ,实验室保藏菌株。
1.2 培养基
斜面平板培养基(g/L) :葡萄糖30,蛋白胨10,酵母膏10,玉米浆30,豆饼水解液10,氯化钠2.5,尿素2,硫胺素30μg,琼脂13,pH7.0。
基本培养基(g/L) :葡萄糖20,磷酸二氢钾1,硫酸镁0.4,柠檬酸钠1,硫酸铁20ppM,硫酸锰20 ppm,生物素2μg,磷酸氢二铵2,硫胺素30μg,蛋氨酸0.5 ,琼脂1.3,蒸馏水配制,pH 7.0。
无氮基本培养基(g/L) :葡萄糖20,磷酸二氢钾0.3,柠檬酸钠0.5,硫酸锰0.01,磷酸氢二钾0.2 ,生物素20ug,硫胺素20ug,pH 7.0。
二氮基本培养基(g/L) :葡萄糖20,磷酸氢二钾0.3,柠檬酸钠0.5 ,硫酸锰0.01,磷酸氢二钾0.2 ,硫酸铵2,蛋氨酸0.2,生物素20ug,硫胺素20ug,pH 7.0。
液体种子培养基(g/L) :葡萄糖30,硫酸铵5,磷酸二氢钾0.5,硫酸镁0.4,玉米浆20,豆饼水解液3,pH7.0。
发酵培养基(g/L) :葡萄糖100,硫酸铵25,磷酸二氢钾0.5,硫酸镁0.4玉米浆20,豆饼水解液10,碳酸钙20,pH7.0。
1.3 菌种诱变
1.3.1 紫外线诱变
将活化过的菌体接入种子培养基中,振荡培养至指数生长期,离心收集菌体,用生理盐水洗涤两到三次,将菌液浓度稀释至106~108个/ml。将10ml细胞悬浮液置于灭过菌的并带有磁力搅拌棒的90mm的培养皿中,照射一定时间后,取1ml处理液稀释涂布平板或进行中间培养,并注意避光。
1.3.2 盐酸羟胺诱变
用5ml无菌水洗下新鲜活化的斜面菌体,取1ml菌液接入装有20ml种子培养基的250ml三角瓶中,置于旋转式摇床上,30℃,150转/分振荡培养至指数生长期后,加入盐酸羟胺,继续培养4~6小时。
1.3.3 紫外线与盐酸羟氨复合诱变
菌种经盐酸羟胺诱变后离心收集菌体,制备细胞悬液,然后进行紫外线诱变处理。
1.3.4 硫酸二乙酯(DES)诱变
将菌体接入种子培养基中,振荡培养至对数生长期,离心收集菌体,用磷酸缓冲液洗涤2~3次,将细胞均匀悬浮于pH7.0磷酸缓冲液中,制成细胞浓度为106~108个/ml的菌悬液。取4ml菌悬液,加入到16mlpH7.0磷酸缓冲液中,加0.2ml DES,使其最终浓度为1%,30℃下振荡处理一定时间。然后每1ml处理液中加入0.5ml 25%硫代硫酸钠中止反应。取1ml处理液进行中间培养或直接稀释涂平板。
1.3.5 氯化锂诱变
将氯化锂加入冷却至55~60℃的固体培养基中,制成含不同浓度氯化锂平板,将稀释好的细胞悬液涂于平板,不含氯化锂的平板做对照,选择合适的氯化锂浓度进行诱变。
1.3.6 硫酸二己酯与氯化锂复合诱变
菌种经硫酸二乙酯诱变后涂布含有氯化锂的平板。
1.4 营养缺陷型菌株的检出
1.4.1 中间培养
为了克服表型延迟,将诱变后的菌液接入到完全液体培养基中进行中间培养2~4小时进行平板分离。
1.4.2 浓缩缺陷型
为了提高获得缺陷型菌株的几率,采用抗生素法淘汰野生型“浓缩”营养缺陷型菌株。将菌液离心,收集菌体,用生理盐水洗涤离心两次,将菌体置于无氮基本培养基中培养6~12h,使游离的有机含氮化合物耗尽。再将培养液全部移入等量的含有两倍氮源的基本培养基中培养2~3h,加入一定量的抗生素继续培养5~6小时,达到杀死“野生型” ,浓缩缺陷型目的。
1.4.3 营养缺陷型菌株的检出
选择逐个检出法进行营养缺陷型菌株的检出。将诱变后的菌液涂布于完全培养基上,长出菌落后,用牙签按一定顺序逐个将菌落点接到完全培养基和基本培养基上,培养一定时间后,在完全培养基上生长,而在基本培养基上不长的菌株可能就是营养缺陷型。
1.4.4 氨基酸缺陷型的鉴定
将生长在完全培养基斜面上的营养缺陷型细胞,用无菌水洗下,离心收集菌体,充分洗涤后,制成细胞浓度为106个/ml的菌悬液。取1ml菌悬液置于培养皿中,倾入15ml融化并冷却的基本培养基,充分混匀凝固后即为待测平板,在平板上贴上蘸有酪素水解物或氨基酸混合液的滤纸。经培养后,若发现滤纸周围有菌体生长,则说明该菌株为氨基酸缺陷型。
1.4.4.1 单一氨基酸营养缺陷型的鉴定
生长谱线法
1.4.4.2 多种氨基酸缺陷型的鉴定
当需要确定一种以上氨基酸缺陷型时,配制分别缺少一种氨基酸的混合液,然后将氨基酸缺陷型的菌株制成待测平板,分区域分别贴上蘸有氨基酸混合液的滤纸片,培养后观察菌体生长情况,若在缺少A的区域和缺少B的区域都不生长,而在其他区域生长的菌株则为A和B的缺陷型。
1.5 高产L-亮氨酸突变株的筛选
初筛:挑取菌株移接斜面培养基,30℃培养20~24h,从斜面上刮取一环菌体接入发酵培养基,30℃,发酵培养3~4天,纸层析法测定发酵液中L-亮氨酸含量,选出L-亮氨酸产量高、杂酸少的菌株进行传代复筛。
复筛:挑取初筛产酸高的菌株再进行摇瓶复筛。每支菌株接种三个摇瓶,发酵3~4天后,测定发酵液中L-亮氨酸含量,选出L-亮氨酸含量高、杂酸少的菌株。筛选出的优良菌株要及时进行分离纯化,保证获得遗传稳定的突变菌株。
1.6 分析方法
1.6.1 菌体浓度的测定
取培养液用蒸馏水适当稀释620nm测定其吸光度,用以表示菌体生长量。发酵液用0.1mol/L的盐酸稀释,充分摇匀待碳酸钙全部溶解后测定。
1.6.2 还原糖测定[8]
斐林试剂定糖法。
1.6.3 L-亮氨酸的定性检测
纸层析法
展层剂:正丁醇∶冰醋酸∶水=4∶1∶2;
显色剂: 0.5%无水丙酮茚三酮溶液。
点样:每次点样量为10uL,点样斑点直径控制在4mm。
展开:将点好样的滤纸放入层析缸内,平衡1h后,滤纸放入展层剂中上行展开。展开剂上行至距滤纸顶端2cm时取出,置于通风橱内风干。
显色:风干后的层析纸用0.5%茚三酮无水丙酮溶液均匀润湿,吹去丙酮后置于65℃显色30min。
1.6.4 L-亮氨酸定量分析
1.6.4.1 纸层析定量方法
展层剂:同“1.6.3” 。
显色剂:同“1.6.3” 。
洗脱剂: 0.1%硫酸铜(CuSO4· 5HO2)∶75%乙醇=2∶38
标准曲线的绘制:配制标准亮氨酸溶液,按梯度浓度10μl点样,在层析缸中平衡1小时,展开。显色后,将色层图谱上紫红色的L-亮氨酸斑点依次剪下。面积大小相仿,在同一张纸上再剪下一块空白纸,作为对照。把剪下来的滤纸片分别置于试管中,然后每个试管中加入4ml硫酸铜乙醇溶液,浸润洗脱30min,洗脱液在520nm测定吸光度。根据吸光值绘制L-亮氨酸标准曲线。
样品的测定:发酵液离心去菌体,清液适当稀释,在上述条件下进行纸层析,洗脱液在520nm测吸光度,用标准曲线回归方程计算样品中L-亮氨酸的含量。
1.6.4.2 氨基酸分析仪分析
仪器:日立835型高速氨基酸自动分析仪
样品处理:取发酵液样品1.0ml,加入5%磺基水杨酸4.0ml,充分混匀后在-18℃放置10分钟,35000g4℃离心30分钟,上清液经微孔滤膜过滤后上机分析。
2 结果与分析
2.1 出发菌株的生长曲线
取新鲜活化斜面菌种一环,接入装有20ml种子培养基的250ml三角瓶中,30℃、150r/min振荡培养,每隔2小时取样,适当稀释后,在620nm处测量吸光度(A620nm) 。以时间为横坐标,吸光度为纵坐标,绘制菌体生长曲线如图1。

图1 黄色短杆菌SFL-8生长曲线
由图可知,该菌株对数生长期为4~16小时。指数期细胞有时代短、细胞生长平衡、酶系活跃、代谢旺盛等特点,因此选择指数生长期细胞进行诱变和接种。选择10~12小时的菌体细胞进行诱变。
2.2 紫外线诱变
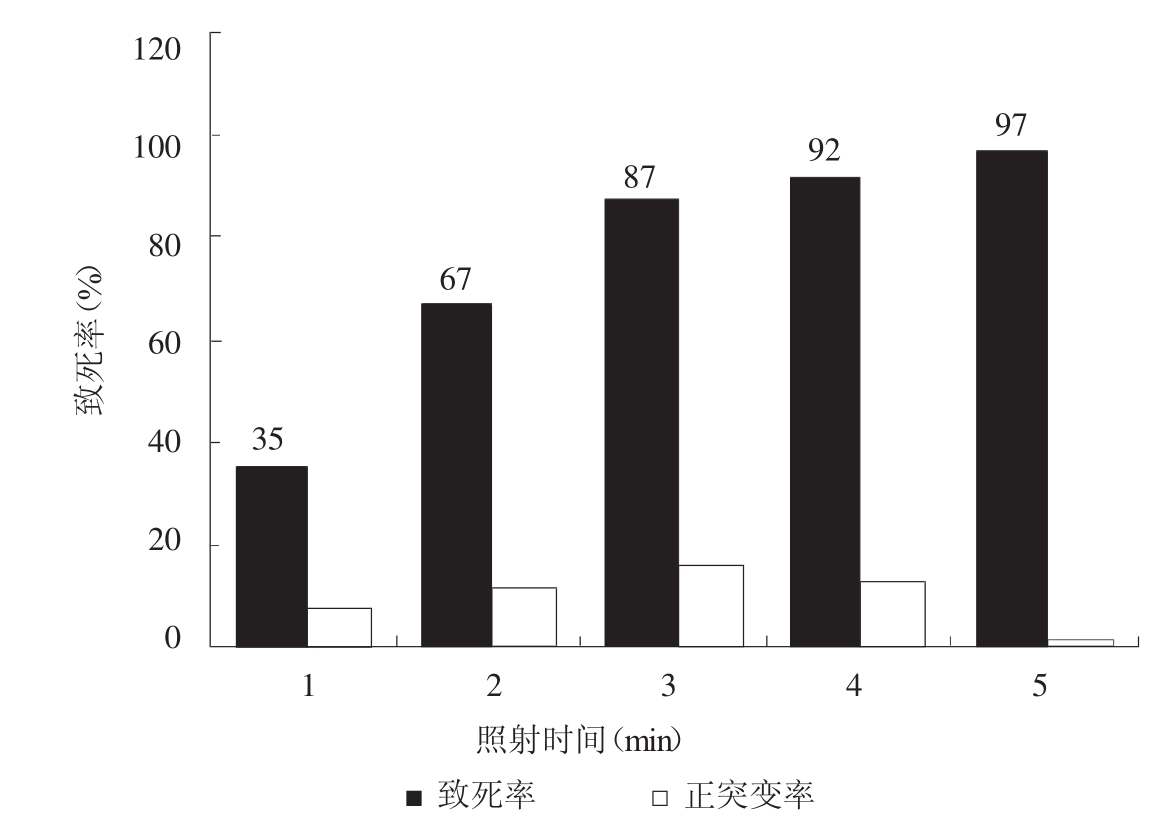
图2 紫外线处理效果
紫外线的处理时间和菌种致死率之间的关系如图2。可以看出致死率约为80%~90%正向突变的几率比较高。选择致死率约在70%~90%多个处理剂量对菌株进行多次紫外线单独诱变或与其他诱变因素联合处理,经紫外线多次诱变后,对产L-亮氨酸高于10 g/L的菌种进行了复筛,结果见表1-1。
表中结果可以看出突变株UV1-11产L-亮氨酸达到12.85 g/L,纸层析结果较好,选做下一论诱变的处理对象。
表1 黄色短杆菌SFL-8紫外线诱变结果

2.3 紫外线与盐酸羟氨复合诱变
2.3.1 盐酸羟氨菌株生长的影响
液体种子培养10小时左右,再在培养基中添加不同浓度的盐酸羟胺,菌株生长结果见表2。
实验表明:培养基中盐酸羟胺浓度大于0.2g/L时,对菌体的生长有较强的抑制作用。选择0.3g/L的盐酸羟胺对菌种进行诱变处理。
表2 盐酸羟氨对菌株生长的影响

2.3.2 紫外线与盐酸羟氨复合诱变结果
采用盐酸羟胺和紫外线共同作用的方法处理菌株,经初筛共挑取100多支产酸增加的菌株,21菌株进行了复筛,结果见表1-3。
经多次复筛和分离纯化获得遗传性状稳定的高产菌株进行保存。其中菌株UH2-12产酸达到15.86 g/L,纸层析效果较好,选取做进一步研究的对象。
2.4 硫酸二己酯与氯化锂复合诱变
表3 紫外线与盐酸羟氨复合诱变部分结果

2.4.1 硫酸二己酯(DES)诱变
实验采用1%的DES对菌株进行诱变处理,诱变时间与致死率的关系如图3。
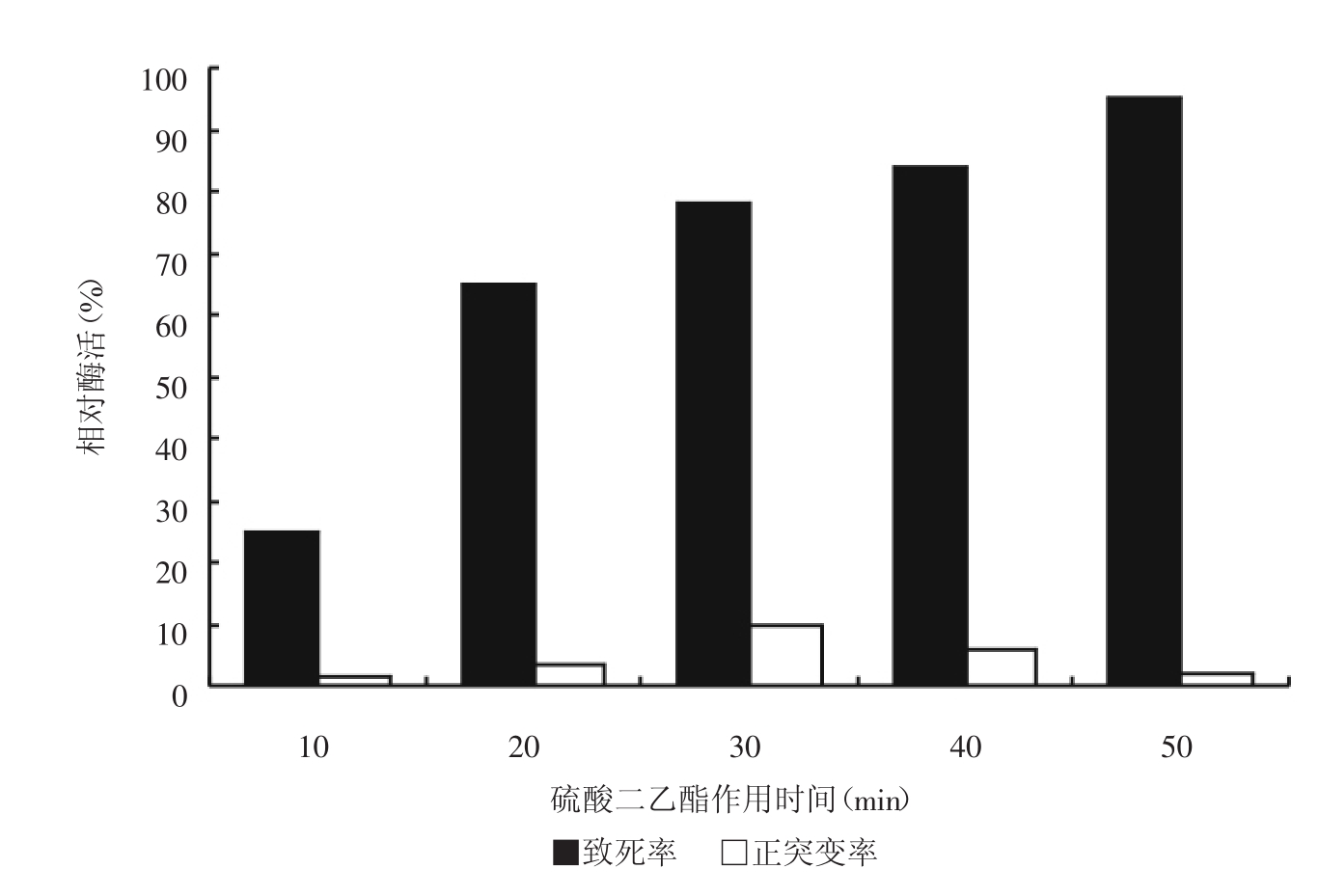
图3 DES作用时间对致死率和正突变率的影响
结果表明选择处理30分钟诱变结果比较好。实验中选用多个处理时间和多次诱变以增加突变株的筛选几率。
2.4.2 氯化锂对菌株生长的影响
氯化锂对菌株生长的影响见表1-4。
表1-4 氯化锂浓度对菌株生长的影响

氯化锂浓度控制在3~4g/L较为理想。
2.4.3 硫酸二己酯与氯化锂复合诱变结果
硫酸二己酯和氯化锂复合诱变处理结果见表1-5。
表1-5 DES与氯化锂复合处理结果

其中菌株DL3-14发酵液中积累L-亮氨酸超过18g/L,经进一步分离纯化后用于下一步研究。
2.5 异亮氨酸和蛋氨酸双重缺陷菌株的选育
L-亮氨酸合成的前体物是丙酮酸,因此减少丙酮酸的代谢支路能够促进L-亮氨酸合成,丙酮酸的代谢支路主要是用于天冬氨酸系氨基酸合成。天冬氨酸系氨基酸包括天冬氨酸、赖氨酸、蛋氨酸、苏氨酸和异亮氨酸等,如果这几种氨基酸缺陷则有利于亮氨酸的积累,实验中有目的的选育了蛋氨酸缺陷和异亮氨酸缺陷株。异亮氨酸缺陷不仅可以切断异亮氨酸的合成代谢流节约丙酮酸,同时异亮氨酸缺陷可以解除三种支链氨基酸对关键酶乙酰羟基酸合成酶的协同反馈抑制和阻遏。
菌株经复合诱变后采用逐个测定法检出氨基酸缺陷型。将浓缩过的缺陷型菌株先涂布完全培养基平板上,将长出菌落逐个对映点种在完全培养基和基本培养基添加蛋氨酸和基本培养基添加蛋氨酸和异亮氨酸的平板上,培养后逐一挑出在基本培养基添加蛋氨酸平板上未有生长,在基本培养基添加蛋氨酸和异亮氨酸平板上生长的菌落。
实验共检出168株在添加异亮氨酸和蛋氨酸平板上生长的菌落,经进一步验证共有26株异亮氨酸和蛋氨酸双重缺陷菌株。摇瓶初筛和复筛结果见表1-6。
表1-6 异亮氨酸和蛋氨酸双重缺陷菌株筛结果

菌株SFL8-3发酵液中积累L-亮氨酸最高达18.98g/L。经进一步验证证明其为异亮氨酸和蛋氨酸双重缺陷。发酵液纸层析显示该菌株除L-亮氨酸外还有积累微量缬氨酸和少量丙氨酸。丙氨酸是丙酮酸转氨形成的,转氨酶作用是可逆的,丙酮酸和丙氨酸可以根据需要相互转换。分析菌株积累丙氨酸的原因,可能是丙酮酸继续代谢不畅,丙酮酸过剩进而转氨生成丙氨酸,希望通过发酵条件的优化可以减少丙氨酸的合成进一步提高L-亮氨酸的产量。
3 结论与展望
3.1 以一株黄色短杆菌SFL-8为出发菌株,经紫外线、盐酸羟胺和硫酸二乙酯等多次复合诱变处理,单菌落分离、摇瓶初筛和摇瓶复筛,获得了一株蛋氨酸和异亮氨酸双重缺陷型突变株SFL8-3 (Met-,Ile-) ,L-亮氨酸产量达18.98g/L,发酵液纸层析分析结果表明该菌株除产生L-亮氨酸外还积累微量的缬氨酸和少量丙氨酸。
3.2 选育异亮氨酸营养缺陷型菌株,仅仅解除了异亮氨酸对L-亮氨酸合成途径中第一个关键酶乙酰乳酸合成酶的部分反馈抑制和阻遏,但酶分子的结构和酶的合成调节没有改变,仍然受L-亮氨酸的反馈调节。L-亮氨酸的合成途径中第二个关键酶α-异丙基苹果酸合成酶,同样受到L-亮氨酸的反馈抑制和阻遏。如果解除L-亮氨酸对这两种关键酶反馈调节,菌体才有可能大量积累L-亮氨酸。筛选解除终产物的反馈调节最有效的方法就是选育抗结构类似物突变株。选育L-亮氨酸发酵抗结构类似物突变株是进一步提高菌株L-亮氨酸产率的有效方法。
3.3 在分子水平上研究与L-亮氨酸代谢有关的酶的调节机制,用于指导基因工程手段构建L-亮氨酸发酵新菌株等工作有待进一步研究。
参考文献:
[1]邵继智.支链氨基酸的生化与营养[J].氨基酸杂志,1990,2: 23
[2]吴波,等.玉米黄浆制取亮氨酸的研究[J].武汉食品工业学院学报,1996,3: 18~21
[3]刘勋.从人发中连续提取亮氨酸和胱氨酸工艺初探[J].氨基酸和生物资源,2000,22 (2) ,30~33
[4]张素珍,等.产L-白氨酸突变株的选育及发酵条件的研究[J].微生物学报,1979,19 (2):180~186
[5]Kisumi M,L-Valine and L-Leucine production by analogresistant mutants derived from Serratia macesscens .[J]. J Bacteriol,1971,107: 824
[6] Tsuchida T,Yoshinaga F Kubota K et al . Culture conditions for L-lercine production by strain No.218,a mutant of Brevibacteriumlactoferentum2256 [J].Agric Boil Chem,1975,39:1149
[7] Takayasu Tsuchida,Haruo Momose,Improvement of an L-leucine-producing mutant of Brevibacterium lactofermentum 2256 by genetically desensitizing it toα-acetohydroxy acid synthetase.[J] Appl Environ Microbiol,1986,51 (5) :1024
[8]朱懿德,梁国庆,包守懿.发酵工业分析[M].北京:中国轻工业出版社,1991.38~41
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















