ε-聚赖氨酸高产菌的筛选
曹伟锋 赵 颖 袁国栋 谭之磊 贾士儒(1)
(天津市工业微生物重点实验室天津科技大学生物工程学院 天津 300222)
摘要:依据传统诱变理论和白色链霉菌生物合成ε-聚赖氨酸的特点,确立了以面包酵母菌为敏感菌,抑菌圈为基准的筛选方法。在优化诱变条件的基础上,以白色链霉菌UV38为出发菌株,经紫外线与硫酸二乙酯复合诱、N+离子注入诱变选育出一株遗传性状稳定酸菌株DUL10,比出发菌株抑菌性能提高33.5%。
关键词: ε-聚赖氨酸;白色链霉菌;诱变育种
有机食品是世界食品工业发展的趋势,食品防腐剂的天然化成为这一趋势的必然要求。目前ε-聚赖氨酸是最具优良性能和巨大商业价值的生物防腐剂之一[1]。它是含有25~30个赖氨酸残基的阳离子聚合多肽,当聚合度低于10肽,会丧失抑菌活性[2]。 ε-聚赖氨酸抑菌谱广,在酸性和微酸性环境中对革兰氏阳性菌、革兰氏阴性菌、酵母菌、霉菌均有抑制作用,而且对耐热性芽孢杆菌和一些病毒也有抑制作用[3]。同时,其热稳定性高,水溶性好,食用安全,因此,广泛用于食品保鲜[4]。此外,在基因治疗[5]、微囊药物的制备[6]、高分子材料等领域中,ε-聚赖氨酸亦有着广泛的用途。文中以筛选获得的白色链霉菌UV38为出发菌株,通过紫外线与硫酸二乙酯复合诱变,N+离子注入诱变处理,对ε-聚赖氨酸高产菌株进行了筛选。
1 材料和方法
1.1 出发菌株
白色链霉菌(Streptomyces albulus) UV38天津科技大学生化工程研究室保藏。
(页下注)通讯作者:贾士儒Tel: 022-60601606 E: mail: jiashiru@tust.edu.cn
1.2 培养基
1.2.1 贝纳特斜面培养基(%)[7]
1.2.2 YEPD培养基(%)[10]
1.3 试剂
1.4 诱变育种
1.4.1 硫酸二乙酯(DES)诱变[10]
1.4.2 紫外线(UV)诱变[10]
1.4.3 DES+ UV复合诱变[10]
1.4.4 N+离子注入诱变[12]
1.4.4.1 N+离子注入前样品的处理[13]
1.4.4.2 离子注入
采用N+离子,能量30KeV,剂量1.0×1014,5.0×1014,8.0×1014,1.0×1015,3.0×1015,5.0×1015,8.0×1015,1.0×1016N+/cm2。
1.4.4.3 离子注入处理
离子注入机是由郑州大学提供,在注入机上,用不同的剂量对白色链霉菌的孢子进行注入;注入靶室的真空密度为5×10-2Pa。
1.5 筛选方法
1.5.1 初筛方法
采用管碟法测定100μl发酵液的抑菌圈直径[7]。
1.5.2 复筛方法将初筛得到的菌株转接于摇瓶发酵培养适当时间,采用管碟法测定100μl发酵液的抑菌圈直径。
1.5.3 筛选标准的建立规定对离子注入后的菌株进行筛选时,突变株抑菌圈直径大于对照5%的突变株称为正突变,而小于5%的菌株称为负突变,在±5%之间作为未突变。
1.6 分析方法
见参考文献14。
2 结果与讨论
2.1 敏感菌的确定
根据白色链霉菌代谢产物ε-聚赖氨酸的抑菌特性,采用管碟法,测定100μl发酵液的抑菌性能,选用酵母菌、大肠杆菌、金黄色葡萄球菌、青霉、枯草芽孢杆菌、米根霉做敏感性对比试验,结果表明(见表1) ,金黄色葡萄球菌为敏感菌时其抑菌圈最大为28.2mm,但其为致病菌,而酵母菌为非致病性菌,且在食品业广泛应用,以其为供试菌株时所形成的抑菌圈也较为清晰可辨,如图1,所以实验中选择酵母菌为敏感菌。
表1 敏感菌的确定
![]()
2.2 白色链霉菌诱变筛选
2.2.1 紫外线(UV)诱变处理
通过UV照射30 S、60 S、90 S、120 S的孢子悬浮液,孢子存活率分别为63.6%、7.5%、3.7%和0.0% (见图2) ,根据遗传育种的经验,正向突变较多地出现在偏低剂量中,因此依照白色链霉菌存活率曲线图,确定45 S为最适剂量。
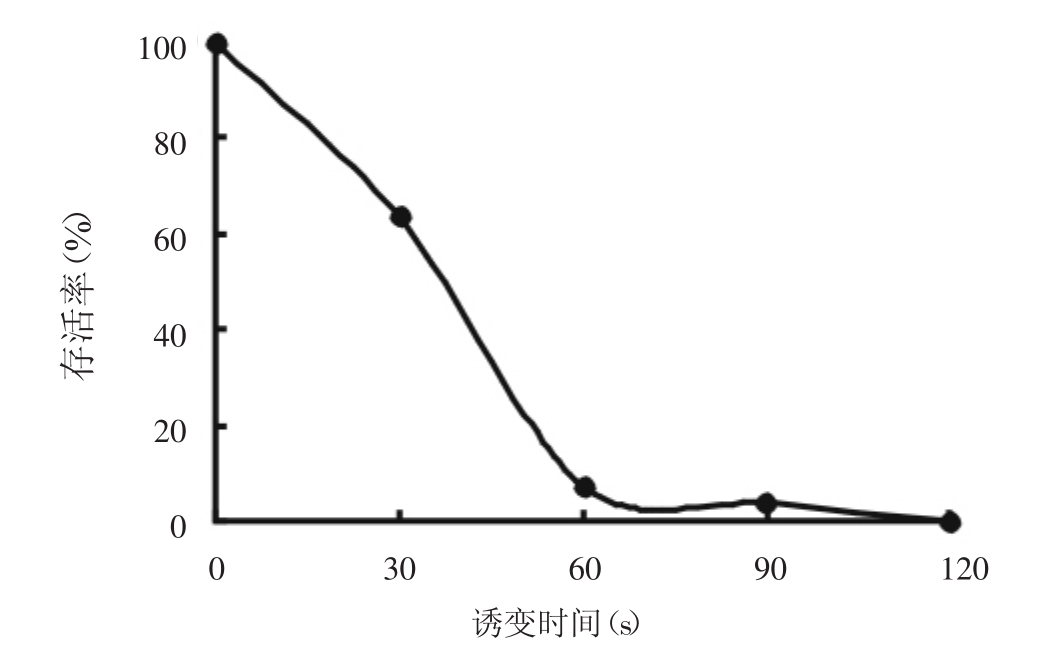
图2 Streptomyces albulus紫外线诱变存活率
2.2.2 硫酸二乙酯处理时间和用量确定
图3和图4表明,以UV38为出发菌株,当用诱变处理时间为25min,细胞的存活率为4.08%;突变率最大为60.98%。当DES体积浓度为1.0%时,菌体存活率为17.6%,突变率为45.27%。说明存活率较低时,正向突变率较大。同时也可以看出,随着诱变剂量的增加,突变率反而下降。上述现象说明DES对白色¥链霉菌的诱变有最适剂量。因此确定DES的最适剂量为:诱变时间25min,DES浓度为1.0% (体积) 。
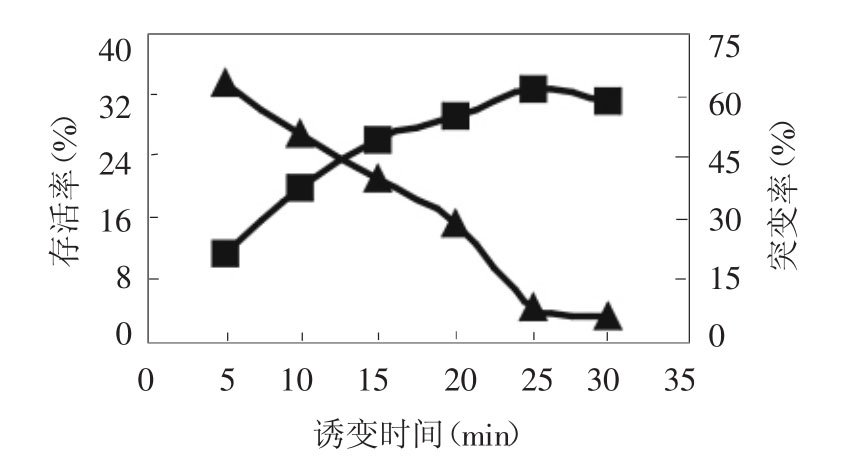
图3 DES最佳诱变时间的确定
Fig3 The determination of optimum
treating period with DES
 存活率
存活率  突变率
突变率
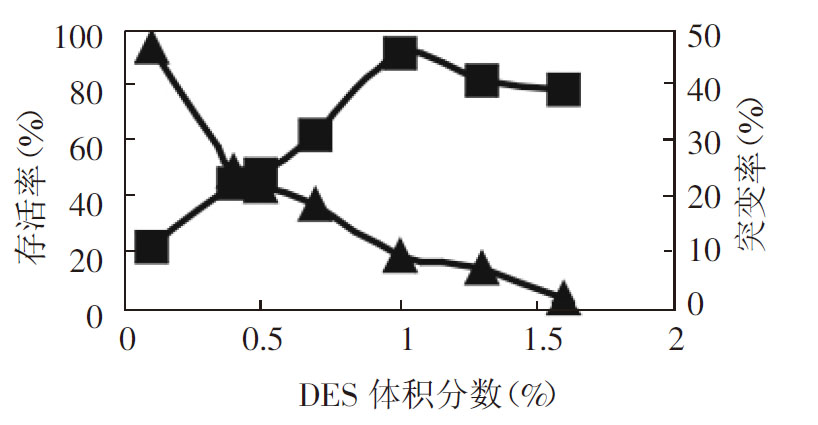
图4 DES诱变最佳浓度的确定
Fig4 The determination of optimum
treating concentration with DES
 存活率
存活率  突变率
突变率
2.2.3 复合诱变方法的确立
2.2.1和2.2.2单从硫酸二乙酯和紫外线单独作用的角度得出的结论,但其二者复合作用将对细胞致死率和突变率造成一定的影响,另外还存在着硫酸二乙酯和紫外线处理次序的问题,因此主要运用DES+UV复合诱变的方法筛选高产菌株。出发菌株UV38遗传性状稳定,DES通过烷化基团使DNA分子上的碱基及磷酸部分被烷化,碱基中容易发生烷化作用的是嘌呤类。[8]但烷化剂不能和胸腺嘧啶反应,腺嘌呤的烷化作用也较少发生(仅占烷化反应的5%~10%)[9]。
紫外线(UV)的诱变频率高,而且不易回复突变[8],主要导致形成嘧啶二聚体[9],因此选择的复合诱变方案为先DES后UV处理。
吸取单孢子悬液4 ml,加入16ml pH7.0磷酸缓冲液,混匀后加入0.2 ml DES (1%) ,30℃恒温振荡一定时间,加入10ml 25% Na2S2O3终止反应。然后吸取DES诱变后的悬液10 ml于φ9 cm无菌平皿中,打开皿盖,在磁力搅拌状态下用紫外灯(波长253.6nm,功率15w,照射距离30cm)照射一定时间。组合为: a、紫外45s + DES 15min; b、紫外20s + DES 25min; c、紫外20s + DES 25min。
2.2.4 注入离子的选择
目前,用于微生物离子注入诱变的离子主要为H+,Ar+,N+,三者在其他条件不变的情况下,在致死率关系上还存在着一些争议,但普遍认为N+的诱变效率最高,因为N+为组成DNA碱基的重要元素之一,N+注入不仅可以直接引起前碱基分子结构的变化,还可以参与细胞的重组和修复,产生的诱变突变较多,因此常用于微生物和植物诱变育种[11],所以这里选择N+对DES+UV诱变所得菌株进行处理。
2.2.5 诱变筛选结果
2.3.5.1 DES+UV复合诱变的结果
经初筛与复筛后获得5株菌的抑菌圈直径比UV38大的比较明显,如表2所示。其中DU82遗传性状稳定,菌株的电镜图如图5所示,菌丝比较粗壮,孢子椭圆形。DU82与UV38的抑菌圈见图6。
表2 DES+UV复合诱变突变株的筛选结果
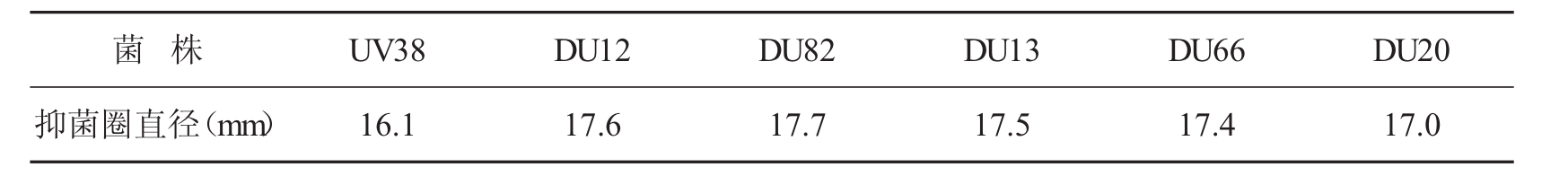

图5 DU82的电镜照片

图6 DU82 (右)与UV38 (左)的抑菌圈图片
由表2可看出DES+UV诱变后正向突变菌株的抑菌圈直径最大为17.7mm。为进一步提高菌株的产量,选择DU82为N+离子注入诱变的出发菌株。
2.3.5.2 N+离子注入诱变结果
2.3.5.2.1 用30keV能量不同剂量注入白色链霉菌孢子对它存活率和突变率进行了考察。存活率曲线见图7。
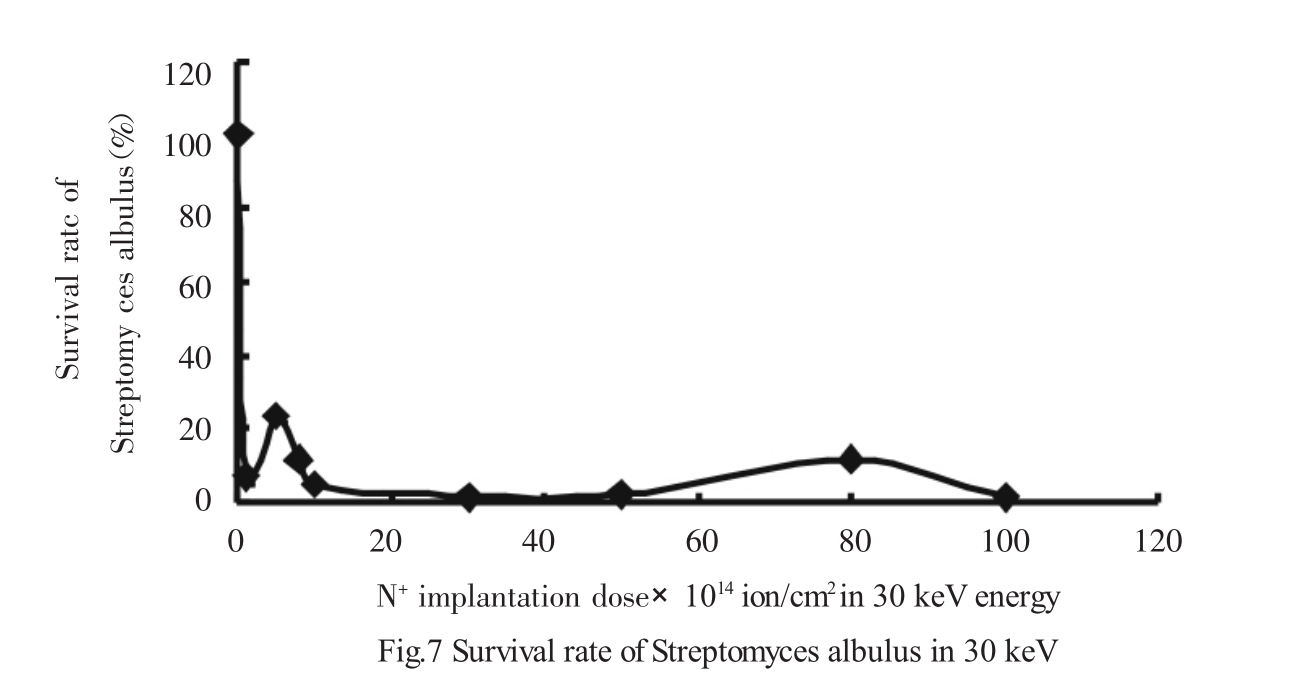
图7 在30keV能量下不同剂量下的存活率
由图7可以看出白色链霉菌在30keV能量下的存活率在陡降后又有一回升,之后形成两个峰。陡降的原因可能为无菌平皿放入注入靶室并密封后,立即抽真空,进行离子注入时间仅10秒左右,之后又将靶室升压与大气压相等取出平皿,此过程经历压力变化较为剧烈,应为细胞致死的主要原因。之后的存活率上升应为压力变化的幅度影响减少,离子注入剂量起主导作用,随剂量的增加,致死率上升。在8×1015ion/cm2致死率的减少可能为细胞在此时产生了应激反应,具体原因还不大清楚,但如不计初始的陡降点,在该位点的变化与其他文献[13]所述马鞍型曲线相似。
2.3.5.2.2 经初筛与复筛后获得5株菌的抑菌圈直径比DU82大的比较明显,如表3所示。其中DUL10经数代继传均遗传性状稳定,比出发菌株UV38抑菌性能提高了33.5%。菌株的电镜图如图8所示,菌丝较DU82较细,孢子椭圆形。DU82与DUL10的抑菌圈见图9。

图8 DUL10电镜照片
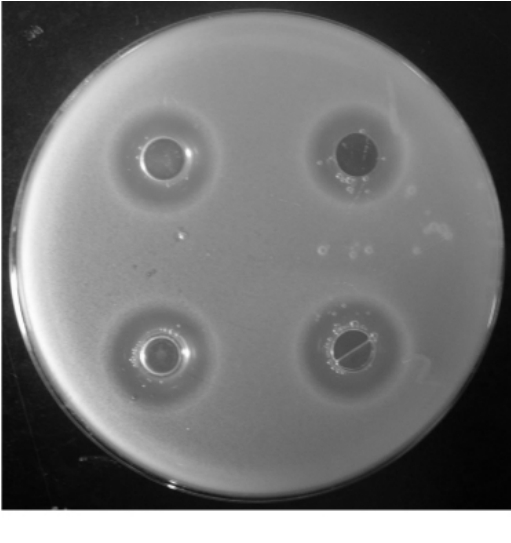
图9 DU82 (1)DUL80 (2) DUL32 (3)与DUL10 (4)的抑菌圈图片
表3 N+离子注入诱变突变株的筛选结果

参考文献:
[1]石功.国外防腐剂市场新动向[N].中国食品报,2002.8.7.2
[2]Shoji Shima. Antimicrobial action ofε-PL[J],Journal ofAntibiotics,1984,37: 1449~1455
[3] Prihardi kahar,Joshiharuk iwata,Enhancement ofε-PLproduction byStreptomyces albulus Strain 410 using pH Control[J].Journal ofBioscience and Bioengineering,2001,91 (2):190~194
[4]徐红华,王英东,赵新淮.多聚赖氨酸在食品抑菌方面的研究进展[J].粮油食品科技,1999,7: 33~34
[5] Ckenzie.Comparative gene transfer efficiency of low molecular weight polylysine DNA-condensing peptides[J].Journal ofPeptide Research,1999,54 (4):311~318
[6] Nussinovitch-A,Gershon-Z,Nussinoviteh-M .Liquidcore hydrocolloid capsules [J].Food Hydrocolloids,1996,10 (1):21~26
[7]中国科学院微生物研究所放线菌分类组编著.链霉菌鉴定手册.北京:科学出版社,1975
[8]施巧琴,吴松刚主编.工业微生物育种学.第2版.北京:科学出版社,2003
[9]章名春编著.工业微生物诱变育种.北京:科学出版社出版,1984
[10]杜连祥,等编著.天津:天津科学技术出版社,1992
[11]李市场,白爱枝.低能离子注入木聚糖酶产生菌黑曲霉(Aspergillus Nigerr)育种中参数的优化.激光生物学报,2003,12 (5)
[12]徐增亮著.离子束生物技术引论.安徽科学技术出版社出版,1998
[13]甄卫军,李茜,等.低能N+离子注入谷氨酸产生菌诱变选育及其发酵的研究.中国科学院研究生院学报,2000,19 (4)
[14]姜俊云,贾士儒,等.搅拌转速和pH对ε-聚赖氨酸发酵的影响.生物加工过程,2004,2 (2)
【注释】
(1)基金项目:国家“十五”科技攻关项目(编号: 2004BA713B05-06)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















