自1960年英国学者Cocking首次用纤维素酶制备番茄根尖原生质体获得成功以来,迄今已有46个科160多个属的360多种植物(含变种和亚种)的原生质体再生植株问世,80余种科间、属间、种间或品种间细胞融合获得胞质杂种。
1)原生质体的分离方法
原生质体的分离方法主要有机械法和酶解法两种,其中酶解法是目前常用的技术。
机械分离法是19世纪末由Klercker首创。具体方法为:先将细胞放在高渗糖溶液中预处理,待细胞发生轻微质壁分离,原生质体收缩成球形后,再用机械法磨碎组织,从伤口处可释放出完整的原生质体。该方法能防止酶对原生质体产生副作用,但收获量太小。
酶解分离法是将材料放入能降解细胞壁的混合等渗酶液(纤维素酶、果胶酶和半纤维素酶)中保温一定时间,在酶液的作用下,细胞壁被降解,从而获得大量有活力的原生质体的方法(见图5.3)。用酶解法游离原生质体时,首先要考虑植物材料的正确选择。一般情况下,当植物处于最佳生长状态时取材,分离的效果最为理想。除此,还应考虑酶的种类和纯度、酶液的渗透压、酶解时间及温度等因素对分离原生质体的影响。
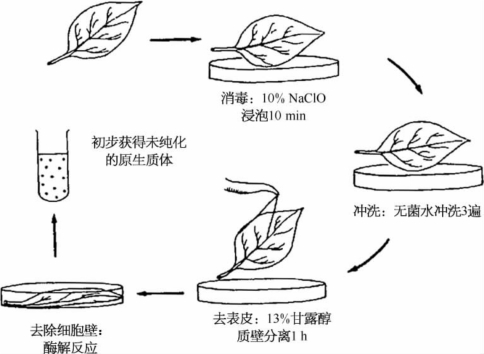
图5.3 酶解法分离原生质体
2)原生质体的纯化方法
酶解后的原生质体悬浮液中混有多种成分,主要是淀粉体、原生质体和细胞碎片,其中淀粉体呈白色球体(见图5.4)。

图5.4 显微镜下未纯化的原生质体(郭艳萍,2013)
原生质体纯化的主要方法是离心纯化(见图5.5、图5.6),分为漂浮法、沉降法、界面法。
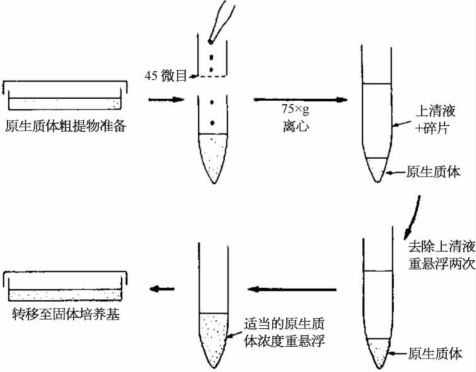
图5.5 原生质体离心纯化
漂浮法,采用比原生质体密度大的高渗溶液,从而使原生质体漂浮在液体表层的纯化方法(见图5.7),是目前比较常用的方法。常用的高渗溶液有Ficoll(聚蔗糖)和血清白蛋白。此法可以避免分离的原生质体因振荡被组织碎片撞击而破损,且所用药品简单,成本低,但对离心力要求比较严格,掌握不好,原生质体则不易漂浮。可采用不同浓度和不同离心速度分次漂浮的方法。

图5.6 烟草叶片原生质体的制备流程
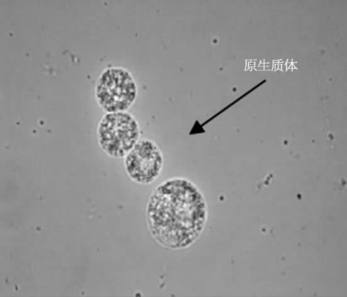
图5.7 漂浮法纯化后的原生质体(郭艳萍,2013)
沉降法,利用比重原理,在具有一定渗透压的溶液中,先进行过滤然后低速离心,使纯净完整的原生质体沉积于试管底部,而碎片和杂质等悬浮在上清液中,随后将上清液吸出,用洗液清洗原生质体。常用的洗液为酶混合液中的渗透压缓冲液或CPW盐溶液。此法纯化原生质体比较简单,但由于原生质体沉积于试管底部,造成相互挤压,常引起原生质体的破碎。
界面法,又称不连续梯度法,采用两种密度不同的溶液形成不连续梯度,通过离心使原生质体与破损细胞分别处于不同液相中,从而纯化原生质体的方法。常用的梯度离心介质有蔗糖、Ficoll、Percoll、血清白蛋白、甘露醇等。此法可以收集到数量较大的纯净原生质体,同时避免收集过程中原生质体因相互挤压而破碎。
3)原生质体活力的主要鉴定方法
(1)形态观察法。一般通过形态特征即可识别原生质体活力。如果颜色鲜艳、形态完整、富含细胞质,则有活力。也可采用渗透压变化法,把原生质体放入高渗或低渗溶液中,观察张缩情况来判断活力,如果体积能随溶液渗透压变化而改变,即为活的原生质体。
(2)染色观察法。检测原生质体活力的最常用的染色方法有荧光醋酸双酯(FDA)染色法、酚藏花红染色法、锥虫蓝染色法和荧光增白剂染色法。其中FDA法最为常用。FDA本身不发荧光也不具有极性,能自由穿过细胞质膜。活细胞内FDA可以被酯酶裂解而成为具有荧光的极性物质,该极性物质则不能自由穿越质膜,在完整的活细胞内积累(见图5.8)。活细胞发淡绿色荧光而死细胞无荧光或荧光很微弱。在荧光显微镜下,能够分辨出具有活力的原生质体,并计算出存活百分比。
4)影响原生质体提取的因素
(1)取材的影响。取材的影响包括不同生态型、不同材料、不同取材时期和部位等方面的影响。Sheen实验室建立了拟南芥叶片原生质体获得的标准方法,通过此方法可以从1 g拟南芥叶片中获得107个原生质体。但通过此方法从1 g玉米叶片中可获取5×106个原生质体,不如拟南芥原生质体的产量。张宪省实验室分别以拟南芥未抽薹时期和拟南芥已抽薹时期的叶片为材料提取原生质体,经过实验验证,拟南芥未抽薹时期的叶片中提取得到的原生质体数量多、杂质少;而拟南芥已抽薹时期的叶片中提取得到的原生质体数量少、杂质多。由此可见,不同的试验材料对应着不同的提取方法。
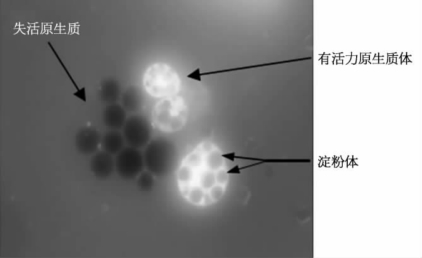
图5.8 FDA染色后荧光激发下的原生质体(郭艳萍,2013)
(2)酶制剂的选择。目前市场上出现了许多游离原生质体的酶制品,但各种酶的性质、活性、纯度及作用有很大的差别,选用时应根据植物材料和酶制品的特性进行综合考虑。
(3)酶解条件。影响酶解过程的主要因素有温度、光照、p H值、渗透压、离子浓度、振荡及预处理等。脱壁的原生质体对光非常敏感,分离原生质体一般在黑暗条件下进行。一般情况下,酶解温度为25~30℃,酶解液的p H值根据所用酶种类的不同可以在4.7~5.8之间变动。
酶解前对材料进行轻微的质壁分离,酶解时低速振荡(40 r/min)以及酶解液中高钙镁离子浓度(CaCl2和MgCl2)等能提高原生质体的产量和质量。另外选择合适的渗透压稳定剂也能提高原生质体的产量和质量。原生质体由于细胞壁的解除和壁压的消失将引起细胞破碎,因而在酶液、原生质体洗涤液及培养液中必须调整渗透压,维持细胞内外渗透压平衡,防止细胞涨破或过分收缩而破坏内部结构。常用的渗透压稳定剂:甘露醇、山梨醇、葡萄糖、蔗糖等,浓度在0.40~0.80 m M。渗透压稳定剂还可促进分离的原生质体再生细胞壁并继续分裂。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















