本节讨论与肿瘤发生发展有关的表观遗传调控机制。癌症表观遗传学旨在研究癌细胞基因组不涉及DNA序列改变的表观遗传修饰,对于一个正常细胞向癌细胞转化而言,表观遗传改变的意义不亚于基因突变。肿瘤抑制基因沉默和癌基因激活的表观调控机制包括基因组中CpG岛甲基化型的改变和组蛋白修饰异常,以及多种DNA结合蛋白的表达调控失常。阐明肿瘤的表观遗传问题对于癌症的预防、诊断和治疗无疑是十分重要的。
早在1979年霍利迪(R.Holliday)就曾经提出DNA甲基化可能在癌变过程中起着重要的作用。1983年范伯格(A.P.Feinberg)和福格尔斯坦(B.Vogelstein)就发现癌细胞中DNA甲基化的总体水平低于正常细胞,并证实肿瘤细胞的低甲基化频繁发生于重复序列和在生物演化过程中引入的外来寄生性DNA(parasitic DNA)。在正常情况下,这类DNA序列是被高度甲基化的,这种特征性的甲基化反映出DNA甲基化和RNA干扰(RNAi)一样,都是在生物演化中起源于对外来DNA侵袭的一种防御机制,细菌中的限制-修饰系统就是以DNA特定序列的甲基化和甲基化序列专一性核酸内切酶为基础的。实验也表明人类基因组的内源性转座子等可移动因子的激活确实是和细胞的遗传不稳定性相关联的,如有一些肺癌和结肠癌细胞DNA总体甲基化水平的降低就和K-ras等癌基因的激活有关。
除了DNA甲基化的总体水平降低之外,癌细胞往往出现局部序列的高甲基化,高甲基化通常集中在启动子等基因表达调控元件附近的CpG岛。从1986年贝兰(J.B.Baylin)等最初发现降钙素(calcitonin)基因在癌细胞中呈现出正常细胞中不存在的异常甲基化起,迄今已发现相当多的基因在癌细胞中显现异常甲基化。例如,在肾癌和视网膜母细胞瘤中VHL(von-hippel landau)基因的沉默和前列腺癌中与DNA损伤修复有关的GSTP1(glutathione-S-transferase p 1)基因的沉默,都可以被抑制DNA甲基转移酶的5-氮胞苷重新激活,这提示DNA甲基化的异常是癌细胞中某些抑制恶性生长的基因沉默的原因。在肿瘤细胞中最常见的因启动子高甲基化而转录沉默的基因包括细胞周期蛋白依赖性激酶抑制基因p16,肿瘤抑制基因p53,三个不同的DNA损伤修复基因MGMT、MLH1和BRCA1,以及细胞周期调节基因APC等。
另一方面,基因组其他部分的CpG岛低甲基化则会通过印迹丢失或者转座因子的重新激活而导致染色体的不稳定性。例如,胰岛素样生长因子基因IGF2的印迹丢失会增加罹患肠癌的风险,并和导致显著增加新生儿癌症风险的贝克威思-怀德曼综合征(BWS)有关联。CpG岛在正常细胞的编码基因之间的非编码区出现的频率是比较低的,基因组中的寄生性重复序列和许多癌基因往往因高度甲基化而受到抑制。研究资料显示,癌细胞基因组中CpG双核苷酸的总体甲基化水平要比正常细胞低20%~50%,这可能反映了癌细胞的DNA甲基转移酶作用受到了阻抑。然而,这会增加有丝分裂重组和染色体重排,甚至催生异倍体细胞形成的机会。值得注意的是,甲基化的胞嘧啶经过水解、脱氨后很容易自动转变为胸腺嘧啶从而提高突变的发生率。不仅如此,甲基化胞嘧啶还增加了核苷酸对紫外线的吸收导致嘧啶二聚体的形成,随之而来的DNA的有误修复也可能增加基因突变。
在人类癌细胞中还观察到了多个功能相互关联的基因,如细胞周期相关基因群和DNA损伤修复相关基因群同时显现肿瘤特异性甲基化。实验还提示基因表达的甲基化失活似乎是癌变的极早期事件,例如在结肠癌的癌前病变组织中就发现过特定基因的甲基化,并观察到甲基化程度与整个病程演进过程的关联。癌细胞中大多数沉默的肿瘤抑制基因启动子区域CpG岛的高甲基化,也许是一个分阶段的渐进过程,先是基因启动子区某些特定的CpG岛从头甲基化,再由此扩展至更多的CpG岛,最终使基因进入持续的沉默状态。有实验提示,最初的甲基化可能起源于在DNA自发损伤修复中产生的5-甲基脱氧磷酸胞嘧啶(5md-CMP)的错误参入。在正常情况下,5md-CMP由一种专门的酶脱氨后转变为脱氧磷酸胸腺嘧啶(dTMP)。而在癌细胞中,相当一部分酶的活性发生了改变,致使部分5md-CMP有可能以二磷酸或三磷酸核苷的形式错误参入DNA。有人曾发现一个长期在体外培养的中国仓鼠卵巢细胞(CHO细胞)分离株的5md-CMP脱氧酶的活性明显下降,造成两个受试基因位点的自发表观突变(spontaneous epimutation)频率明显增高,H3-标记的5md-CMP参入实验证明这个CHO的表观突变细胞株确实参入了甲基脱氧胞苷。
除了DNA甲基化异常以外,在肿瘤细胞中往往出现组蛋白修饰和染色质重塑的异常,如在正常细胞中组蛋白高度甲基化的异染色质区域,特别是重复序列,在肿瘤细胞中出现了甲基化程度下降而乙酰化程度明显增加;在常染色质区域则出现了完全相反的变化,启动子区域甲基化程度增加,组蛋白乙酰化呈逐步丢失趋势。这一系列表观遗传异常造成整个肿瘤细胞基因组的表达调控失常。
最近,B.埃默森(Beverly M.Emerson)等发现,位于肿瘤抑制基因p16上游的一个印迹调控区的差异甲基化区域(DMR)中特有的染色体屏障调节蛋白CTCF结合序列CCCTC发生了缺失,使它与CTCF共同构成的一道将异染色质和基因组其他部分隔开的分子藩篱不再存在,异染色质型特征性表观遗传修饰的结构得以强袭扩展,最终使p16沉默。这可能就是癌细胞发生发展过程的一个关键性事件。图8-19是CTCF特异性结合序列缺失造成肿瘤抑制基因沉默过程的示意图(关于屏障调节蛋白CTCF和差异甲基化区域DMR的概念可参阅第5章)。
近年来的研究还揭示了表观遗传病与肿瘤的相关。例如BWS患者的肾母细胞瘤的发病率比对照群体高1 000倍。对肺癌、神经胶质瘤(glioma)、乳腺癌和结肠癌的分析表明IGF2等基因的印迹丢失(lossof imprinting,LOI)是肿瘤危险因子,也是最常见的表观遗传改变。LOI的机制还涉及CTCF和另一种印迹调控蛋白(brotherof regulatorof imprinted sites,BORIS)在染色体上的结合靶位的甲基化状态的改变,以及印迹调控蛋白质复合体对染色质结构重塑的影响。
染色质分子屏障对于真核细胞基因组而言是重要的调控序列,也许它们的作用还不仅是调节增强子与启动子,或阻止异染色质的扩展。它们很可能借助多种经不同修饰的屏障蛋白及其特征性结合序列构筑起基因组中影响更为广泛的调控网络,甚至能动性更强的染色质组织系统。
近年来的研究充分表明,正常组织和恶性肿瘤组织中处于不同等级层次细胞的表观遗传学修饰状态是不相同的。恶性肿瘤组织中有极少数细胞是一群类似于成体干细胞那样具有自我增殖和分化潜能的肿瘤细胞,称肿瘤干细胞(cancer stem cell,CSC),它们经过一系列的中间步骤能产生出分化的子代细胞。与成体干细胞一样,DNA甲基化、组蛋白修饰、染色质重塑及miRNA等表观遗传学机制在CSC的调控中发挥着重要作用,然而正常细胞分化所伴随的细胞重编程过程是可逆的,而细胞恶性转化过程是一个不断地发生和积累遗传突变和表观遗传学事件的不可逆过程,最终会形成一个遗传背景多种多样的肿瘤组织。在每一种遗传背景相同的细胞群中还会出现表观遗传学背景不同的亚克隆细胞。CSC不仅能导致肿瘤发生,还是引起肿瘤转移、复发和抗药的关键原因。此外,染色质调控因子或基因转录调控因子的活性发生改变也可能促进细胞转化和表观遗传的致癌性重编程,实验资料还提示这些调控因子在肿瘤形成之后会继续发挥作用,促使已分化的肿瘤细胞重编程为干细胞样的肿瘤干细胞,在肿瘤组织里细胞分化与重编程这两种作用最后会达到某种平衡的状态。肿瘤干细胞模型是近年来关于肿瘤形成及生物学特征的一种重要观点。图8-20是正常组织和肿瘤组织中的细胞分化或重编程的等级层次及其渐变过程的示意图。
近年来的研究发现,具有表观遗传调控作用的miRNA在肿瘤转移中起着重要的作用。肿瘤转移的开始阶段主要包括肿瘤细胞发生上皮细胞向间质细胞的转化(epithelial-mesenchymal transition,EMT),导致细胞间黏附能力逐渐丢失,进而穿越基底膜和血管壁进入循环系统,并逃避免疫监控,最终使部分肿瘤细胞侵袭特定器官形成转移灶。而miRNA,如miR-200家族成员可靶向调节上皮细胞向间质细胞转变的两个重要转录因子ZEB 1(zinc finger E-box binding protein 1)和ZEB2(zinc finger E-box binding protein 2),促进肿瘤的转移。已经发现有一部分miRNA在细胞内的水平会呈现出与肿瘤转移相关的时空特异性。对特定miRNA的分析也已经成为肿瘤转移相关的临床基础研究的重要内容。
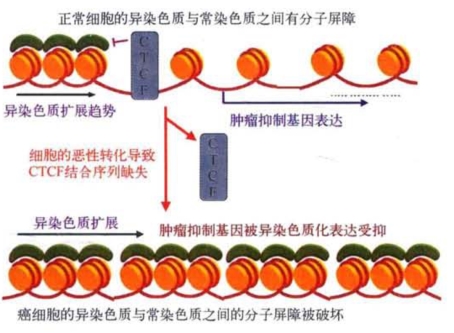
图8-19 癌细胞中介于异染色质和基因组其他部分之间的分子屏障的缺失导致肿瘤抑制基因沉默过程的示意(改自S.Kaam和B.Emerson)

图8-20 正常组织和肿瘤组织中的细胞分化或重编程的等级层次(引自M.L.Suvà等)
miRNA与部分肿瘤抑制基因的作用机制也密切相关,如人们发现与乳腺癌和卵巢癌发生风险有重要关联的BRCA1借助表观遗传机制行使肿瘤抑制基因功能的新模式,用图8-21来说明:野生型BRCA1和组蛋白脱乙酰酶HDAC2形成复合物,并结合于MIR-155的启动子,减少了这个区域的组蛋白乙酰化,降低了miRNA-155的表达(图8-21a)。即使在存在一个BRCA1突变等位基因的前提下,野生型BRCA1仍然足以保持对miRNA-155表达的控制(图8-21b)。具有保护作用的野生型BRCAl基因的丢失阻断了BRCA1-HDAC2复合物的形成使MIR-155启动子区域的组蛋白得以乙酰化,并促进miRNA-155的表达(图8-21c)。大量miRNA-155作用于它的下游靶分子,致使细胞恶性转化和肿瘤的发生。这个例子为我们从一个新的视角来认识肿瘤敏感基因BRCAl的突变是如何导致乳腺癌和卵巢癌的(图8-21d)。
图8-22是致癌性miRNA(oncomiR)和肿瘤抑制性miRNA(tsmiR)在肿瘤发生、发展信号通路中的作用示意图,同时也列出了相应的miRNA拮抗剂(antago miRs)和tsmiR模拟物(miRNA mimic)在肿瘤防治中可能的作用和机制。
2013年,美国纪念斯隆-凯瑟琳癌症研究中心的桑德(C.Sander)研究组和哈佛大学医学院的布尔克姆(R.Beroukhim)研究组同时发表了有关泛癌症(pancancer)研究的文章,他们的研究代表了跨越不同组织的界限来探索不同类型肿瘤之间具有共性的遗传学问题的新方向、新潮流。两个研究组都利用了癌症基因组图集(The Cancergenome Atlas,TCGA)的数据库。
布尔克姆研究组检查分析了源自11种不同肿瘤的4 934个病理样本基因组中约150万个位点的DNA拷贝数变异,共发现了约20万个体细胞的拷贝数变异(somatic copy-number alterations,SCNA),平均每个肿瘤样本含39个。这些SCNA的位置、长度和拷贝数都不同,提示它们形成机制也不一样。值得注意的是在基因组140个区域观察到反复集中出现的SCNA,其中的102个区域并没有已知的癌基因或肿瘤抑制基因,却可能包含相当多涉及表观遗传调控的基因,50个区域有明显的DNA序列改变。观察结果强烈地暗示这些区域存在尚待深入研究的与肿瘤发生发展有密切关联的遗传因子,而且这些因子很可能不是蛋白质编码基因而是非编码RNA,尤其是lncRNA。肿瘤与非蛋白质编码基因之间的关系正在展开癌症研究的新画卷,有的学者把涉及非蛋白质编码基因的遗传物质称为基因组中的暗物质(dark matter)。迄今已有的研究资料表明,lncRNA在肿瘤相关的基因表达调控中起着至关重要的作用,特定的表达紊乱有可能从根本上使细胞增殖失控,伴随恶性转化的进程还可能产生癌细胞侵袭、转移。
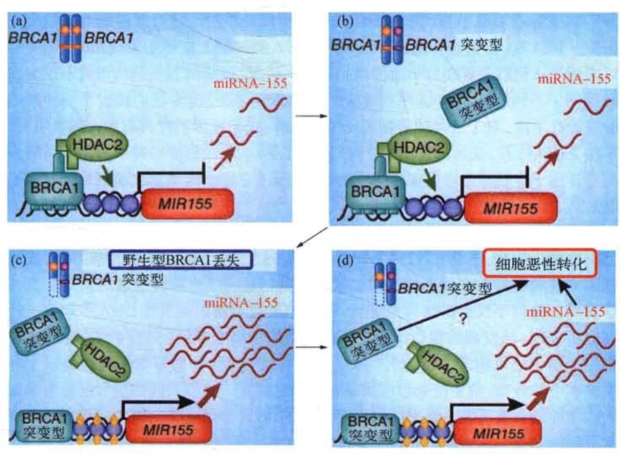
图8-21 BRCA 1通过表观遗传机制调控miRNA-155的表达来执行肿瘤抑制基因的功能(改自A.Velkove和A.N.A.Moneteiro)

图8-22 致癌性miRNA和肿瘤抑制性miRNA在肿瘤发生、发展信号通路中的作用
有关肿瘤形成中表观遗传修饰的病理作用并没有否定有关肿瘤起源的突变研究。1981年,温伯格和巴瓦西德等先驱在人类膀胱上皮癌中发现Ras基因突变以来的工作仍然是肿瘤分子遗传学的基石。然而,肿瘤的表观遗传研究不仅为我们提供了一种不涉及DNA序列改变的病因研究途径,也为我们提供了一种新的肿瘤治疗手段,对于医师和药物研发企业来讲,它比基因治疗具有更大的吸引力。早在2004年5月,美国的食品药物管理局(FDA)就已经批准一种甲基化抑制剂5-氮胞苷用于骨髓异常增生症的临床治疗,据报道它能使因甲基化而沉默的基因重新激活。
桑德研究组针对致癌的分子机制复杂多样和癌细胞对肿瘤治疗的反应千差万别这两个问题,分析了12种不同类型肿瘤的3 299个病理样本的基因组,发现基因突变和拷贝数变异造成基因组极端不稳定是癌细胞基因组最为突出的遗传学变异。他们不仅分析拷贝数变异,还详细研究了基因突变和DNA甲基化。观察分析表明,已发现的数以千计的不同类型的遗传变异中,只有479种会在各种各样肿瘤中反复出现。研究人员又进一步检查这479种遗传学变异在每一个肿瘤样本中的分布,希望能突破组织器官界限来建立一套以共同的信号通路为基础的新的肿瘤分类系统。毫无疑问,肿瘤的组织器官分类对临床医学而言当然是非常重要的,然而,泛癌症研究确实开拓了癌症基础研究的新思路。
我们对癌基因的讨论是从劳斯的病毒致瘤实验开始的,关于病毒可能致癌的劳斯假设又被广泛接受,并获得了病毒致癌的实证。美国卫生和福利部发布的新版《致癌物报告》也列入了多种病毒,其中最值得注意的是造成急性或慢性肝炎的病原体乙肝病毒(HBV)和丙肝病毒(HCV),因为慢性的乙型肝炎和丙型肝炎感染可导致肝癌发生。还有导致生殖系统黏膜感染的性传播病毒人乳头瘤病毒(HPV)可造成女性宮颈癌发生。此外,《致癌物报告》还列入了生活中经常会接触到的致癌化合物,如杂环胺化合物、纺织品染料、涂料和墨水中的一些物质。根据系统的流行病学调查资料,多家国际学术机构确认吸烟和酗酒,甚至大气污染物均能增加肿瘤的发病风险。
人们对肿瘤及其发生、发展机制的认识还在不断深入,本章只讲述了已经认识到的知识中的一部分。然而,我们提出了一个在生物学和医学中非常重要的问题,即对癌基因和肿瘤抑制基因的研究不仅有助于阐明肿瘤发生、发展的机制,癌症的诊断、治疗和预防,也为揭开包括人类在内的生物有机体正常生长和发育之谜。遗传学的研究和医学的研究往往从突变、异常、病态去揭示和研究正常的生物学反应和生理学功能。例如,通过对突变基因的研究达到对正常的野生型基因及其蛋白产物的认识,通过对白化的研究达到对色素代谢调控的认识,通过对糖尿病的基础研究以及临床诊断和治疗来认识胰岛素的结构、功能和糖代谢的调节机制。这也许就是癌基因和肿瘤相关基因的研究如此吸引人们持续不断关注的重要原因之一,也许我们分离和研究的各种癌基因和肿瘤相关基因正是控制人体生长和发育的重要基因群,也许对癌基因和肿瘤相关基因的研究正在为我们揭示一条最终会阐明生命本质的科学之路。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















