表观遗传学的英文是epigenetics,这个词最初是用来描述从受精卵发育成为成熟个体的胚胎发育过程的,当时人们对这个过程的认识非常有限。从学科发展历史来看,表观遗传的研究与生物演化和个体发育的研究密切相关,随着我们对真核生物基因表达的分子机制知识的不断积累,表观遗传的含义发生了极为深刻的变化。现在我们不仅了解了生物机体的每一个细胞都具有相同的DNA,还对基因表达的机制有了相对深入的认识。如今,表观遗传已经成为一个专有名词,专门用来表述某些不涉及DNA中的核苷酸序列改变,却与DNA的化学修饰,或与结合于DNA的结构蛋白或调节蛋白修饰相关的基因表达模式相关联的遗传现象。或者说,表观遗传学是专门研究不涉及DNA序列变化,却能通过有丝分裂或(和)减数分裂复制传递的基因功能表达模式的建立与维持机制的遗传学分支学科。表观遗传机制在胚胎发育早期的作用似乎又与epigenetics最原始的含义有了内在关联,这表明遗传问题的阐明为思考胚胎学问题创造了必要的前提条件,从传统的胚胎学发展为发育生物学的标志就是涉及发育和分化的基因表达调控机制的阐明。譬如同源异形基因(homeoticgene)组成的同源框基因簇(Hoxgene cluster)的分子发育遗传学研究提示,Hox基因在胚胎发育过程中能调控其他基因的时空表达,几乎在所有动物的发育过程中都控制着身体各部分形成的位置,包括确定动物身体轴向器官的分布、分节、肢体形成等,因而在主要生物群的产生与生物多样性起源中扮演着类似总设计师或“万能开关”的角色。它将机体发育的空间特异性展开为身体前后轴上不同部位的结构细节,进而影响细胞的分化,保证了生物体在正常的位置发育出正常形态的躯干、肢体、头颅等器官。如果Hox基因发生突变,便会导致胚胎发育的错位或基因的异位表达,产生同源异形现象(homeosis),使动物某一体节或部位的器官变化成为别的体节或其他部位的器官。在整个分化发育过程中基因表达模式的表观遗传修饰的建立和维持起着特别关键的作用。
早在20世纪30年代,摩尔根实验室的马勒就曾经发现果蝇的某些基因可以因为从常染色质区域易位到异染色质区域,或者反过来从异染色质区域易位到常染色质区域,就可能会显著改变其表达的性状。他把这种不涉及基因突变的性状改变称为基因表达的位置效应(position effects)。马勒等的研究,特别是麦克林托克在玉米转座因子的大量研究,提示基因的表达会受到它在染色体上所处位置的影响,基因在功能表达上并不是绝对独立的。20世纪80年代观察到抗体的多样性涉及体细胞谱系的DNA重排,这在某种意义上也是一种表观遗传事件,它与马勒观察到的位置效应导致的基因表达变化的本质有一定的共性。
然而,大量的表观遗传研究并不涉及DNA片段的结构重排,而是聚焦于碱基的修饰和在细胞核内与DNA形成复合物的蛋白质。譬如,20世纪60年代初发现的X染色体失活是早期发现的不涉及DNA序列改变,但却能以克隆形式在体细胞谱系中遗传的表观遗传机制。70年代中期起,相继发现了DNA甲基化修饰现象,甲基化的建立和在DNA复制中的维持机制,甲基化的去除机制,以及相关的一系列酶系。还发现了Igf2/H 19等位点的表观遗传调控模式。
学者们还认识到真核细胞核中与DNA相互结合的蛋白质,尤其是组蛋白可能与DNA修饰有关联。1964年,有人发现组蛋白的乙酰化可能与基因活化相关,此后又发现了甲基化、磷酸化和泛酸化等组蛋白修饰形式。1974年,科恩伯格和托马斯(J.O.Thomas)发现构成染色质的基本亚单位是核小体(参见第4章),研究又证实组蛋白的氨基端尾部从DNA-蛋白质组成的八聚体核心向外伸出,因此很容易经特定酶系的催化而被修饰。20世纪80年代,格林施泰因(M.Grunstein)等的研究提示组蛋白的氨基端尾部在基因转录激活或抑制,以及染色质沉默结构形成的调控机制中起着至关重要的作用。此后10来年是发现和重新评价组蛋白修饰作用的重要时期,许多有关组蛋白修饰的重要分子元件和结构组合,如组蛋白修饰和核小体重塑复合物,以及与此相关的酶系大多是在这个阶段发现或被证实的。值得注意的是某些非编码RNA也可以像蛋白质那样被招募到修饰或重塑组蛋白的特定位置。与DNA的甲基化修饰不同,我们至今尚不十分清楚这类与基因激活的组蛋白修饰相关的表观遗传信息如何在细胞分裂过程中传递下去的。但确实有些研究提示经过修饰的组蛋白能以其特有的方式招募蛋白质,并影响染色质局部的结构与功能。如组蛋白H3第9位赖氨酸(H3K9)的甲基化后可招募异染色质蛋白HP 1,进而HP1又能招募负责甲基化的酶(如Suv39H1),从而导致染色质的沉默状态沿着该区段延伸扩展。图9-7a是组蛋白的表观遗传标记在染色体复制过程扩展延伸的一种可能模式的示意图。图中显示经H3K9甲基化修饰的组蛋白尾部M与该种修饰的特异性结合蛋白B相互作用,蛋白B还能结合特异性催化酶W,而W能对邻接的核小体进行同样的组蛋白修饰。这样,组蛋白的表观遗传标记就能逐步向前延伸,直到界定异染色质和常染色质边界的屏障因子的出现。有人将这套机制用来解释细胞分裂周期中传递和维持该区段特定的组蛋白表观遗传修饰模式的可能机制(图9-7b)。
与DNA甲基化一样,组蛋白修饰除了在细胞分裂过程中维持已经建立的表观遗传修饰状态的机制外,还必须考虑从头修饰问题,即从无到有地建立特异性组蛋白修饰的机制。2011年,沃斯(T.C.Voss)等报道转录因子糖皮质激素受体(glucocorticoid receptor,gR)作为最初参与染色质表观遗传修饰的先行分子,可能参与将结构紧密的染色质松弛打开的启动过程,然后将具有DNA激活的ATP酶活性的染色质重塑复合物Swi/Snf招募至它介入的染色质位点。在ATP存在时,Swi/Snf复合物能降低核小体中DNA和组蛋白之间相互作用的稳定性,其表现为该区段染色质对DNA 1酶的水解高度敏感。在染色质重塑的松弛阶段,GR存在时间非常短,一旦GR离开,ER pBox复合物就进入该区段,将染色质重塑过程持续下去(图9-8)。
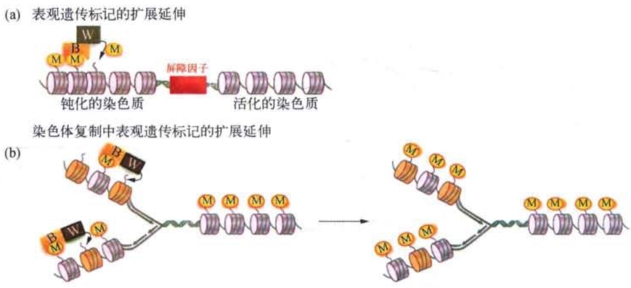
图9-7 表观遗传标记在染色体复制过程中的扩展延伸机制的可能模式(改自G.Felsenfeld)
(a)异染色质区组蛋白H3K9甲基化修饰扩展延伸的一般模式,被修饰的组蛋白尾M与该修饰特异性结合蛋白B相互作用,蛋白B同时具有与一种能对邻接的核小体(图中呈灰色)进行同样的组蛋白修饰特异性催化的酶w的结合位点。这样,组蛋白的表观遗传标记就能逐步向前延伸,直到界定异染色质和常染色质边界的屏障因子的出现;(b)在染色体复制过程中维持组蛋白修饰的可能机制。随着DNA的复制,新参入的核小体(图中呈黄色)夹在亲代核小体(图中呈灰色)之间,亲代核小体上已被修饰的组蛋白尾M就会与蛋白B结合,B再与w相互作用,然后w借助邻接的子代核小体来催化组蛋白尾上同样的甲基化修饰
最近,对单细胞真核生物裂殖酵母(Schizosaccharomyces pombe)中染色质沉默机制的研究,为我们提供了有关染色质沉默结构建立机制的新的实验证据。裂殖酵母决定交配型的基因位点和中心粒序列的异染色质化过程涉及多种RNA转录产物,特别是重复序列转录产物的生成,这些转录产物经过核酸内切酶Dicer、阿格诺蛋白和依赖RNA的RNA多聚酶的作用被加工成一系列小RNA分子。这些小RNA随即被招募至与它们同源的DNA位点,并形成与相关酶结合在一起的复合物,再招募能传递沉默状态的组蛋白修饰复合物,逐步启动异染色质形成过程。我们已经知道生物体能行使多种表观遗传机制,如等位基因特异性修饰、X染色体的随机失活和许多印迹位点的等位基因特异性表达等。表观遗传修饰还与排列于同一个染色体的免疫球蛋白基因的重排导致抗体表达的选择性抑制有关联。此外,研究还表明多梳蛋白基因负责建立能在随后的细胞分裂中得以维持的染色质沉默结构域(参见第5章有关内容)。
表观遗传变化还与植物中副突变(paramutation)的产生有关,副突变让一个等位基因引起可遗传变异,使之表达同源等位基因的形状。雷索尔查根(M.Rassoulzadegan)在2006年证实这是一种能通过减数分裂和有丝分裂遗传的表观遗传状态。此外,研究已经表明,从果蝇一直到人,中心粒的凝聚染色质(condensed chromatin)特征性结构是通过中心粒关联的蛋白质而不是DNA来传递的。在这一系列例子中,由于DNA甲基化、组蛋白修饰或组蛋白变异体的介入,尽管DNA序列始终完整不变,但它的表达能力是受到制约的。X染色体不仅是最早显示DNA甲基化在表观遗传信号传递的实例,实际上它也是多种机制整合起来共同负责表观遗传调控的最好例证。最近的研究表明,DNA甲基化、特定的沉默组蛋白修饰、多梳蛋白群、非编码RNA和组蛋白变异体都参与了X染色体的沉默失活状态的建立,及其在细胞分裂过程中的传递。这一类由非DNA编码的表观遗传信息的传递机制,及其在从受精卵发育成个体整个胚胎发育过程中的作用已经受到高度关注。如今我们对发育过程的知识已经大大增加,特别是有关胚胎干细胞的研究表明少数几个关键性转录因子的表达就能建立起自我稳定的发育多能状态,并能以表观遗传机制通过细胞分裂传递下去。然而,这种状态也可能发生扰动,导致细胞维持不一样的表观遗传表达模式,即按照不同的分化途径分化成不同的细胞类型。借助精细的实验操作也能使已经分化的体细胞重编程成为多能细胞。
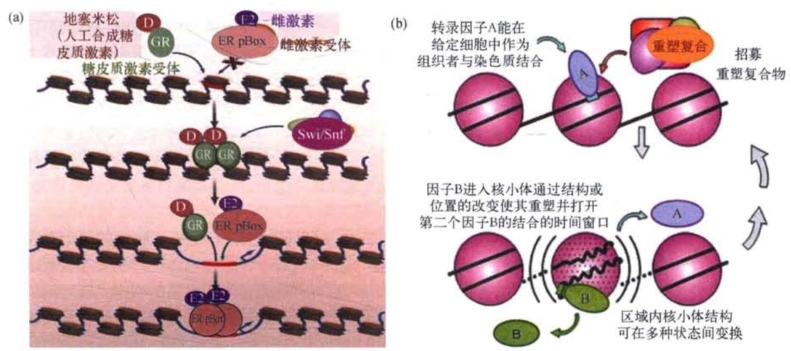
图9-8 组蛋白表观遗传修饰起始的可能机制示意(改自T.C.Voss等)
(a)转录因子糖皮质激素受体(GR)作为修饰的先行分子可能参与将结构紧密的染色质打开过程,结构紧密的染色质对DNA 1酶的水解是不敏感的,而GR能在介入位点招募染色质重塑复合物Swi/Snf,它由SWI及SNF基因(SWI1、SWI2/SNF2、SWI3、SWI5、SWI6)的编码产物和若干其他多肽组成,具有DNA激活的ATP酶活性,在ATP存在的条件下,能降低核小体中DNA和组蛋白之间相互作用的稳定性,致使该区段染色质对DNA 1酶的水解高度敏感。染色质重塑的松弛阶段GR存在时间很短,GR离开后ER pBox复合物就进入该区段,继续染色质重塑的下一个步骤;(b)转录因子参与核小体结构重塑起始的理论假设示意
从马勒发现果蝇的某些基因表达的位置效应到麦克林托克发现转座因子对基因表达的调控作用,再到近30年来大量有关基因功能表达调控的实验研究,我们对表观遗传的研究已经深入到在分子水平上分析从多能干细胞一直到个体的分化状态的整个进程,由此了解到表观遗传机制实际上调控了复杂机体相当大一部分表型。
演化医学理念的另一个重要来源是对人体内细胞群体广泛存在的表观遗传差异的认识,个体内细胞群体之间存在着遗传变异或表观遗传修饰差异是将动态演化的思考引入医学的基础。细胞群体中丰富的遗传和表观遗传变异使选择更加有效,细胞群体更新世代短则使选择更加迅速,这两点有着重要的临床意义,也为具有医学或药学意义的临床干预提供了可能性。
我们已经从演化医学角度把癌症过程表述为由自然选择驱动的若干存在遗传异质性差异的癌细胞克隆之间的竞争,还有一件必须思考的问题是在表观遗传修饰上异质的细胞克隆之间的竞争,这也许比遗传学上异质的细胞克隆之间的竞争更具有潜在的临床意义。在基因组结构一致的前提下,表观遗传修饰的模式直接决定了细胞的基因表达谱,即RNA转录谱和蛋白质表达谱,其中还包括大量非编码RNA转录谱,由此决定了细胞及其生化水平的表型。这表明即使细胞的基因序列没有发生改变,在不产生新突变的情况下,表观遗传修饰也可能扩大细胞群体之间的表型差异。表观遗传修饰上异质性为自然选择和治疗过程中的药物选择提供了表型上有差异的异质细胞克隆群体。可以说医生在治疗进程中会不断面临新的癌细胞群体。此外,表观遗传修饰模式的变化比基因组的结构突变更普遍、更有弹性,可以设想它对选择方向或强度也许有更大的影响力。如果选择因子作用强度足够大,加上癌细胞增殖速度足够快,癌细胞通过群体更新就可能形成在选择条件下增殖更快的新群体来拮抗选择因子,这也许就是生物演化造成抗癌药物的有效治疗期日益趋短的原因。
关于表观遗传修饰和演化医学关系的另一个重要问题是父母之间和亲子之间在母体环境内的拮抗,以及亲代印迹基因在持续拮抗中的作用。
早在1964年,汉密尔顿(W.Hamilton)就用亲族选择(kin selection)概念来解释双亲之间的拮抗。他认为通过对亲族成员的行为的影响来选择会增加家族在下一个世代中的代表性的基因,演化将趋向于某种通过亲族获得的利益能延展至特定个体适应值的增加的行为。1974年,特里费斯(R.Trivers)提出亲族选择意味着双亲可能陷入在双亲环境下与子女的拮抗。对于有性生殖的二倍体物种而言,母亲与她的每一个子女有50%的遗传关联,而孩子与自身的遗传关联是100%,与同胞兄弟姐妹的遗传关联度是50%,与半同胞兄弟姐妹的遗传关联度是25%。因此选择会有利于通过消耗母亲对同胞兄弟姐妹和半同胞兄弟姐妹的投入来增加母亲对自身的投入,最终达到以自身和亲族生育为指标的自身最大适应值。特里费斯颠覆了母子利益相融一致的传统观点。有人根据特里费斯的母子拮抗观点提出,先兆子痫和妊娠期高糖血症这两种妊娠期常见疾病就是胎儿操控母亲的资源来提高自身生长速率的结果。
20世纪90年代起穆尔(T.Moore)和艾格(D.Haig)等学者开始认识到,父母双方为了争取对胎儿有更大的影响而在母体环境中相互拮抗,是借助双亲基因的差异性印迹来进行的,父母双方的基因印迹在胎盘和胎儿中呈现不同的表达水平。在针对遗传工程小鼠的基因印迹自然模式表达的操控实验中,若阻断父源基因印迹而让有利于母亲的基因表达,婴儿出生时体重会减轻10%;反过来若阻断母源基因印迹而让有利于父亲的基因表达,婴儿出生时体重会有10%的增加。这表明在自然状态下,母源沉默基因反映的是父亲的利益,而父源沉默基因反映的是母亲的利益,来源于双亲的基因印迹平衡了双亲的利益,双方拮抗的平衡点是同时达到母子健康状态,并往往使婴儿出生时体重处于中等水平。
在第5章§ 5.3节我们讨论了人的一个父源或母源印迹模式完全不同的染色体印迹区15q11-q13,该区段的父源缺失会导致普拉德-威利综合征(Prader-Willi syndrome),而该区段的母源缺失会导致安格尔曼综合征(Angelman syndoome)。这就进一步提示父母间的利益拮抗超越了妊娠期对母体资源的争夺,绕过了出生后的哺乳期,一直延伸至儿童阶段。近年来有关模式动物和人体的研究还提示这种拮抗的失衡与多种疾病有关,其中包括阿尔茨海默病、基底细胞癌、乳腺癌、糖尿病、肥胖症和酒精中毒等。
毫无疑问演化医学的思考不能被分子医学、细胞生物学或发育生物学所取代,演化的观点必须与已有的学科结合在一起,才会有助于减轻患者的痛苦,拯救更多生命,提高更多病患的生活质量。我们还可以把视野扩展到人类社会的健康管理,健康管理的核心问题是如何平衡个体的眼前利益和群体的长远利益。例如,一个人可能因为很小的风险而选择不接种疫苗,但要是许多人都这样的话,他们的选择就会削弱整个人群的免疫力,并升高每一个未接种疫苗的人的感染风险。麻疹的重新流行正是这样的例证。又如,一个人可能在并不必要的情况下选用了抗生素治疗,但要是许多人都这样的话,他们的选择会促进病原菌演化出对抗生素的抗性,并升高每一个被这种病原菌感染的人的死亡风险。再如,一个医生只是为了怕担误诊的风险而采用某种没有足够根据且又昂贵的诊断或治疗程序,但要是许多医生都这样做的话,每个人的医疗保险费用就会增加。有人因此选择不买医疗保险而依赖看急诊,但要是许多人都这样的话,那么整个社会就可能不堪重负。这些例子反映我们的公共政策还没有从演化的观点充分考虑整个人群的长远利益,而这正是健康管理的重要思路。目前,我们仍然处在许多新的研究和改革思路的交叉口,所以很难评估演化的观点和思考对医学的全部意义,但我们已经看清它的潜能是无限的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















