随着表观遗传学研究的深入,我们理解正常和异常的基因表达越来越离不开表观遗传调控机制分析。表观遗传调控取决于多层次表观遗传修饰的相互作用,由表观遗传修饰异常引起的疾病主要可分为两大类:一类是在发育的重新编程过程中造成的特定基因表观遗传修饰的异常,有人称之为表观突变(epimutation);另一类是与表观遗传修饰的分子机器结构与功能相关的蛋白质编码基因有关的,如DNA甲基转移酶基因或差异甲基化CpG岛结合蛋白CTCF基因的突变或表观突变。
1983年哈格贝里(B.Hagberg)等以35例临床资料为基础报道了一种遗传性进行性神经系统疾病,患者均为女性,在出生后7~18个月就出现发育停滞,随后出现高级脑功能的迅速恶化和严重痴呆等症状,家系分析显示这是一种X连锁基因突变所致。文献检索表明,在1966年雷特(A.Rett)曾经报道过一种称为脑萎缩性高氨血症(cerebroatrophic hyperammonemia)的神经发育异常疾病,其症状与这种遗传性疾病十分相似,哈格贝里就把这种遗传病命名为Rett综合征(Rett syndrome,RS)。研究表明Rett综合征的致病基因是位于Xq28的McCP2蛋白质(methyl-CpG-biding protein 2)的编码基因McCP2。McCP2是一种甲基结合蛋白(methyl-binding protein,MBP),能专一性地识别甲基化的CpG岛并与之结合,其功能是作为分子榫头将染色质修饰复合物(chromatin-modifying complex,CMC)和DNA甲基化区域连接在一起以阻遏基因的转录。Rett综合征患者的McCP2基因突变集中在甲基化CpG结合域和转录阻遏域。显而易见,这类突变会严重干扰表观遗传修饰的正常功能。值得注意的是McCP2基因的表达谱是比较广泛的,所以,突变所造成的病理作用为什么只局限于脑内神经细胞的机制还有待于研究。
ICF综合征(immunodeficiency-centromeric instability-facial anomalies syndoome)是一种罕见的常染色体隐性遗传病,它是一种变异性免疫缺陷病,主要病症是不同程度的免疫球蛋白缺陷,并伴以面部畸形和智力低下。多个研究小组独立发现,该病是DNA从头甲基化酶DNMT3B编码基因的突变所致。患者至少有两种同型免疫球蛋白的减少或缺失,并造成细胞免疫缺陷。此外,患者淋巴细胞分裂中的1号、9号和16号等多条染色体的环着丝粒区域的异染色质不稳定性也明显增高,位于该区域的一种通常是被甲基化的异染色质组成成分的卫星DNA序列Ⅱ和Ⅲ(satellites 2 and 3)有典型的低甲基化,在ICF患者中甚至完全是非甲基化的。这些卫星DNA序列被认为与着丝粒的功能和动基体(kinetochore)的装配有关。还有人发现ICF患者的失活X染色体上的CpG岛和两个重复序列家族D4Z4和NBL2也出现了DNA失甲基化。这些变化与基因组中5-mC水平降低和某些染色体着丝粒周围区域重复序列的低甲基化是相互吻合的。基因芯片的表达分析还显示,患者淋巴细胞中部分与免疫功能调节相关的基因表达水平下调,但未观察到这些基因启动子区甲基化型的变化,提示ICF综合征中DNMT3B基因的突变可能通过降低转甲基活性而减少了对基因转录的阻遏作用,从而间接影响了淋巴细胞部分基因的表达模式。
埃利希(M.Ehrlich)等发现,虽然DNMT3B与组蛋白脱乙酰化酶、异染色质蛋白1(heterochromatin protein 1,HP 1)、其他的DNA甲基化酶、染色质重塑蛋白、染色质凝聚复合物,以及其他核蛋白都有广泛的功能关联,但DNMT3B催化活性的部分丧失仍被认为是主要的病因。他们还发现ICF患者多涉及转录调控、细胞凋亡和机体免疫反应信号通路的一系列基因的RNA转录水平都与正常人有显著的差异。这些基因可能因DNA甲基化程度降低而调控失常,以致造成患者免疫缺陷和其他症状。埃利希等提出一种假设,认为1号染色体和16号染色体长臂异染色质区的卫星DNA序列Ⅱ的低甲基化通过反式作用封闭了转录因子,并改变了染色质的结构或者非编码RNA的表达,从而引起了这一系列基因表达失常。有人曾经将人的DNMT3B编码基因分离后导入酿酒酵母(Saccharmyces cerevisiae)并使其高表达,转基因酿酒酵母因多种代谢酶基因表达异常而导致生长受抑,这个实验暗示DNMT3B突变确实可能引起基因表达调控失常,也在某种程度上佐证了埃利希的假设。
脆性X综合征(fragile-X syndrome,FXS)是一种以智力低下为主要症状的遗传性智力障碍综合征,疾病相关基因是位于Xq27.3的脆性X智障基因(fragile X mental retardation-1,FMR1),长3.8 kb,由17个外显子编码的蛋白产物被命名为脆性X智力低下蛋白(fragile X mental retardation protein,FMRP),FMR1基因5′端非翻译区包含一个CGG重复序列,后者上游250 bp处有一个CpG岛。FMRP基因最常见的突变是5′端非翻译区中CGG三核苷酸重复序列的异常扩展,一般正常人的(CGG)n重复序列最多为50拷贝左右,扩展至55~200拷贝时称为前突变(pre mutation),扩展至200~2 000拷贝时称为完全突变(full mutation),这种(CGG)n拷贝数的异常扩展是随着世代而不断进行的,又称为动态突变(dynamic mutation)。研究表明(CGG)n重复序列扩展可使上游启动子区域的CGG中CpG岛及附近的序列发生不同程度的甲基化,严重时造成FMRl基因转录失活及其蛋白产物FMRP表达缺失。FMR1基因的沉默还涉及染色质构型的改变,而染色质的浓缩进而使扩展的(CGG)n重复序列的遗传稳定性增加。脆性X综合征患者临床表现为不同程度的智力低下,也可伴有孤僻、焦虑等精神疾病症状,男性患者的症状重于女性。
图5-24a是FMR l基因5′端非翻译区中CGG三核苷酸重复序列数及其甲基化程度对该基因转录和翻译影响的理论假设,图5-24b是FXS患者和正常人,以及男性和女性FMR l基因前突变基因携带者的mRNA与FMRP表达量的实测数据分布图。两组数据都显示前突变基因携带者的FMR1基因很少完全沉默,FMRP表达量也基本正常或略有降低,然而转录的mRNA数量明显高于正常值。转录的增加还呈现出与(CGG)n序列重复数的多少有相关性。FMRl基因的mRNA与FMRP表达量的测定现已成为脆性X综合征的临床诊断和预后的常规方法。

图5-24 FXS患者与前突变携带者以及正常人的相关基因表达水平示意(改自L.Rodriguez-Revenga等)
A,FXS患者;N,CGG拷贝数正常者;NTM,FMRl前突变男性携带者;Pre,FMRl前突变女性携带者;图中黑色横线代表FMRP水平及其变化范围;★代表FMRl的mRNA水平
韦尔勒(D.Wohrle)等的鼠源胚胎肿瘤细胞的FMR 1转基因实验也为CCG重复序列甲基化在脆性X综合征发生中的分子病理学作用提供了新的线索。当将携有CCG重复延伸并甲基化的脆性X染色体转入肿瘤细胞后,会导致去甲基化和FMR1基因转录的重新激活,并增加(CCG)n重复序列的遗传不稳定性。为了证实肿瘤细胞中确实发生了去甲基化反应,用能诱导去甲基化反应的5-氮脱氧胞苷(5-aza-2′-deoxycytidine)处理脆性X细胞,结果使FMRl基因和乙酰化组蛋白H3和H4重新联结,转录也重新被激活(图5-25)。这表明脆性X综合征患者的FMR1基因沉默最初起因于延伸重复序列的甲基化,这也是研究得最清楚的一种因特定DNA序列表观遗传修饰异常而导致的一种疾病表型。

图5-25 FXS的实验性治疗示意
除了脆性X综合征(FXS)之外,三核苷酸重复导致的疾病还有一种迟发性神经退行性疾病脆性X震颤性共济失调综合征(fragile X tremor ataxia syndrome,FXTAS),以及亨廷顿病(Huntington's disease)和脊髓小脑型共济失调(spinocerebellar ataxia,SCA)等。近来的研究表明某些lncRNA的正常表达及其功能也会受到三核苷酸重复的影响并与疾病表型相关联。例如,转录自FMR1基因的两种lncRNA FMR4和ASFMR 1的表达模式与FMRl基因相似,即在FXTAS患者中高表达,而在FXS患者中表达受抑,FMR4和ASFMR1的表达模式与这两种疾病之间的内在联系尚待进一步研究。体外实验研究表明,FMR4在人体细胞中有抗凋亡功能,很可能在神经元及其子裔细胞发育过程中受到FMR4的保护而免遭凋亡。也许FMR1基因与FMR4和ASFMR1相互合作于一个RNA-蛋白质网络,而这个调控网络的阻断则可能会影响大脑的正常功能,这也为解释FXS和FXTAS患者之间的症状差异程度提供了新的思路。由此可见,lncRNA的重复序列的延伸和蛋白质编码基因的重复序列的延伸都与某些神经系统疾病有关联。此外,我们有理由设想这一类lncRNA的突变或者表达调控异常也可能导致疾病,相关的分子机制也应该是疾病表观遗传学研究的重要内容。
1981年威茨拉尔(D.J.Weathrall)等报道了地中海贫血和智力低下的联系,随后证实这并非患者同时患有两种疾病,而是一种X连锁疾病,被称为X连锁α地中海贫血/智力发育迟滞综合征(X-linked alpha-thalassemia/mental retardation syndrome,ATR-X)。ATRX基因突变会引起特征性的发育异常,如严重的智力低下、面部变形、α地中海贫血、泌尿生殖道畸形,甚至出现性反转表型。前期的研究表明ATRX基因编码的蛋白质可能是一种转录调节因子,通过修饰染色质的局部结构来调节转录。在细胞分裂间期和中期,ATRX蛋白质定位在着丝粒附近的异染色质区。在ATR-X综合征患者中发现一些高度重复序列的甲基化型改变,包括编码核糖体RNA的rDNA重复序列,Y染色体特异的卫星DNA和亚端粒区重复序列等区域甲基化的严重减少,提示ATRX编码的蛋白质功能可能起着将DNA甲基化和染色质重塑这两类表观遗传修饰连接在一起的作用。
曾经在超过180个ATR-X患者家系中发现了113种不同的基因突变,但这些突变究竟如何造成α珠蛋白这样的基因表达异常的确切机制一直是不清楚的。2010年劳(M.J.Law)等通过系统分析证实ATRX蛋白质在小鼠和人类基因组中主要与染色体端粒区域和常染色质上的串联重复序列结合,发生了突变的ATRX蛋白则会引起诸如α珠蛋白这类与串联重复序列有关联的基因调控异常,进一步分析还提示靶基因表达调控失常的程度取决于与其关联的串联重复序列的长度。已知基因组中的许多串联重复序列都是富含鸟嘌呤G并能在活细胞内形成非B型DNA结构,如G-四聚体构型(G-quadruplex),而劳等的实验证实ATRX蛋白在体外能与多种呈现G-四聚体构型的DNA(G4)结合,相比B型DNA结构,ATRX蛋白更倾向于与G4 DNA结合,尤其是与若干在ATR-X综合征患者中呈现表达异常基因邻近的富含鸟嘌呤G的串联重复序列相互结合。ATRX蛋白C端有一个与染色质重塑解旋酶SNF2(sucrose non-fermenting 2)同源的解旋酶样结构域,N端有一个ADD(ATRX-DNMT3-DNMT3L)结构包含了一个植物锌指蛋白同源结构域(plant homo-domain zinc finger,PHD),它能与组蛋白H3的变异体H3.3的尾部相互作用,而H3.3的分子伴侣就是能结合ATRX的DAXX蛋白(death domain-associated protein)。已被分析的突变分布表明,与ATR-X综合征相关的A TRX基因突变大多数发生于C端和N端的这两个区域。据此他们提出了一种工作假设,在正常情况下,ATRX蛋白会与靶基因中呈现G4结构的DNA相互结合,协同DAXX 、H3.3使G4 DNA转变为B型结构,并调控靶基因使之正常表达。然而,ATR-X综合征患者中发生了突变的ATRX蛋白不再具有将靶基因邻近的富含鸟嘌呤G的串联重复序列由G4 DNA转变为B型结构的能力,导致靶基因表达失控。此外,有研究提示ATRX和H3.3在一起还有维持染色体上转录活性区和非转录区之间边界的作用。所以,正常ATRX蛋白的丧失也许会造成无转录活性的异染色质区的延伸,甚至沉默邻近区域α珠蛋白这样的基因。劳等的发现不仅为阐明ATR-X综合征的发病机制提供了新的思路,还进一步暗示基因组中的重复序列很可能并不只是没有任何功能的简单重复。通过X连锁α地中海贫血/智力发育迟滞综合征的发病机制研究,可以清楚地认识到基因的表达几乎涉及表观遗传修饰对于控制基因转录和染色体结构稳定的每一个环节,表观遗传信号甚至可以通过具有阻遏特定基因转录的双链RNA分子在细胞间的传递来影响邻近细胞的基因表达。表观遗传调控对相关疾病的深入研究必将有助于阐明参与表观遗传调控的众多分子元件的结构与功能,以及整个基因组表观遗传调控机制(图5-26)。
诚然,目前对于表观遗传修饰在疾病发生中作用的研究还处在初级阶段,我们的认识还很不全面,已经有的一些认识可能还不符合实际情况,但是霍利迪(R.Holliday)等已经提出了表观遗传病(epigenetic disease)的概念,其中包括多种复杂的遗传性综合征、印迹综合征、免疫性疾病和中枢神经系统发育紊乱等,还包括衰老和癌症。关于癌症的表观遗传学问题,将在有关肿瘤的分子遗传学分析的章节中做专门讨论。图5-27汇集了表观遗传的多方向、多层次信息及其与疾病的关联生物信息涉及遗传和表观遗传两个层面。

图5-26 ATRX蛋白结构和功能相关的特征
(a)ATRX蛋白各个功能结构域和ATRX基因突变高发区段;(b)关于ATRX蛋白协同DAXX蛋白以及组蛋白变异体H3.3使四聚体DNA转变为正常的B型二聚体结构的假设示意(改自I.Whitehousei和T.Owen-Hughes)
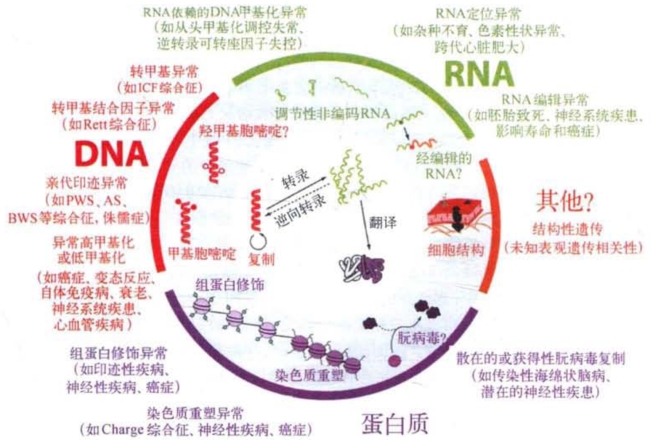
图5-27 表观遗传的多方向、多层次信息及其与疾病的关联生物信息涉及遗传和表观遗传两个层面(引自R.Chahwan)
图的中央显示分子生物学的中心法则:遗传信息从DNA到RNA再到蛋白质。其次是基因组不同层次的表观遗传修饰,包括了解得比较清楚的DNA甲基化、组蛋白修饰、染色质重塑,以及尚待进一步研究的细胞结构的表观遗传修饰,这一系列从分子到染色体再到细胞的修饰同样是充分了解生物表型的根本问题。在最外层列出了表观遗传信息调控与疾病发生、发展及防控相关的表型。分子医学面临的挑战是阐明遗传学和表观遗传学之间错综复杂的关系,逐步增进疾病的预防、诊断和治疗。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















