第一节 细胞周期及其调控
细胞增殖是生命的基本特征,种族的繁衍、个体的发育、机体的修复等都离不开细胞增殖。细胞增殖是通过细胞周期(cell cycle)来实现的,而细胞周期的有序运行是通过相关基因的严格监视和调控来保证的。
细胞周期指由细胞分裂结束到下一次细胞分裂结束所经历的过程,所需的时间叫细胞周期时间。真核细胞的细胞周期包括有丝分裂期(mitosis,简称M期)和分裂间期(interphase)两个阶段。细胞分裂的各个时期周而复始地重复着。M期包括细胞的有丝分裂和胞质分裂两个过程。在有丝分裂的过程中,复制的染色体被分到两个细胞核中,胞质分裂则是将整个细胞一分为二,形成两个子细胞。分裂间期实际上是新细胞的生长期,根据新细胞从开始生长起到分裂前期的生理和生化变化,可分为:G1期(Gap1phase),即从M期结束到S期开始前的一段间歇期;S期,即DNA合成期(DNA synthetic phase);G2期(Gap2 phase),即DNA合成后(S期)到有丝分裂前的一个间歇期;暂不分裂细胞则进入G0期(图1-1)。
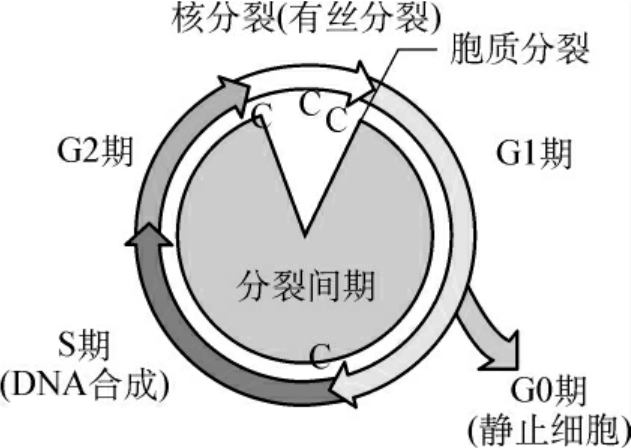
图1-1 真核细胞周期
注:C:为控制点。
一、有丝分裂
有丝分裂期是高等真核生物的增殖分裂方式,因分裂过程中呈现线状纤维结构的纺锤体而得名。其生物学意义在于,将在间期复制加倍的DNA形成染色体再平均分配到两个子细胞中去,使每个子细胞得到一整套和母细胞完全相同的遗传信息。根据形态学特征,有丝分裂过程分为前期、前中期、中期、后期和末期5个阶段。
1.前期(prophase) 最显著的特征是染色质通过螺旋化和折叠变短变粗,形成光学显微镜下可以分辨的染色体,每条染色体包含2个染色单体(图1-2)。主要事件是:①染色质凝缩;②分裂极确立与纺锤体开始形成;③核仁解体;④核膜消失。
2.前中期(prometaphase) 指由核膜解体到染色体排列到赤道面(equatorial plane)这一阶段。纺锤体微管向细胞内部侵入,与染色体的着丝点结合。着丝点处的分子马达使染色体向微管的负端移动。在光镜下可以看到,此时染色体也就是既向一极移动也向另一极移动,是以振荡的方式移向纺锤体中部的。
3.中期(metaphase) 每条染色体逐渐向纺锤体中心区移动,最终排列在赤道板上,这是纺锤体动粒与微管相互作用的结果,此时,染色体向稳定状态转变(图1-3)。
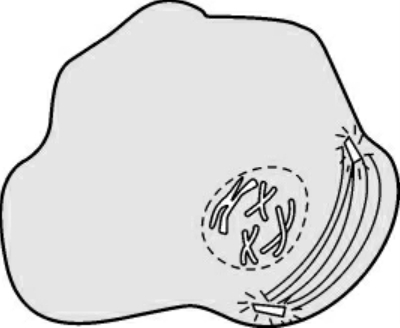
图1-2 前期染色体
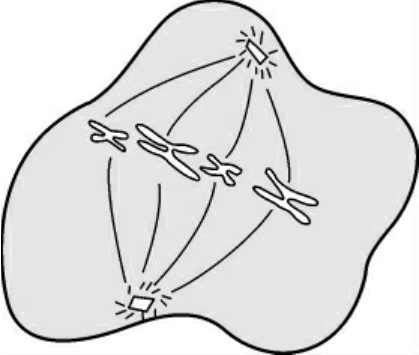
图1-3 中期染色体
4.后期(anaphase) 指姊妹染色单体分开并移向两极的时期,当子染色体到达两极后,标志这一时期结束。染色体着丝点微管在着丝点处去组装而缩短,在分子马达的作用下染色体向两极移动,最后着丝粒分开,染色单体移向两极,几乎所有的姊妹染色单体都同时分裂(图1-4)。
5.末期 是从子染色体到达两极,至形成两个新细胞为止的时期。末期涉及子核的形成和胞质分裂两个方面。末期子核的形成,大体经历了与前期相反的过程,即染色体解聚缩,核仁出现和核膜重新形成(图1-5)。
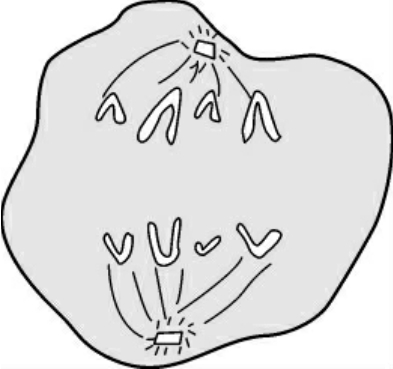
图1-4 后期染色体
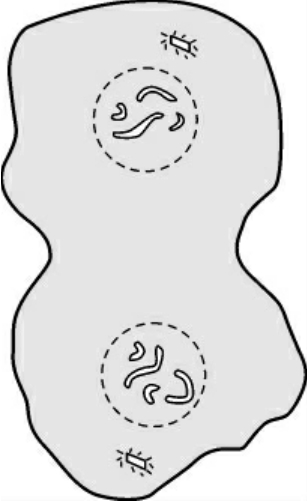
图1-5 末期染色体
在核分裂的后期,细胞中其他物质的分配也开始进行,称为胞质分裂。动物细胞的胞质分裂是以形成收缩环的方式完成的,收缩环在后期形成,由大量平行排列的肌动蛋白和结合在上面的肌球蛋白Ⅱ等成分组成,用细胞松弛素及肌动蛋白和肌球蛋白抗体处理均能抑制收缩环的形成(图1-6)。
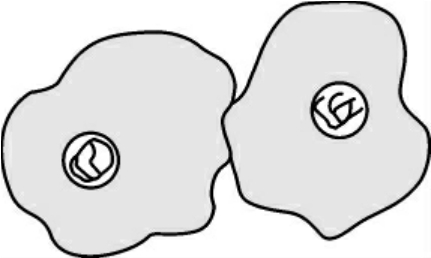
图1-6 子细胞形成
二、间期
细胞从前一次分裂结束到下一次分裂开始之间的间隔期称为间期。根据DNA的复制情况间期分为3个时期:G1期,即第一间隙期或复制前期;S期或称复制期;G2期即第二间隙期,或称复制后期。这3个阶段主要为后面的有丝分裂期做准备工作,合成有丝分裂时必需的核酸、蛋白质、ATP等。
1.G1期 是从有丝分裂完成到DNA复制前的一段时间,又称为合成前期。此期细胞中物质代谢极为活跃,合成rRNA、蛋白质、脂类和糖类。应用RNA合成抑制剂放线菌素D可阻断细胞从G1期进入S期。在G1期,组蛋白发生磷酸化,使染色质的结构改变,有利于S期DNA合成。在G1晚期,细胞合成DNA复制所需要的各种酶类,如DNA聚合酶、解旋酶等;与G1期向S期转变相关的触发蛋白、钙调蛋白、细胞周期蛋白等均在此期合成。
G1期细胞只有在条件合适的情况下才会进入S期。如果条件不合适,细胞就延迟通过G1期,并可能进入G0期的休眠状态。若条件合适,G1期或G0期的细胞会通过一个特定时期,这个特定时期在哺乳动物中称为限制点(restriction point,R点)。通过这个点后,即使细胞生长和分裂的细胞外信号被除去,细胞仍然会进入S期开始DNA合成。但与G1期细胞相比,G0期细胞进入S期需要较长时间进行物质准备。
2.S期 是细胞进行DNA复制的阶段,真核细胞DNA复制在多个起点上进行,复制的启动具有严格的时间顺序。通常,常染色质的复制要早,GC含量较高的在早期复制,AT含量较高的DNA在晚期复制,而雌性动物被钝化的X染色体最后复制。
S期也是组蛋白合成的主要时期,进入S期后,组蛋白mRNA水平可增加50倍。组蛋白的合成是与DNA复制同步进行的,抑制其中一个的合成,均会阻断另一个的合成。可见,组蛋白和DNA在染色质复制过程中相互制约、相互联动,以保证新合成的组蛋白在数量上适应DNA复制的需要。
3.G2期 是从DNA合成结束到细胞分裂开始前的阶段,细胞合成进入M期所需要的结构与功能相关的RNA和蛋白质,像染色质凝集相关蛋白、构成有丝分裂装置的微管蛋白等均在此期合成。此外,已在S期中复制的中心粒,在G2期逐渐长大,并开始向细胞两极分离。在G2期合成的成熟促进因子(maturation promoting factor,MPF)能促进M期的启动,使细胞进入有丝分裂期。
细胞周期进程是在严格调控下进行的,细胞中存在着一个完善而又复杂的细胞周期调控网络系统,这个系统不仅控制着细胞周期中每一个事件顺序进行,还对其控制的过程中
三、细胞周期调控
反馈回来的信息作出反应。细胞周期中有4个点负责监控反馈信号及阻滞细胞周期进程,这些点称为检查点(checkpoint)。它们分别是G1/S期、S期、G2/M期和M期检查点(图1-7)。G1/S期和G2/M期检查点主要监测细胞生长状态、环境条件及DNA损伤情况;S期检查点监测DNA复制有没有完成,若DNA复制不完全就不能开始有丝分裂;M期检查点监测纺锤体有没有组装好,任何一个着丝点没有正确连接到纺锤体上,都会阻止成对姐妹染色单体分离。
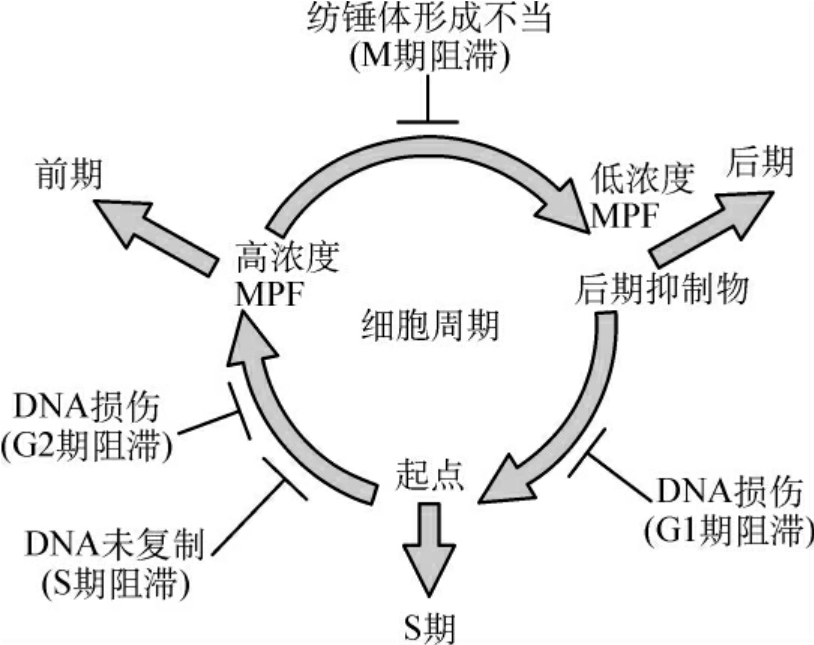
图1-7 细胞周期检查点
引自Lodish,et al.Molecular Cell Biology.3th ed.New York and Oxford:Scientific American Books,Inc.,1995
1.细胞周期调节因子的发现 对于细胞周期调控机制的发现最初来源于两个方面的实验研究。首先是Rao和Johnson(1970、1974)将HeLa细胞同步于不同阶段,然后与M期细胞混合,在灭活仙台病毒介导下,诱导细胞融合,发现与M期细胞融合的间期细胞产生了形态各异的早熟凝集染色体(prematurely condensed chromosome,PCC),这种现象称为早熟染色体凝集(premature chromosome condensation)。
为了进一步研究促使G1期细胞DNA复制以及诱导细胞提前进入有丝分裂的调节因子的本质,用蛙和无脊椎动物的卵母细胞及早期的胚进行了一系列的实验。实验中,在细胞周期的特定阶段分离蛙的卵细胞,并从蛙卵细胞中制备提取物,将它们分别注射到非洲爪蟾的卵母细胞(未受精卵的不成熟的前体)中。发现注射来自M期卵细胞中的提取物,可使间期卵母细胞进入M期。而用来自细胞周期其他阶段的提取物注射入卵母细胞则不能诱导进入M期。这是首次发现在M期的细胞中有促进细胞分裂的因子存在,由于当时对这种因子的化学本质和作用机制都不清楚,只是简单地称为M期促进因子(M-phase promoting factor,MPF)。另一方面,1971年,Masui和Markert用孕酮对卵母细胞进行体外刺激实验,发现成熟M期细胞质中存在一种物质,能诱导不成熟的卵母细胞成熟,称之为成熟促进因子(MPF)。后来证实这两种因子为同一种物质。虽然MPF首先发现于蛙的卵细胞,但后来在所实验用的动物细胞中都发现了MPF,说明这种因子是普遍存在的。
2.细胞周期蛋白(cyclin) 由于MPF的纯化工作困难,所以对它的纯化工作持续了好几年。最后,Lohka于1988年,用柱层析纯化了MPF。实际上MPF是两个不同的亚基组成的异质二聚体,一个是催化亚基p34(CDC2,cell division cycle gene),它能够将磷酸基团从ATP转移到特定底物的丝氨酸和苏氨酸残基上,这种蛋白激酶后来被称为周期蛋白依赖性蛋白激酶(cyclin-dependent protein kinases,CDKs);另一个亚基p45(cyclin B)称为周期蛋白。
1983年Hunt首次发现海胆卵受精后,在其卵裂过程中两种蛋白质的含量随细胞周期剧烈振荡,在每一轮间期开始合成,G2/M时达到高峰,M结束后突然消失,下轮间期又重新合成,故命名为周期蛋白(cyclin),或称为周期素。细胞周期蛋白是一个大家族,目前在高等生物中发现的有周期蛋白A、B、C、D、E、F、G、H和T等,在酵母中有Cln1~3、Clb1~6和Cig等。以细胞周期与CDK结合并起作用的细胞周期阶段来划分,可将周期蛋白归为4种类型:①G1周期蛋白,与以CDK4为主的几种激酶结合,有助于促进细胞通过G1末期的限制点;②G1/S期周期蛋白,在G1末期cyclin E与CDK结合并决定细胞进行DNA复制,使细胞向S期过渡;③S周期蛋白,在S期与CDK结合,是DNA复制起始所需要的;④M周期蛋白,在S末期与CDK1结合,促进有丝分裂。
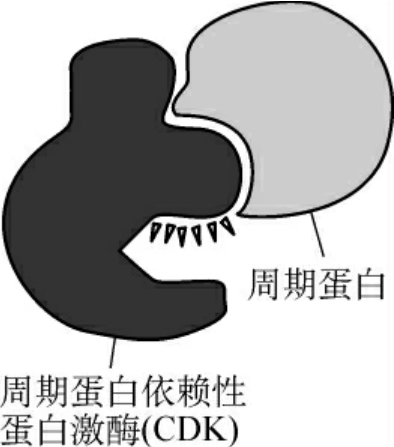
图1-8 cyclin-CDK复合物
引自Alberts,et al.Molecular Biology of the Cell.2nd ed.New York and London:Garland Publishing,Inc.,1994
3.周期蛋白激酶 CDC2与细胞周期蛋白结合才具有激酶的活性,称为细胞周期蛋白依赖性蛋白激酶(CDK),因此CDC2又称为CDK1。激活的CDK1可将靶蛋白磷酸化而产生相应的生理效应,如将核纤层蛋白磷酸化导致核纤层解体、核膜消失,将组蛋白H1磷酸化导致染色体的凝缩等。这些效应的最终结果是细胞周期的不断运行。因此,CDK激酶及其调节因子又被称为细胞周期引擎(图1-8)。
目前,发现的CDK在动物中有7种。各种CDK分子均含有一段相似的激酶结构域,这一区域有一段保守序列,即PSTAIRE,与周期蛋白的结合有关。随着研究的深入,发现大部分CDK家族激酶的蛋白质水平在细胞周期中保持非常恒定的水平,但它们的激酶活性却受周期蛋白的影响而周期性地上升或下降。这种变化直接导致细胞内蛋白质磷酸化的周期性变化,是调节细胞周期的主要事件。因此,CDK活性的调节为细胞周期调控的核心。
4.CDK活性的调节
(1)细胞周期蛋白的降解:CDK活性最主要的调节物是周期蛋白,CDK必须与细胞周期蛋白结合才有蛋白激酶活性。周期蛋白水平的周期性变化导致周期蛋白-CDK复合物周期性地装配和活化,这种活化转而触发细胞周期事件。一旦特定的细胞周期事件完成之后,触发该事件的细胞周期蛋白必须被迅速地降解,这样才能保证细胞周期的正常进行。目前的研究表明,周期蛋白的降解主要依赖于两种不同的酶复合物:SCF(skp1-cullin-F-box protein,3个蛋白构成的复合体)和APC(anaphase promoting complex)。
在中期当MPF活性达到最高时,通过一种未知的途径,激活后期促进复合物APC,将泛素连接在周期蛋白B上,导致周期蛋白B被蛋白酶体(proteasome)降解,完成一个细胞周期(图1-9)。
分裂期周期蛋白N端有一段序列与其降解有关,称为降解盒(destruction box)。当MPF活性达到最高时,通过泛素连接酶催化泛素与周期蛋白结合,周期蛋白随之被26S蛋白酶体水解。G1周期蛋白也通过类似的途径降解,但其N端没有降解盒,C端有一段PEST序列与其降解有关。
泛素由76个氨基酸组成,高度保守,普遍存在于真核细胞,故名泛素。共价结合泛素的蛋白质能被蛋白酶体识别和降解,这是细胞内短寿命蛋白和一些异常蛋白降解的普遍途径,泛素化相当于蛋白质被摧毁的标签。泛素化的蛋白质最后被26S蛋白酶体分解成短肽。
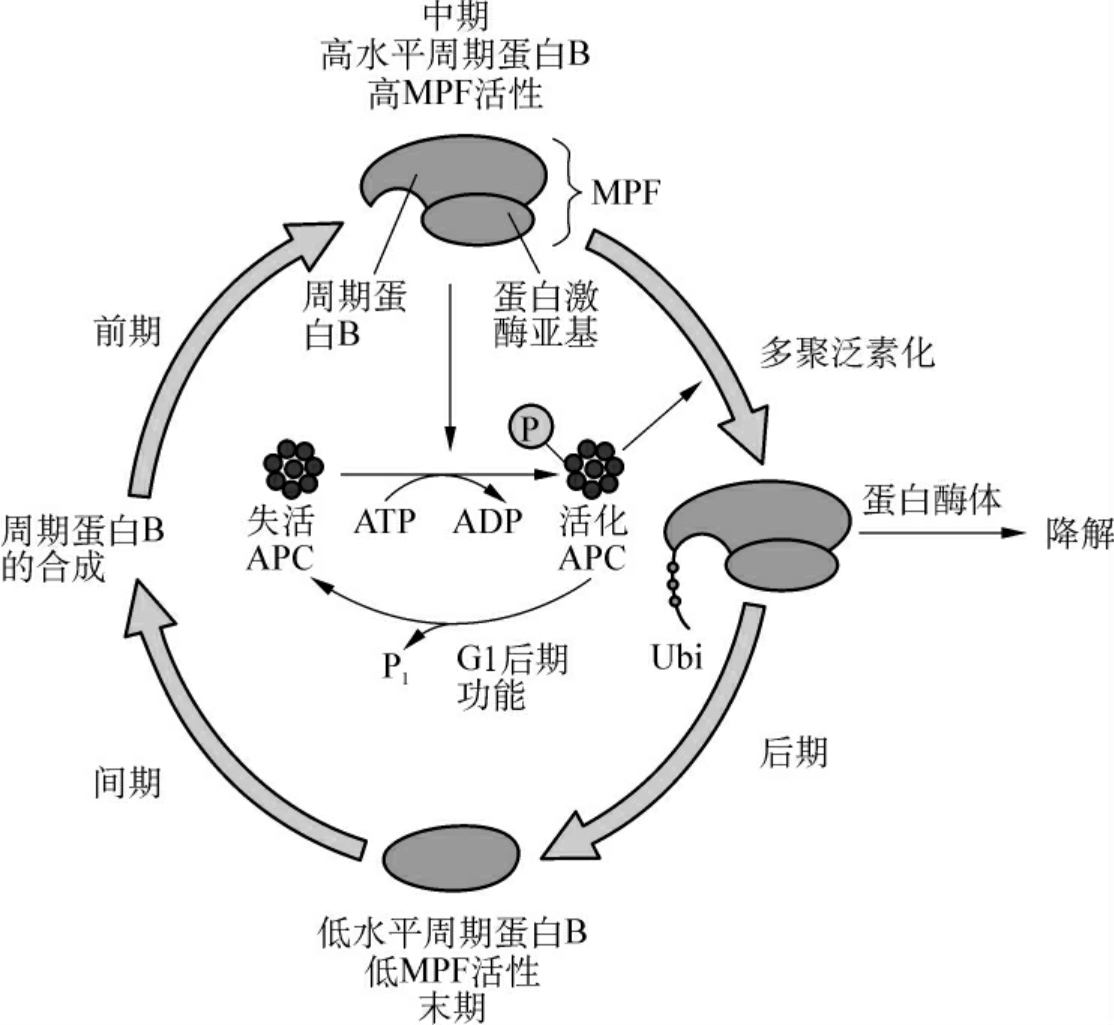
图1-9 Cyclin B的降解途径
引自Lodish,et al.Molecular Cell Biology.4th ed.New York:W H Freeman & Co.,1999
在蛋白质的泛素化过程中(图1-10),E1(泛素活化酶,ubiquitin-activating enzyme)水解ATP获取能量,通过其活性位置的半胱氨酸残基与泛素的C端形成高能硫酯键而激活泛素,然后E1将泛素交给E2(泛素结合酶,ubiquitin-conjugating enzyme),最后在E3(泛素连接酶,ubiquitin-ligase)的作用下将泛素转移到靶蛋白上。参与细胞周期调控的泛素连接酶至少有两类,其中SCF负责将泛素连接到G1/S期周期蛋白和某些CDK抑制蛋白(CDK inhibitor,CKI)上,主要参与G1-S过渡期的调控,启动DNA复制;而APC负责将泛素连接到M期周期蛋白上,主要参与分裂后期姐妹染色体分离以及M期的调控。SCP和APC在细胞周期进程中起重要作用,但它们自身的调节机制以及两者之间的关系还有待于进一步研究。
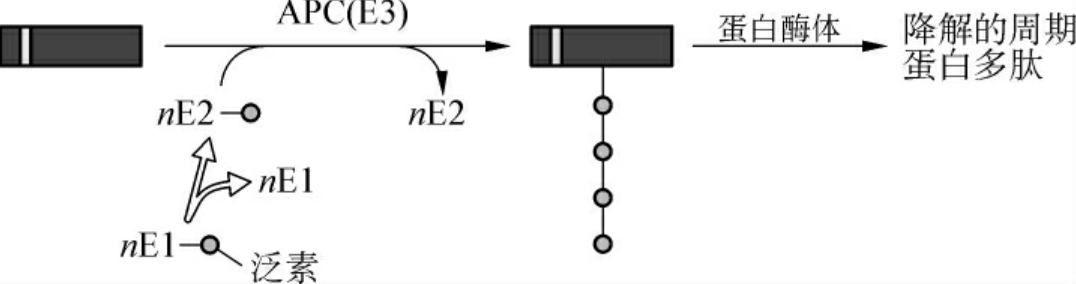
图1-10 细胞周期蛋白的降解盒与降解途径
引自Lodish,et al.Molecular Cell Biology.4th ed.New York:W H Freeman & Co.,1999
细胞周期中有3个关键的过渡,即G1期→S期、中期→后期、后期→末期及胞质分裂期的过渡。这些过渡都是通过触发蛋白质的降解进行的,所以都是不可逆转的,这就迫使细胞周期只能沿一个方向进行。需要指出的是,周期蛋白的降解引起CDK活性的变化,然而,在大多数细胞中,转录调节在细胞周期进程中也起重要作用。例如,多数细胞的周期蛋白,不只是由细胞周期的降解系统所调控,还受到细胞周期蛋白基因的转录和周期蛋白合成的调控因素的严格影响,特别是细胞生长因子的影响。
(2)CDK磷酸化改变和CDK抑制蛋白的作用:细胞周期蛋白与CDK的结合是决定CDK活性的必要条件。然而仅与周期蛋白结合并不能使CDK完全活化,还需要几种激酶和磷酸酶对CDK活性进行精细调节。
以裂殖酵母M-CDK的活化为例,M期CDK的激活起始于分裂期细胞周期蛋白的积累,在胚胎细胞周期中周期蛋白一直在合成,其浓度决定于降解的速度。但在大多数细胞的有丝分裂周期中,周期蛋白的积累是因为在G2-M期M-cyclin基因转录的增强。
随着M-cyclin的积累,结合周期蛋白的M-CDK(CDK1)增加,但是没有活性,这是因为Wee1激酶将CDK1的Thr14和Tyr15磷酸化的缘故,这种机制保证了CDK-cyclin能够不断积累,然后在需要的时候突然释放。
在M期,一方面Wee1的活性下降,降低了CDK1的磷酸化;另一方面CDC25使CDK去磷酸化,去除了CDK活化的障碍。CDC25可被两种激酶激活,一是polo激酶,另一个是M-CDK本身。激活的M-CDK反过来抑制Wee1的活性,形成一个反馈环。因此,不难想象只要有少量的CDK被CDC25或polo激活,立即就会有大量的CDK被活化。CDK的激活还需要Thr161的磷酸化,它是在CDK激酶(CDK-activating kinase,CAK)的作用下完成的。CAK可磷酸化一系列CDKs,包括CDK1、CDK2、CDK3、CDK4、CDK6,从而对细胞周期进行调控。
除了周期蛋白及磷酸化和去磷酸化对CDK活性进行调控外,细胞内还有一些对CDK活性起负调控作用的蛋白质,称为CDK抑制蛋白(CKI)。目前发现的CKI分为两大家族:①Ink4(inhibitor of CDK 4),如p16ink4a、p15ink4b、p18ink4c、p19ink4d,特异性抑制CDK4·cyclin D1、CDK6·cyclin D1复合物;②Kip(kinase inhibition protein):包括p21cip1(cyclin inhibition protein 1)、p27kip1(kinase inhibition protein 1)、p57kip2等,能抑制大多数CDK的激酶活性,p21cip1还能与DNA聚合酶δ的辅助因子PCNA(proliferating cell nuclear antigen)结合,直接抑制DNA的合成。
总之,细胞周期的调控是十分复杂的,细胞周期调节的失衡与肿瘤等许多疾病密切相关。因此,细胞周期调控正是医学研究的一大热点。
四、细胞周期时相的测定和细胞的同步化
(一)细胞周期时相和时间的测定
如何判断一个细胞处于细胞周期中的哪一个阶段?常用的方法包括掺入标记法和流式细胞仪法。
细胞周期进程中的显著特点是DNA的复制,若在细胞培养液中加入的3 H标记的DNA合成前体胸腺嘧啶脱氧核苷(TdR)或人工合成的类似物溴化脱氧尿苷(BrdU),然后通过放射自显影或免疫化学染色,可以判定出不同时相细胞的数量和比例。
在整个细胞周期进程中,只有处于S期细胞的DNA才能被标记。因此,根据有丝分裂中标记细胞所占的比例,可以推断出细胞周期不同时间持续的时间,这就是有丝分裂百分率法(percentage labeled mitoses,PLM)。其原理是对测定细胞进行脉冲标记、定时取材、利用放射自显影技术显示标记细胞,通过统计标记有丝分裂细胞百分数的办法来测定细胞周期。通常使用的是3H或者14C标记的胸腺嘧啶核苷。细胞周期测定原理如图1-11所示:①待测细胞经3H-TDR标记后,所有S期细胞均被标记。②S期细胞经G2期才进入M期,所以一段时间内PLM=0。③开始出现标记M期细胞时,表示处于S期最后阶段的细胞,已渡过G2期,所以从PLM=0到出现PLM的时间间隔为TG2。④S期细胞逐渐进入M期,PLM上升,到达到最高点的时候说明来自处于S期最后阶段的细胞,已完成M期,进入G1期。所以从开始出现M到PLM达到最高点(≈100%)的时间间隔就是TM。⑤当PLM开始下降时,表明处于S期最初阶段的细胞也已进入M期,所以出现PLM到PLM又开始下降的一段时间等于TS。⑥从PLM出现到下一次PLM出现的时间间隔就等于TC,根据TC=TG1+TS+TG2+TM即可求出TG1的长度。
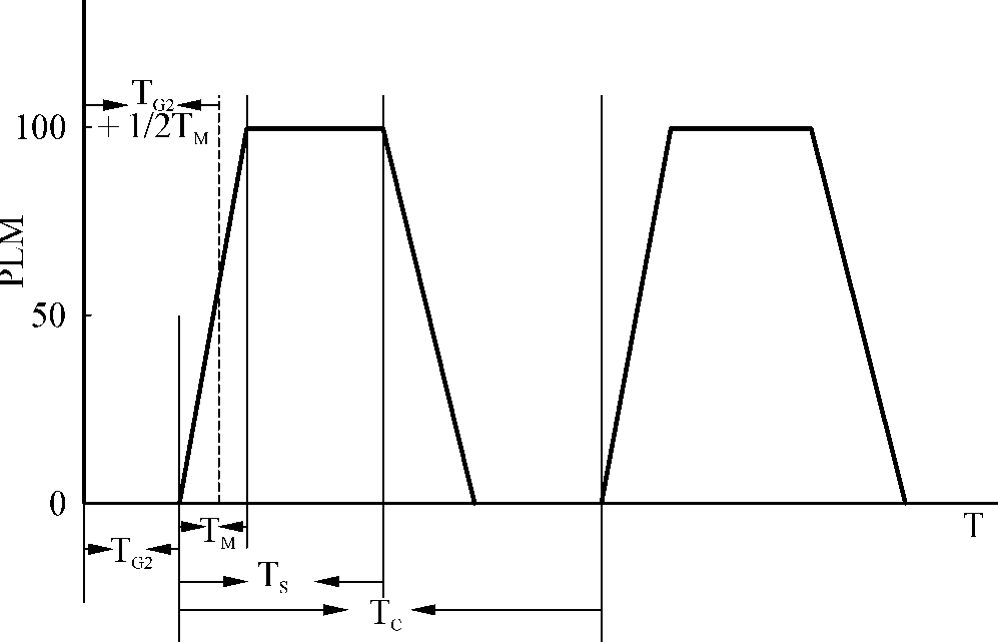
图1-11 细胞周期各阶段的时间与PLM的关系
事实上由于一个细胞群体中TC和各时相不尽相同,第一个峰常达不到100%,以后的峰会发生衰减,PLM不一定会下降到零,所以实际测量时,常以(TG2+1/2TM)-TG2的方式求出TM。
随着流式细胞仪技术的发展,细胞周期时相和时间可以快速测量。其原理是:用荧光染料标记细胞DNA,荧光强度与DNA含量成正比,当细胞逐个通过流式细胞仪的荧光探测装置时,每个细胞的荧光强度被记录下来。在细胞周期各时相中,G2期和M期DNA的含量为G1期的2倍,S期细胞的DNA含量介于两者之间,据此可以直接统计各时相细胞数。还可利用细胞周期蛋白,对细胞周期进行精确的分期。如采用周期蛋白E+A/DNA多参数流式细胞术,可将细胞分为G0期、G1早期、G1晚期、S期、G2期和M期。
(二)细胞的同步化
体外培养的细胞群体通常是处于各个不同周期时相的“混合”细胞,这些细胞对外界的刺激如生长条件、药物、辐射等所引起的反应和机制各不相同。为了探讨某单一时相细胞的活动规律及其对外界干预的反应,需要将体外培养的细胞处于同一状态,共同进入周期的某一特定阶段,这一过程称为细胞同步化(synchronization)。高等真核生物细胞的人工同步化方法包括以下几种。
1.选择同步化
(1)有丝分裂选择法:使单层培养的细胞处于对数增殖期,此时分裂活跃,MI高。有丝分裂细胞变圆隆起,与培养皿的附着性低,此时轻轻振荡,M期细胞脱离器壁,悬浮于培养液中,收集培养液,再加入新鲜培养液,依法继续收集,则可获得一定数量的中期细胞。其优点是操作简单、同步化程度高、细胞不受药物伤害;缺点是获得的细胞数量较少(分裂细胞占1%~2%)。
(2)细胞沉降分离法:不同时期的细胞体积不同,而细胞在给定离心场中沉降的速度与其半径的平方成正比,因此可用离心的方法分离。其优点是可用于任何悬浮培养的细胞,缺点是同步化程度较低。通过离心淘洗法可获得大量G期、S期、G2期加M期不同时相细胞。
2.诱导同步化
(1)DNA合成阻断法:选用DNA合成的抑制剂,可逆地抑制DNA合成,而不影响其他时期细胞的运转,最终可将细胞群阻断在S期或G/S期交界处。氟脱氧尿嘧啶、羟基脲、阿糖胞苷、甲氨蝶呤、高浓度AR、GdR和TdR,均可抑制DNA合成使细胞同步化。其中高浓度TdR对S期细胞的毒性较小,因此常用TdR双阻断法诱导细胞同步化。在细胞处于对数生长期的培养基中加入过量TdR,S期细胞被抑制,其他细胞继续运转,最后停在G1/S期交界处。移去TdR,洗涤细胞并加入新鲜培养液,细胞又开始分裂。当释放时间>TS时,所有细胞均脱离S期,再次加入过量TdR,细胞继续运转至G1/S期交界处,被过量TdR抑制而停止。DNA合成阻断法的优点是同步化程度高,适用于任何培养体系,可将几乎所有的细胞同步化。缺点是产生非均衡生长,个别细胞体积增大。
(2)中期阻断法:利用破坏微管的药物将细胞阻断在中期,从而得到同步于M期的细胞。常用的药物有秋水仙素和秋水仙酰胺,后者毒性较少。该方法的优点是无非均衡生长现象,缺点是可逆性较差。
与选择法相比,诱导同步法的优点是能根据需要获得多种类型的大量同步化细胞,但所用的化学诱导药物可影响到细胞的不均衡生长,或可能干扰细胞周期正常进行的调节等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















