特发性肺纤维化是一种不明原因的特殊类型的慢性致纤维化性间质性肺炎,其特征是病理组织学为寻常型间质性肺炎(UIP)。IPF是许多肺间质疾病的一种,其发病率为3~6/10万人,也有研究发现可能高达13~20/10万人,并呈上升趋势。目前临床尚缺乏有效的治疗方法,从确诊起其平均生存期仅2~3年,5年生存率不足40%。起病隐匿,从症状发作到终末期呼吸功能不全或死亡,病程呈进行性恶化。其突出症状为进行性持续加重的呼吸困难,CT以间质纤维化改变为主,且多见于中年以上,约2/3在60岁后出现症状。对激素及免疫抑制药效果均较差,预后不佳。
一、病因及发病机制
均不明,过去推测可能与病毒、真菌、环境因素和毒性因子等致病因子与肺免疫细胞相互作用,引起炎症及免疫反应,直接损伤上皮细胞有关。然而在采用抗炎和免疫抑制类药物治疗的过程中发现其有效率仅20%~30%,而且伴有严重的不良反应,表明炎症可能不是其首要原因。新的观点认为在IPF发病最初就有成纤维细胞灶的形成。近年来通过大量的临床试验发现氧化/抗氧化失衡,在IPF的发生发展中起重要作用。
二、诊 断
(一)临床表现
多见于50岁以上,起病隐匿渐进,无明显的发病时间,就诊时通常已有1~3年病史,男∶女约2∶1,早期可无阳性特征,平均存活2~4年,死亡率65%~75%,预后差。
1.症状
(1)呼吸困难:为最常见而突出的症状,呈进行性持续加重,且活动后为重。
(2)咳嗽:呈轻重不等的干咳,一般镇咳药不能控制。
2.体征
(1)吸气末爆裂音(Velcro音):典型者为双肺底部闻及吸气末的爆裂音(约占80%),且随病情加重逐渐向上蔓延。
(2)杵状指(趾):40%~80%患者可出现杵状指(趾),且出现较早。
(3)晚期出现肺动脉高压、肺源性心脏病体征及呼吸衰竭表现。
(二)辅助检查
1.肺功能检查 典型表现为限制性通气功能障碍,肺活量(VC)减少,第一秒用力呼气量(FEV1)占用力肺活量(FVC)百分率正常或增加;由于肺泡毛细血管破坏而引起弥散功能障碍,肺泡-动脉血氧分压差(A-aPO2)增大,静息或运动后肺一氧化碳弥散量(DLCO)下降。
2.胸部X线检查
(1)胸片:早期无异常发现,以后可见磨玻璃样阴影,而绝大多数患者在就诊时已出现典型的肺弥漫阴影,以肺下叶及周围分布为主,且病变常为双侧、不对称,以网纹、线条、网结节、结节、蜂窝改变为主要表现,偶见肺门或纵隔增宽。
(2)高分辨率CT(HRCT):病变以肺周边(胸膜下)及肺基底为显。可见磨玻璃样改变(常<30%的肺容积)、不规则线状或网状影、斑片状实变影、小结节影及蜂窝样改变,常见牵引性支气管或细支气管扩张,以上病变混合存在,其中网纹和蜂窝囊肿为其特征性改变。
3.支气管肺泡灌洗(BAL) 支气管肺泡灌洗液(BALF)检查对于IPF无特异性,但其结果可提示或除外其他疾病;若结合临床表现、HRCT及肺功能检查则对IPF诊断意义较大。70%~90%的IPF病人BALF中的中性粒细胞增多,40%~60%病人的嗜酸性粒细胞>5%,10%~20%为淋巴细胞增加,且中性粒细胞2倍于嗜酸性粒细胞的增加。曾有研究认为BALF中若以淋巴细胞增多为主者对治疗(皮质激素)反应较好,预后亦较好;而若以嗜中性及酸性粒细胞为主则皮质激素治疗效果较差,且预后亦差。但以上结果为不恒定的数字,且因病人不能于治疗中耐受多次支气管镜检查,故现认为不宜作为预后的判断指标。
4.肺组织活检及病理特点 电视辅助胸腔镜手术肺活检或开胸肺活检是诊断IPF的最可靠检查方式,可使90%~95%的病例得到确诊。肺活检至少应在不同部位(≥2个肺叶)取材,选择肉眼观察为中等度病变区及相对正常部位取肺组织,要深入到胸膜下的肺实质。经支气管肺活检(TBLB)因其标本过小,且IPF的病变又多呈灶性分布,故不能反映病理学改变的全貌,对IPF诊断意义不大;但因其损伤较小,安全,故病人易接受,且可行多次活检以助排除IPF,并可用一些特殊的组织病理方法或染色确诊一些其他类型的间质疾病,如恶性肿瘤、结节病、嗜酸性肺炎、变应性肺炎等。
IPF病理上表现为病变组织与正常组织互相错杂,不同部位的病变新旧参差,成纤维细胞灶和胶原沉积的瘢痕或蜂窝样变同时存在。
5.诊断标准 根据2011年特发性肺纤维化诊断和治疗循证指南,确诊诊断标准包括:
(1)有外科活检资料①肺组织病理学表现为UIP特点;②除外其他原因所致的间质性疾病(如药物、环境因素、胶原血管病);③限制性肺功能异常及气体交换障碍;④特征性胸片或HRCT改变。
(2)无外科活检资料,需符合以下所有的主要标准及至少3条次要标准。
①主要标准:除外间质性疾病的其他原因;肺功能呈限制性异常及气体交换障碍;HRCT双肺基底部胸膜下网状异常、蜂窝肺、磨玻璃样改变不明显;经纤维(电子)支气管镜肺活检或BALF检查未显示其他疾病的特征。
②次要标准:年龄>50岁;原因不明、隐匿起病的活动后呼吸困难;病程>3个月;双下肺吸气相爆裂音(Velcro音)。
Hunninghake等在8个医疗中心的一项盲法前瞻性研究表明,术前诊疗中心的IPF(UIP)诊断阳性预测值为80%,呼吸病专家小组或影像医学专家小组则分别将阳性预测值提高到87%和95%。故通过呼吸科专家与影像专家共同讨论,可将该病的术前诊断率提高,因而有些病人可不必行手术活检。
2011年新指南首次将影像学表现为UIP型写入IPF的定义,强调高分辨CT是诊断UIP分型的重要依据(表16-1和表16-2)。
三、鉴别诊断
鉴别诊断见表16-3。
表16-1 UIP型HRCT分级诊断标准
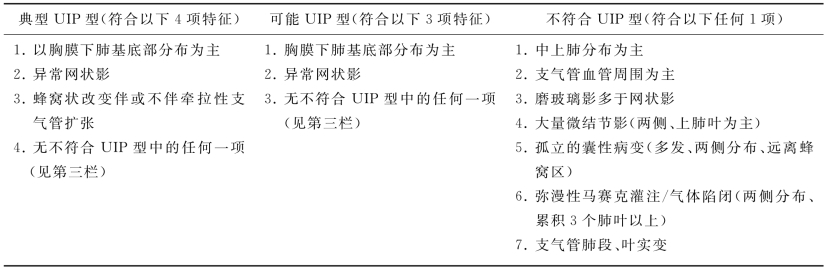
表16-2 UIP型病理组织学诊断标准

表16-3 UIP和NSIP的鉴别

四、治 疗
要观察病程的发展速度及治疗是否奏效可从临床、放射、生理(肺功能)即CRP三方面考虑。经正规治疗后约70%病人有主观症状进步,客观检查生理变化20%~30%进步,肺功能(VC、DLCO)比不治疗前基线提高10%~15%,认为疗效良好。
(一)判断疗效标准
1.进步 治疗后3个月、6个月各检查1次,有下列2项或2项以上进步者。
(1)临床症状减轻:尤其活动能力增加。咳嗽次数减少,咳嗽严重性减轻。
(2)胸片或HRCT病变减少。
(3)肺功能改善(2项或2项以上):①TLC(肺总量)或VC≥10%(或≥200ml);②DLCO≥15%[或≥3ml/(min·mmHg)];③常规心肺功能运动试验后氧饱和度增加(≥4%)或PaO2增加(≥4mmHg)。
2.稳定 治疗后3个月和6个月检查1次,2项或2项以上符合者(稳定亦应视为有效)。
(1)TLC或VC变化<10%或<200ml。
(2)DLCO变化<15%或<3ml/(min·mm-Hg)。
(3)常规心肺运动试验后氧饱和度无变化(或增加<4%或PaO2增加<4mmHg)。
3.无效
(1)呼吸困难和咳嗽加重。
(2)胸片或HRCT阴影增多或出现肺动脉高压。
(3)肺功能降低2项或2项以上:①TLC或VC降低≥10%(或≥200ml);②DLCO降低≥15%[或≥3ml/(min·mmHg)];③氧饱和度恶化(≥4%)或A-aPO2于心肺运动试验后增加(≥4mmHg)。
(二)支持与对症治疗
1.氧疗:吸氧可以减轻运动所致的低氧血症,提高运动耐力。
2.口服可待因溶液和其他镇咳药对有些患者可能有用,也可用于咳嗽复发的患者。
3.肺康复治疗:包括患者评估、运动训练、教育、营养干预和社会心理支持等。
4.对胃食管反流、睡眠呼吸障碍、肺动脉高压、冠状动脉粥样硬化性心脏病等常见并发症进行评价和处理。
6.控制理想体重。
7.对患者实行一系列的肺生理、气体交换、运动能力、HRCT监测,以优化今后临床处理决策。
(三)药物治疗的选择
1.皮质激素 泼尼松为首选药物,以前一直是IPF治疗的惟一方法,但文献报道其疗效不足20%,且作用常为短暂的,可能与其病理改变以纤维化为主,而非炎症反应有关。现主张其用量为0.5mg/(kg·d),持续2~3个月,待主观及客观指标不再进步,即逐渐减量,每次减5mg/d,维持2~3个月,直至减到5~7.5mg/d为最后维持量,或10~15mg/次,隔日1次。如病情恶化可再加大剂量,至病情再度好转并持续一段时间后再慢慢减至维持量。如有效则应长期应用;若无效则应加用免疫抑制药或细胞毒药物,并使原用泼尼松在减量情况下续用4~6周,然后停用,或与小剂量泼尼松联合应用。
2.免疫抑制药 对泼尼松无效或治疗有严重并发症者(年龄>70岁,不能控制的糖尿病、高血压、严重的骨质疏松和消化性溃疡等),改用后有报道认为可获15%~50%的进步,而另有报道则认为该类药物除了不良反应外,其疗效甚微或根本无效。
(1)硫唑嘌呤(MTX):以小剂量为主,初始量为25mg/d,以后据病情逐渐增加,最大不超过100mg/d,选用有效低剂量为维持量,其起效较慢,应用4~6个月或以后观察疗效。常见不良反应为恶心、呕吐、消化性溃疡、腹泻、乏力、白细胞降低、贫血、血小板减少、全血减少,20%~30%的患者因不良反应而停药。
(2)环磷酰胺(CTX):起始剂量应用25mg/d,然后据病情逐渐加量至50mg/d,75mg/d,最大量不超过100mg/d,或与低剂量泼尼松联合使用。其起效缓慢,约3个月后才出现明显疗效,剂量与疗程应据病情及不良反应而定。最常见的不良反应为白细胞减少,贫血、血小板减少;出血性膀胱炎、带状疱疹、停经、肝损害、恶心、腹泻等。
(3)环孢素:曾有少数报道认为治疗IPF有效,但其疗效为暂时性,且费用昂贵,不良反应大(神经系统、肾、消化系统、多毛症等),很少选用。
3.影响胶原合成和纤维化的药物
(1)秋水仙碱:抑制肺泡巨噬细胞衍生生长因子和纤维连接蛋白及刺激成纤维细胞因子的释放,同时降低戒烟者肺泡灌洗液中的中性粒细胞弹性蛋白酶的浓度。以前的研究因缺乏对照组或无组织学证据,或为回顾性总结,缺乏令人信赖的依据。认为以秋水仙碱0.6~1mg/d或0.6mg每日2次,可单用或与低剂量皮质激素合用,可使IPF进步或稳定。但以后的一项对487名IPF/UIP患者(20%的患者经活检证实)的观察发现,在单用秋水仙碱组167例(34%),秋水仙碱加泼尼松组71例(15%),单独应用泼尼松组54例(11%),其他治疗组38例(8%)和无治疗组157例(32%)之间无显著性差异。上述研究证实秋水仙碱有潜在的抗纤维化作用,可用于IPF的治疗,但还不能肯定其治疗的有效性,仍需大量的临床研究证实。
(2)干扰素γ-1b:可抑制成纤维细胞增殖、胶原合成、减少TGF-β产生。可用100~200mg皮下注射,每周3次,联合小剂量泼尼松7.5mg/d治疗,国外研究以IFN-γ1b合并小剂量泼尼松龙和单用泼尼松龙治疗12个月,结果证明IFN-γ1b加低剂量泼尼松龙治疗1年可以稳定或改善肺功能,而单用泼尼松龙的所有患者均没有改善。其不良反应为寒战、发热以及骨骼与肌肉疼痛,用药数日后可消失。
(3)吡非尼酮:作用机制为抑制胶原合成,减少细胞外基质沉积、抑制成纤维细胞增殖、下调TGF-β表达。在一项前瞻性开放研究中,对54例(其中42例经活检证实)不愿接受传统治疗或传统治疗无效的IPF用吡非尼酮治疗,1年生存率78%,2年生存率63%,均优于历史对照,且83%的患者停用了泼尼松,余下17%的患者泼尼松量亦有减少;而且所有用免疫抑制药的患者均停用了免疫抑制药,但该研究缺乏对照,且样本量小,其有效性及安全性待进一步研究证实。2008年10月16日日本厚生健康、劳动和福利保障部批准吡非尼酮用于特发性肺纤维化的治疗。常见不良反应为恶心、乏力、光过敏。
(4)青霉胺:通过干扰胶原的交连防止胶原堆积,用法为750~1500mg口服,但因其不良反应及缺乏有力证据证实其有效性,故目前仍不建议用于IPF治疗。约50%出现不良反应,如食欲缺乏、恶心、呕吐、口腔炎、肾毒性等。
(5)N-乙酰半胱氨酸(NAC):为谷胱甘肽合成的前体,可发挥抗氧化作用,并保护肺泡上皮免受氧自由基的损伤。国外研究发现,与单独应用细胞毒药物和免疫抑制药相比,IPF患者经口服大剂量NAC(1800mg/d),BALF中谷胱甘肽总浓度及还原型谷胱甘肽浓度均明显提高,持续使用1年后,肺功能显著改善。目前认为可作为治疗IPF的辅助方法。
(6)干扰素β-1a:体外试验提示可抑制成纤维细胞增殖、抑制胶原产生,动物实验发现IFN-β可以减少鼠的放射性纤维化。一项多中心研究显示,用该药15~60mg,每周2次肌内注射,治疗1~2.5年,结果显示该药无明显疗效。
(7)脂氧化酶及白三烯受体拮抗药:研究发现花生四烯酸脂氧化酶通路参与了IPF患者的发生发展过程,目前已有将脂氧化酶抑制药Zilenton和白三烯受体拮抗药扎鲁司特及孟鲁司特用于治疗IPF的报道,且显示了一定疗效。
(8)血管紧张素转化酶抑制药(ACEI):IPF发生过程中肺的成纤维细胞可产生血管紧张素,血管紧张素可上调致纤维化细胞因子TGF-β1的表达、介导肺泡上皮细胞的凋亡,从而使损伤区域不能形成上皮层而致该区域的永久性纤维增殖。ACEI可通过多种机制抑制纤维化进程。巯甲丙脯酸可完全抑制血管紧张素的上述作用。目前正进行该类药物治疗IPF的临床试验。
(9)其他抑制成纤维细胞增殖或介导其凋亡的药物
①洛伐他汀:据报道其临床达到的有效浓度在体外可介导人肺成纤维细胞的凋亡,在体内可以减少肉芽组织的形成,并在豚鼠外伤性纤维增殖模型中可以诱导成纤维细胞的凋亡。
②舒拉明:体外试验中,舒拉明可以对抗多种能促进纤维化的生长因子,如TGF-β、胰岛素样生长因子-1、血小板衍生生长因子、上皮样生长因子和成纤维细胞生长因子等,在体内舒拉明也可以延缓创伤的愈合。
③松弛素:抑制TGF-β在细胞外基质中的表达,在体外试验中刺激胶原酶的产生,在小鼠体内,显示可以抑制博来霉素引起的纤维化。
④二十烷类物质:前列腺素PGE2可以抑制成纤维细胞的增殖和细胞外基质的沉积,可能改善IPF的纤维化进程。吲哚美辛是环氧酶的抑制药,在动物模型中可以抑制博来霉素引起的肺纤维化,但是其对人类IPF的影响还未见报道。白三烯B4在IPF患者的BALF和肺组织中均有增高,对白三烯的抑制也许是有效的方法。
⑤贝拉康坦:在体外贝拉康坦可以促进成纤维细胞的凋亡,诱导胶原酶-1表达,减少I型胶原。
⑥基因治疗:基因特异性反义治疗如抗c-Ki-RAS寡核苷酸可抑制人类成纤维细胞的增殖;TGF-β1抑制药(如decorin,又名修饰素);Smad7转基因;IFN-γ转基因治疗等。
4.其他药物 可阻断TNF-α的药物;IL-12或抑制IL-4及IL-13的药物以纠正Th1/Th2的失衡;ET-1抑制药均为今后研究药物应用的方向。
5.肺移植 是治疗终末期IPF的主要手段,可明显改善患者的生命质量和生存率,5年生存率约40%。对内科治疗无效者,行肺移植后约40%可存活5年。ISHLT提出出现以下情况应行肺移植:①DLco<39%预测值;②在6个月的随访中,FVC下降10%或以上;③6min步行距离测定中,脉搏血氧饱和度(SpO2)<88%;④HRCT有蜂窝(纤维化评分>2分)。
附录
2011年特发性肺纤维化诊断和治疗循证指南
一、概 念
IPF是病因未明的慢性进展性纤维化型间质性肺炎的一种特殊类型,好发于老年人,病变局限于肺部,组织病理学和(或)影像学表现具有UIP的特征。诊断IPF需要排除其他各种间质性肺炎,包括其他类型的特发性间质性肺炎(IIP)及与环境暴露、药物或系统性疾病相关的间质性肺疾病。
二、定义和流行病学特征
(一)临床表现
所有表现为原因不明的慢性劳力性呼吸困难,并且伴有咳嗽、双肺底爆裂音和杵状指的成年患者均应考虑IPF的可能性。其发病率随年龄增长而增加,典型症状一般在60—70岁出现,<50岁的IPF患者罕见。男性明显多于女性,多数患者有吸烟史。
(二)发病率和患病率
目前尚无关于IPF发病率和患病率的大规模研究。美国新墨西哥州伯纳利欧县的一项研究结果显示,IPF的年发病率男性约为10.7/10万,女性约为7.4/10万。英国的一项研究认为IPF年发病率为4.6/10万,但1991—2003年,IPF发病率以每年约11%的速度增长,并认为这与人口老龄化或轻症患者确诊率增加无关。另据美国一个大规模的健康保险数据库推算,IPF的年发病率为(6.8~16.3)/10万。
文献报道普通人群中IPF的患病率为(2~29)/10万,造成这种差异的原因可能与缺乏统一的IPF诊断标准、研究设计方案及研究对象的不同等因素有关。目前还不明确IPF发病率和患病率是否受地理、民族、文化或种族因素的影响。
(三)潜在危险因素
1.吸烟 吸烟与IPF紧密相关,尤其是吸烟量>每年20包时;这种关联现象在家族性IPF和散发性IPF中均存在。
2.环境暴露 研究结果显示,某些环境暴露因素与IPF患病风险增高相关,如金属粉尘(黄铜、铅及钢铁)和木质粉尘(松木)。从事农耕、鸟类饲养、理发、石材切割/抛光等职业以及暴露于牲畜和蔬菜粉尘/动物粉尘等也与IPF的发病相关。
3.病原微生物 一些研究结果显示,慢性病毒感染可能是IPF的病因之一,尤其是EB病毒和丙型肝炎病毒。包括病毒在内的多种病原体与IPF的相关性受多种混杂因素的影响,如IPF患者在接受免疫抑制治疗后容易合并这些病原体的感染,EB病毒在普通人群中的患病率也很高。所以,目前虽然有很多相关研究,但微生物在IPF发病中的作用尚不肯定。
4.胃食管反流 一些研究结果显示,胃食管反流(GER)可增加误吸的发生,是导致IPF发病的危险因素之一。IPF患者常合并GER,但大多数患者GER的IPE临床症状并不明显。GER在普通人群及其他原因所致的晚期肺疾病中也很常见。目前尚不明确IPF患者的肺顺应性降低导致的胸内压力改变是否会反过来导致GER的发生,因此,GER与IPF之间的关系还有待进一步研究明确。此外,最近还有其他危险因素的报道,如糖尿病。
(四)遗传因素
1.家族性肺纤维化 家族性肺纤维化占所有IPF患者的比例<5%。家族性IPF在诊断标准、临床表现和肺病理等多方面与散发性IPF相同。不过家族性IPF发病时间较早,基因转录模式与散发性IPF不同。常染色体显性的可变性外显率是家族性肺纤维化的最主要遗传模式。近年来的研究结果显示,人端粒酶反转录酶(hTERT)基因或人端粒酶RNA(hTR)基因的突变与家族性IPF和部分散发性IPF有关。
2.遗传因素在散发性IPF中的作用 研究结果显示,包括编码多种细胞因子、酶及促纤维化因子的基因、编码表面活性蛋白A和B以及免疫调节基因等多种基因的多态性与散发性IPF患者发病率增加有关,其中部分基因还被认为与疾病进展有关,但进一步的研究并未明确肯定。委员会并不推荐对家族性或散发性IPF患者在临床评估中常规进行基因检测。
三、UIP型的定义
(一)HRCT的特征
HRCT是IPF诊断流程中的重要组成部分。HRCT上UIP的特征为胸膜下和肺基底部的网格状阴影和蜂窝影,常伴有牵张性支气管扩张,尤其是蜂窝影对IPF的诊断有很重要的意义。HRCT上的蜂窝影指成簇的囊泡样气腔,蜂窝壁边界清楚。囊泡直径为3~10mm,偶尔可大至25mm。磨玻璃影常见,但病变范围少于网格状影。如果UIP型合并胸膜病变,如胸膜斑块、胸膜钙化或大量的胸腔积液,则提示UIP型病变可能由其他疾病所致。HRCT上出现大量微结节、气体陷闭、非蜂窝样囊泡、大量磨玻璃样改变、肺实变或者病变以沿支气管血管束分布为主,应该考虑其他诊断。部分患者可伴纵隔淋巴结轻度增大(短径通常<1.5cm)。HRCT诊断UIP的阳性预测值为90%~100%。若HRCT无蜂窝影,但其他影像特征符合UIP标准,定义为可能UIP,需进行外科肺活检确诊。HRCT不符合UIP型的患者,外科肺活检的病理表现仍有可能是UIP型表现(表16-4)。
(二)组织病理学特征
UIP的组织病理学特征和主要诊断标准是在低倍镜下病变的不均一性。即瘢痕形成和蜂窝样改变的纤维化区域与病变轻微或正常的肺实质区域交替出现。病变主要位于胸膜下和间隔旁的肺实质,一般情况下炎症反应轻,表现为淋巴细胞和浆细胞在肺间质中的斑片状浸润伴Ⅱ型肺泡上皮细胞和细支气管上皮细胞增生。纤维化区域主要由致密胶原组成伴上皮下散在的成纤维母细胞灶。蜂窝样改变区域由囊状纤维化气腔构成,这些气腔内衬细支气管上皮细胞。充满黏液和炎症细胞。纤维化和蜂窝样改变区域的间质内常有平滑肌上皮细胞化生。病理学上需要与UIP鉴别的疾病相对较少,尤其是病理改变符合UIP型表现时。主要的鉴别诊断在于与其他可引起UIP样病变的疾病的鉴别,如结缔组织疾病、慢性外源性变应性肺泡炎和尘肺(尤其是石棉肺)。“不可分类的纤维化”指肺活检标本镜下表现为纤维化,但不符合上述UIP型的诊断标准;若其镜下表现缺乏典型的某些疾病(如外源性变应性肺泡炎、结节病等)的组织病理学特征,但有典型的IPF的临床表现和影像学表现时,经仔细的多学科讨论后仍有可能诊断为IPF。
四、诊 断
(一)X线胸片(高千伏摄片)
1.常表现为网状或网状结节影伴肺容积减小。随着病情进展,可出现直径多在3~15mm大小的多发性囊状透光影(蜂窝肺)。
2.病变分布:多为双侧弥漫性,相对对称,单侧分布少见。病变多分布于基底部、周边部或胸膜下区。
3.少数患者出现症状时,X线胸片可无异常改变。
(二)HRCT
1.HRCT扫描有助于评估肺周边部、膈肌部、纵隔和支气管-血管束周围的异常改变,对IPF的诊断有重要价值。
2.可见次小叶细微结构改变,如线状、网状、磨玻璃状阴影。
3.病变多见于中下肺野周边部,常表现为网状和蜂窝肺,亦可见新月形影、胸膜下线状影和极少量磨玻璃影。多数患者上述影像混合存在。在纤维化严重区域常有牵引性支气管和细支气管扩张,和(或)胸膜下蜂窝肺样改变。
(三)肺功能检查
1.典型肺功能改变为限制性通气功能障碍,表现为肺总量(TLC)、功能残气量(FRC)和残气量(RV)下降。第一秒用力呼气量占用力肺活量百分率(FEV1/FVC)正常或增加。
2.单次呼吸法一氧化碳弥散(DLCO)降低,即在通气功能和肺容积正常时,DLCO也可降低。
3.通气/血流比例失调,PaO2、PaCO2下降,肺泡-动脉血氧分压差[P(A-a)O2]增大。
(四)BALF检查
1.BALF检测的意义在于缩小ILD诊断范围即排除其他肺疾病(如肿瘤、感染、嗜酸性粒细胞肺炎、外源性变应性肺泡炎、结节病和肺泡蛋白沉积症等)。但对诊断IPF价值有限。
表16-4 UIP型HRCT分级诊断标准

2.IPF患者的BALF中中性粒细胞(PMN)数增加,占细胞总数5%以上,晚期部分患者同时出现嗜酸性粒细胞增加。
(五)血液检查
1.IPF的血液检查结果缺乏特异性。
2.可见红细胞沉降率增快,丙种球蛋白、乳酸脱氢酶(LDH)水平升高。
3.出现某些抗体阳性或滴度增高,如抗核抗体(ANA)和类风湿因子(RF)等可呈弱阳性反应。
(六)组织病理学改变(表16-5)
1.开胸/胸腔镜肺活检的组织病理学呈UIP改变。
2.病变分布不均匀,以下肺为重,胸膜下、周边部小叶间隔周围的纤维化常见。
3.低倍显微镜下呈“轻重不一,新老并存”的特点,即病变时相不均一,在广泛纤维化和蜂窝肺组织中常混杂炎性细胞浸润和肺泡间隔增厚等早期病变或正常肺组织。
4.肺纤维化区主要由致密胶原组织和增殖的成纤维细胞构成。成纤维细胞局灶性增殖构成所谓的“成纤维细胞灶”。蜂窝肺部分由囊性纤维气腔构成,常常内衬以细支气管上皮。另外,在纤维化和蜂窝肺部位可见平滑肌细胞增生。
5.排除其他已知原因的ILD和其他类型的IIP。
五、诊断标准
诊断IPF标准可分为有外科(开胸/胸腔镜)肺活检资料和无外科肺活检资料。
(一)有外科肺活检资料
1.肺组织病理学表现为UIP特点。
2.除外其他已知病因所致的间质性肺疾病,如药物、环境因素和风湿性疾病等所致的肺纤维化。
3.肺功能异常,表现为限制性通气功能障碍和(或)气体交换障碍。
4.胸片和HRCT可见典型的异常影像。
(二)无外科肺活检资料(临床诊断)
缺乏肺活检资料原则上不能确诊IPF,但如患者免疫功能正常,且符合以下所有的主要诊断条件和至少3项的次要诊断条件,可临床诊断IPF。
1.主要诊断条件
(1)除外已知原因的ILD,如某些药物毒性作用、职业环境接触史和风湿性疾病等。
(2)肺功能表现异常,包括限制性通气功能障碍(VC减少,而FEV1/FVC正常或增加)和(或)气体交换障碍[静态/运动时P(A-a)O2增加或DLCO降低]。
(3)胸部HRCT表现为双肺网状改变,晚期出现蜂窝肺,可伴有极少量磨玻璃影。
(4)经支气管肺活检(TBLB)或BALF检查不支持其他疾病的诊断。
2.次要诊断条件
(1)年龄>50岁。
(2)隐匿起病或无明确原因进行性呼吸困难。
(3)病程≥3个月。
(4)双肺听诊可闻及吸气性Velcro啰音。
表16-5 UIP型病理组织学诊断标准

六、鉴别诊断
IPF除了与其他原因引起的ILD相鉴别外,还需要与其他类型的IIP相鉴别。IPF占所有IIP的60%以上,NSIP次之,而DIP/RBILD和AIP相对少见。把UIP与其他类型IIP区别开来至关重要,因其治疗和预后有很大区别。
(一)脱屑性间质性肺炎/呼吸性细支气管炎伴间质性肺疾病(DIP/RBILD)
1.DIP:男性多发,绝大多数为吸烟者。起病隐袭、干咳,进行性呼吸困难。50%患者有杵状指(趾)。实验室检查无特殊,肺功能呈限制性通气功能障碍,弥散功能降低,但不如IPF/UIP显著。影像学上早期出现双肺磨玻璃样改变,后期也出现线状、网状、结节状间质影像。与UIP不同的是DIP通常不出现蜂窝样改变。
RBILD:临床表现同DIP。杵状指(趾)相对少见。影像学上2/3患者HRCT出现网状-结节影,未见磨玻璃影。
2.DIP显著的病理学改变是肺泡腔内肺泡巨噬细胞(AM)均匀分布,见散在多核巨细胞。与此相伴的是轻、中度肺泡间隔增厚,伴少量炎性细胞浸润,无明显的纤维化和成纤维细胞灶。在低倍镜下病变均匀分布,时相一致,与UIP分布多样性形成鲜明对比。当AM聚积以细支气管周围气腔为主,而远端气腔不受累时,这一病理便称为RBILD。
3.多数糖皮质激素治疗反应良好。
(二)急性间质性肺炎(AIP)
1.AlP原因不明,起病急骤,临床表现为咳嗽、严重呼吸困难,继之很快进入呼吸衰竭。多数病例发病前有“感冒”样症状,半数以上患者有发热。肺部影像学检查表现为双侧弥漫性网状、细结节及磨玻璃样阴影。急骤进展可融合成斑片乃至实变影。
2.病理表现为弥漫性肺泡损伤(DAD)机化期改变。
3.AIP预后不良,病死率极高,生存期很短,多在1~2个月死亡。
(三)非特异性间质性肺炎(NSIP)
1.可发生于任何年龄,男性多于女性,主要临床表现为咳嗽、气短,少数患者有发热。
2.影像学上表现为双侧间质性浸润影,双肺斑片磨玻璃阴影是本病CT特征性所见。
3.病理改变为肺泡壁明显增厚,呈不同程度的炎症和纤维化,病变时相一致,但缺乏UIP、DIP或AIP的特异性改变。肺泡结构破坏较轻,肺泡间隔内由淋巴细胞和浆细胞混合构成的慢性炎症细胞浸润是NSIP的特点。
4.本病对糖皮质激素反应好,预后良好。
七、治 疗
(一)药物治疗
根据现有文献,委员会认为目前尚无治疗IPF的有效药物,但一些临床药物试验的结果提示某些药物可能对IPF患者有益。推荐强度反映了委员会对该干预措施的疗效与不良反应之间的权衡结果:对大部分治疗方案的推荐意见都是强反对,即缺乏足够证据支持应该常规使用这些药物治疗;对一些治疗的推荐意见是弱反对,表明这些治疗的收益与风险尚不明确。还需要更高质量的研究结果来证实。弱反对的药物可能适用于一些特定的患者,对于充分知情并强烈要求药物治疗的患者,推荐选用这些弱反对的药物。
1.强推荐,很低质量证据 ①IPF患者不应该接受糖皮质激素单药治疗;②IPF患者不应该接受秋水仙碱治疗;③IPF患者不应该接受环孢素治疗;④IPF患者不应该接受糖皮质激素与免疫抑制药的联合治疗。
2.弱推荐,低质量证据 ①多数IPF患者不应该接受糖皮质激素、硫唑嘌呤及乙酰半胱氨酸联合治疗,但对于少数患者可能是合理的治疗措施;②多数IPF患者不应该接受乙酰半胱氨酸单药治疗,但对于少数患者此治疗可能是合理的选择。
3.强推荐,高质量证据 IPF患者不应该接受干扰素-γ治疗。
IPF患者是否应该接受波生坦治疗?
4.强推荐,中等质量证据 ①IPF患者不应该接受波生坦治疗;②IPF患者不应该接受益赛普治疗。
5.弱推荐,很低质量证据 多数患者不应该接受抗凝血治疗,但对少数患者抗凝血治疗可能是合理的选择。
6.弱推荐,低-中等质量证据 多数患者不应该接受吡非尼酮治疗,但对少数患者该药物可能是合理的选择。
7.尚无推荐意见的药物 西地那非,伊马替尼。
(二)非药物治疗
委员会推荐的适用于IPF患者的一些非药物治疗措施如下。
1.强推荐,很低质量证据 有静息低氧血症的IPF患者应该接受长期氧疗。
2.强推荐,低质量证据 某些合适的IPF患者应该接受肺移植治疗。
3.弱推荐,低质量证据 ①多数IPF引起的呼吸衰竭不应该接受机械通气,但对于少数患者机械通气可能是合理的选择;②多数IPF患者应该接受肺康复治疗,但对于少数患者肺康复治疗可能是不合理的选择。
(三)针对并发症和伴发疾病的治疗
IPF患者的常见并发症和伴发疾病越来越受到人们的关注,主要包括IPF急性加重、肺动脉高压、胃食管反流、肥胖、肺气肿和阻塞性睡眠呼吸暂停结合征。目前尚不明确治疗这些伴发的疾病是否会影响IPF患者的预后。由于迄今为止尚无IPF患者伴发肥胖、肺气肿和阻塞性睡眠呼吸暂停综合征治疗方面的研究资料,因此,委员会无法给予推荐意见。
弱推荐,很低质量证据:①多数IPF急性加重时应该接受糖皮质激素治疗,但对少数患者来说,糖皮质激素治疗可能是不合理的选择;②多数IPF患者不应该接受针对肺动脉高压的治疗,但对少数患者来说可能是合理的选择;③多数IPF患者应该接受针对无症状胃食管反流的治疗,但对少数患者来说可能是不合理的选择。
(四)姑息治疗
姑息治疗旨在减轻患者症状和减少痛苦,而不是治疗疾病。姑息治疗的目标是减轻患者生理与精神上的痛苦,为患者及其家属提供心理与精神上的支持。这些治疗措施均需个体化,是疾病辅助治疗的一部分。IPF患者咳嗽和呼吸困难等症状的恶化很常见且疗效差。有限的研究结果提示,糖皮质激素和沙利度胺可能缓解IPF患者的慢性咳嗽;慢性阿片类药物可用于治疗严重呼吸困难和咳嗽,但需要严密监测药物不良反应。
(五)推荐的药物和剂量
迄今,对肺纤维化尚没有一种令人满意的治疗方法。临床较常用的药物包括糖皮质激素、免疫抑制药/细胞毒药物和抗纤维化制剂。上述药物可以单独或联合应用,其使用剂量和疗程应视患者的具体情况制定。推荐治疗方案为:糖皮质激素联合环磷酰胺或硫唑嘌呤,具体方法如下(供参考)。
1.糖皮质激素 泼尼松或其他等效剂量的糖皮质激素,每日0.5mg/kg(理想体重,以下同)口服4周;然后每日0.25mg/kg,口服8周;继之减量至每日0.125mg/kg或0.25mg/kg隔天1次口服。
2.环磷酰胺 按每日2mg/kg给药。开始剂量可为每日25~50mg口服,每7~14天增加25mg,直至最大量150mg/d。
3.硫唑嘌呤 按每日2~3mg/kg给药。开始剂量为25~50mg/d,之后每7~14天增加25mg,直至最大量150mg/d。
(六)疗程与疗效判定
1.疗程
(1)一般治疗3个月后观察疗效,如果患者耐受好,未出现并发症和不良反应,可继续治疗至少6个月以上。
(2)已治疗6个月以上者,若病情恶化,应停止治疗或改用、合用其他药物;若病情稳定或改善,应维持原有治疗。一般多主张联合用药。
(3)已治疗12个月以上者若病情恶化,应停止治疗或改用、合用其他药物治疗;若病情稳定或改善,也可维持原有治疗。
(4)治疗满18个月以上的患者,继续治疗应个体化。
2.疗效判定
(1)反应良好或改善:①症状减轻,后动能力增强;②X线胸片或HRCT异常影像减少;③肺功能表现TLC、VC、DLCO、PaO2较长时间保持稳定。以下数据供参考:TLC或VC增加≥10%,或至少增加≥200ml;DLCO增加≥15%或至少增加3ml/(min·mmHg);SaO2增加>4%;心肺运动试验中PaO2增加≥4mmHg(具有2项或2项以上者认为肺生理功能改善)。
(2)反应差或治疗失败:①症状加重,特别是呼吸困难和咳嗽;②X线胸片或HRCT上异常影像增多,特别是出现了蜂窝肺或肺动脉高压迹象;③肺功能恶化。以下数据供参考:TLC或VC下降≥10%或下降>200ml;DLCO下降≥15%或至少下降≥3ml/(min·mmHg);SaO2下降≥4%,或运动试验中P(A-a)O2增加≥4mmHg(具有2项或2项以上者认为肺功能恶化)。
(徐 玲)
参考文献
[1] Behr J.Lung function in idiopathic pulmonary fibrosis-extended analysis of the IFIGENIA trial[J].Respir Res,2009,10:101.
[2] KingJr T E.Effect of interfer on gamma-1bon survival in patients with idiopathic pulmonary fibrosis(INSPIRE):amulticentre,randomised place bocontral-1trial[J].Lancet,2009,374(9685):222-228.
[3] Datta A,Scotto C J,Chambers R C.Novel therapeutic approaches for pulmonary fibrosis[J].Br J Pharmacol,2011,163(1):141-172.
[4] Kliment C R,Oury T D,Oxidative stress,extracellular matrix targets,and idiopathic pulmonary fibrosis[J].Fra Radic Biol Med,2010,49(5):707-717.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















