第二节 共聚焦显微镜在穿透性角膜移植术后随访中的应用
共聚焦显微镜是穿透性角膜移植术(penetrating keratoplasty, PKP)(图4-10)后随访中的一项重要工具,可用于观察活体状态下植片各层细胞的情况,尤其是内皮细胞的情况、角膜神经的修复与再生等,并对早期发现术后并发症如内皮功能失代偿、植片排斥等具有重要意义。
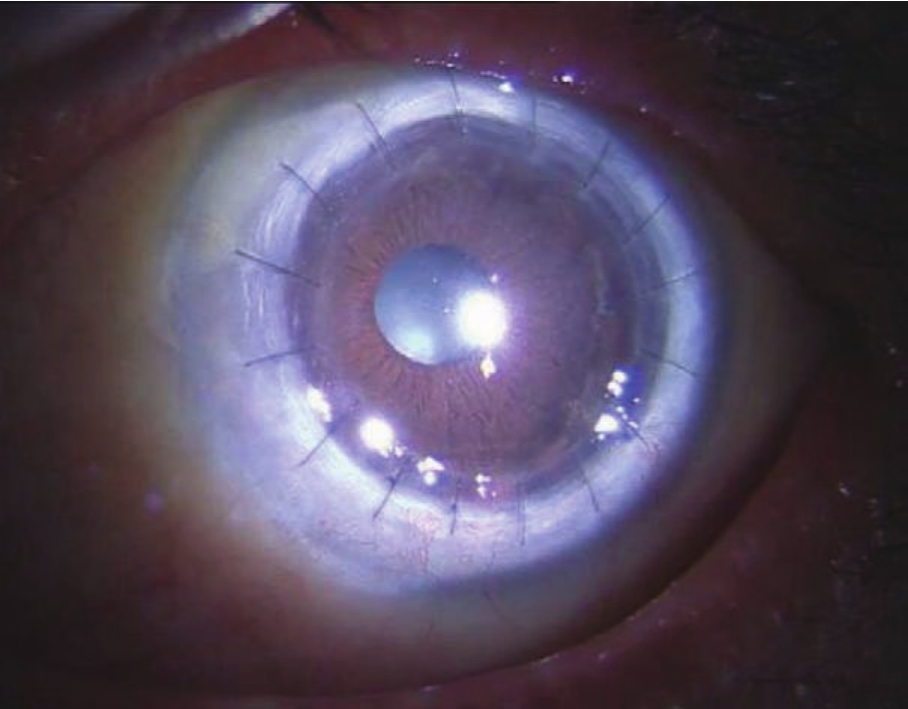
图4-10 PKP术后患者的裂隙灯像
注:可见植片透明,前房深度良好,瞳孔圆
一、PKP术后情况的观察
1.角膜内皮细胞 角膜内皮细胞是维持角膜透明状态的重要成分。正常情况下随着年龄的增长,角膜内皮细胞数量逐渐下降。特别是在PKP术后,内皮细胞丢失率往往明显上升。既往研究表明,PKP术后10年,即使无任何并发症(即未发生排斥、内皮功能失代偿或再次手术)的植片,内皮细胞丢失率也达到67%±18%,特别是术后1~2年的内皮细胞丢失率最高,可达30%以上,之后逐渐下降,术后5~10年内皮细胞每年丢失率平均为4%。所以定期评估PKP术后角膜内皮细胞的数量、细胞形态以及六边形细胞占总细胞数的比例(图4-11),对于判断植片预后具有重要意义。

A. PKP术后1年患者的内皮细胞密度为1 861个/mm2,可见大部分细胞仍为六边形,但有少数细胞形态异常(红色箭头处),且可见一个八边形细胞(黑色箭头处)

B.在植片/植床交界处可见中间的低折光带。左侧为植床,植床上的内皮细胞基本为六边形(白色箭头所指处);右侧为植片,可见数个四边形内皮细胞(白色虚线箭头所指处)。植片上的内皮细胞平均面积明显大于植床
图4-11 共聚焦显微镜在PKP术后观察到的角膜内皮细胞
(X 1 000,NIDEK CS系列)
笔者对200余例PKP术后植片情况稳定病例进行随访结果表明: PKP术后1年角膜内皮细胞平均密度为2 158个/mm2(1 218~2 646个/mm2);术后2年内皮细胞平均密度下降至1 758个/mm2 (1 002~2 259个/mm2);术后3年平均密度进一步下降至1 443个/ mm2(867~2 167个/mm2)(图4-12)。结果与国内外的文献报道接近。在形态学研究方面,也发现PKP术后患者角膜内皮细胞形态有不同程度异常。当六角形细胞比例下降时,可见四边形及八边形内皮细胞,并且细胞大小差异度和平均细胞面积均高于正常人群。此外,还发现内皮细胞密度越低,细胞大小差异度越高,平均细胞面积越大。

A. PKP术后6个月,可见内皮细胞之间有多个暗区(白色箭头),内皮细胞密度约为2 300个/mm2

B. PKP术后18个月,可见内皮细胞之间的暗区明显增多,细胞轮廓受到明显破坏,细胞密度为1 800 个/mm2左右

C. PKP术后2年,内皮细胞密度为1 292个/mm2,细胞大小差异度明显增加,可见数个八角形内皮细胞,细胞面积明显大于邻近细胞(△)

D. PKP术后3年,内皮细胞密度937个/mm2,细胞内可见高反光的细胞核样结构,细胞大小差异明显,六边形细胞比例明显下降
图4-12 共聚焦显微镜观察1例PKP术后的角膜内皮细胞
(X 1 000,NIDEK CS系列)
2.角膜基质和角膜上皮 正常情况下,共聚焦显微镜下仅能见到角膜基质细胞的胞核,而见不到基质细胞的胞体。但在PKP术后早期,角膜基质中往往可见到大量处于激活状态的基质细胞,胞体呈有突起的多角形,体积较大,高反光;而胞核往往反光较弱,因此胞核与胞质不易区分。数月之后,胞体的高反光特性将会逐渐消退,胞核又重新可见。但PKP术后角膜基质细胞的胞核往往较小、排列较紊乱,并且密度大多低于正常人群(图4-13)。

A. PKP术后3个月,可见大量呈激活状态的基质细胞,胞体呈有突起的多角形,高反光,而胞核基本无法分辨

B. PKP术后1年,仍可见较多呈激活状态的角膜基质细胞,但已可见部分细胞胞核

C. PKP术后角膜基质内可见许多纵形暗纹,基质细胞的胞核较小、排列较紊乱,且密度低于正常

D.浅基质层内可见高反光物质沉积,沉积物附近的基质细胞形态较难分辨,但仍然可见神经纤维(箭头)
图4-13 共聚焦显微镜观察PKP术后的角膜基质(X 1 000,NIDEK CS系列)
在缝线附近的角膜基质以及深层角膜基质中,往往见到中低反光的纵形条纹,与圆锥角膜深基质层中的纵形暗纹类似,推测可能与缝线牵拉造成基质内形成细小的皱褶有关。此外,在极少数植片透明的患者中,还可见到浅基质层内有高反光物质沉积于细胞基质之间,在此附近的基质细胞往往无法辨认。这种高反光物质的来源和性质目前尚不清楚,还有待于进一步的研究。
PKP术后情况稳定的植片,其上皮细胞形态与正常上皮细胞基本相同,且细胞密度也无明显差异(图4-14)。

图4-14 共聚焦显微镜观察PKP术后的角膜上皮(X 1 000,NIDEK CS系列)
注:PKP术后3年,稳定的角膜植片的上皮细胞层(E)、上皮细胞基底层(EB)和前弹力层(BM)形态与正常角膜无明显差异
3. PKP术后角膜神经的恢复与再生 传统检查方法无法观察到活体状态下角膜神经的情况,而共聚焦显微镜可以无创伤、动态地观察到PKP术后角膜神经的恢复和再生情况。据观察总结,PKP术后3~6个月即可在植片周边部观察到细小再生的角膜神经纤维,但是在植片中央区域却见不到再生的神经纤维。术后1年左右,浅基质层和中基质层可见到部分再生的神经纤维。但是,上皮下神经丛的恢复和再生则至少需要2~3年(图4-15)。

A. PKP术后1年,在角膜基质内可见再生的神经纤维,但与正常角膜基质神经相比,再生的神经纤维纤细且扭曲明显

B. PKP术后1年,前弹力层处尚未见典型的神经纤维,但可见早期处于芽生状态的细小神经纤维(箭头)
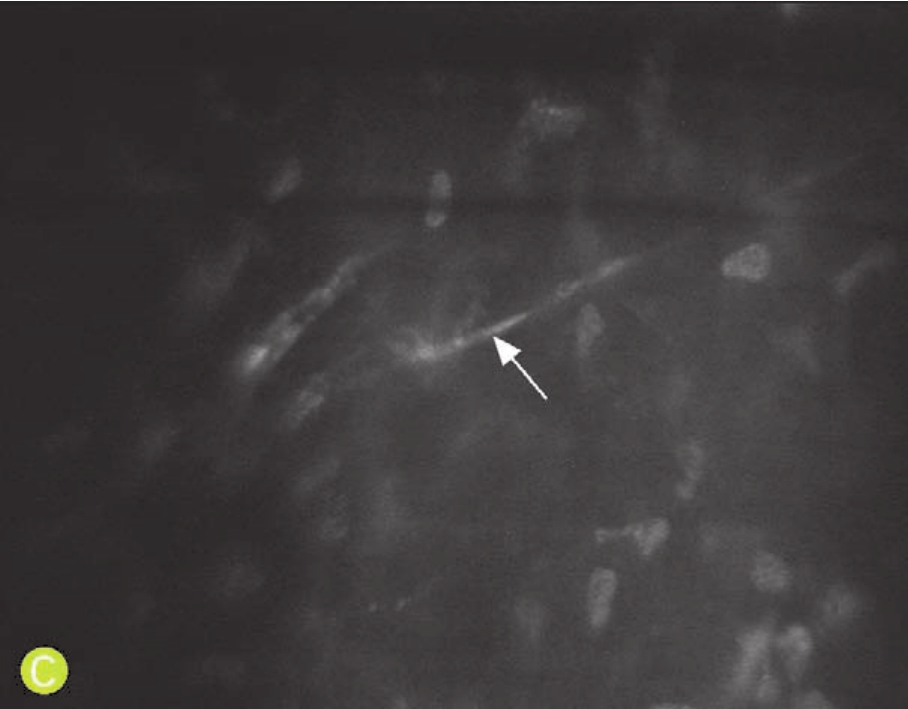
C. PKP术后2年,角膜基质内见再生的神经纤维,与正常的神经纤维相比仍较纤细,但已无明显扭曲

D. PKP术后30个月,前弹力层处可见再生的神经纤维,形态与正常上皮下神经丛接近,但神经分支较少
图4-15 共聚焦显微镜观察PKP术后的角膜神经(X 1 000,NIDEK CS系列)
另外,PKP患者再生神经纤维的形态往往与正常的神经纤维有所差异。据文献报道,这可能与患者年龄和原发疾病有关。一般来说,老年患者或者术前诊断为角膜营养不良和大疱性角膜病变患者,术后再生的神经纤维形态和直径往往异于正常,可以表现为神经异常扭曲、走行方向异常以及明显粗于或细于正常的神经纤维。
4.植片/植床愈合过程 有研究表明,PKP术后1周左右在植片/植床结合处及缝线周围即形成瘢痕。在随后的3~4周,瘢痕反应继续加重,以后逐渐趋于稳定。缝线周围的瘢痕组织仅在围绕缝线的表浅部分形成,位于角膜深层的缝线周围则很少形成,除非缝线穿透或非常靠近内皮层。笔者的研究结果与此类似,在术后2年,靠近角膜内皮层的植片与植床之间并未见到明显的瘢痕组织(图4-11B)。另外,植床/植片钻切整齐,对合较好处瘢痕组织往往较轻;而在对合不佳处瘢痕形成较为明显。瘢痕形成程度的不同以及缝线的松紧、深浅可能都会对术后的角膜散光产生影响。
二、PKP术后移植排斥反应的表现和诊断
角膜移植术后免疫排斥反应是导致手术失败的重要原因(图4-16)。

图4-16 PKP术后排斥患者的裂隙灯像
注:箭头所示处为排斥线,排斥线以下角膜水肿、混浊,排斥线以上的角膜尚透明
有关角膜移植术后免疫排斥反应的发生机制及防治研究是提高角膜移植手术质量的重要课题。应用共聚焦显微镜可在活体上对角膜移植术后免疫排斥反应的角膜移植片进行三维实时水平的扫描检测。
1.角膜上皮层 上皮排斥线是上皮型排斥反应的主要表现。以排斥线为界,可见两个不同区域上皮细胞呈现完全不同的形态改变。上皮排斥线未经过的区域,上皮表层细胞与基质细胞排列整齐,表层细胞排列较疏松而基质细胞排列较紧密,边界清楚,细胞数目正常,一般很少见到朗格汉斯细胞(图4-17)。排斥线所经过的区域,上皮表层细胞边界模糊,胞核反光度降低,细胞间可见许多由于表皮细胞坏死脱落留下的暗区;基底细胞数目明显减少,在接近前弹力层的基底上皮区域伴明显的朗格汉斯细胞浸润(图4-17)。

A.排斥线未经过区域,角膜上皮形态正常

B.排斥线经过区域,角膜上皮结构完全破坏,细胞边界模糊,胞核反光降低

C.排斥线经过区域的角膜上皮基底层内见大量朗格汉斯细胞浸润
图4-17 共聚焦显微镜观察PKP术后角膜上皮排斥(X 800, HRT系列)
2.角膜基质层 基质型排斥反应大多与内皮型排斥反应共存。共聚焦显微镜下可见角膜基质细胞普遍处于激活状态,细胞体积增大,胞体变形,胞核数量减少;在细胞形态模糊不清的基质细胞背景中,出现数量不等、分布不均、胞体较小、胞核反光明亮的炎症细胞。这些炎症细胞较多分布在移植片缝线及新生血管周围,而且这种改变往往早于基质细胞的改变(图4-18)。

A.浅基质层内见大量处于激活状态的基质细胞,胞体呈多角形突起,并相连形成蜂窝状,胞核较难分辨(X 800,HRT系列)

B.深基质层内也可见大量处于激活状态的基质细胞,但细胞胞体较浅基质层内的细胞大,且密度较低,部分细胞的胞核勉强可辨(X 800,HRT系列)

C.排斥角膜水肿,背景反光增强,并见大量炎症细胞浸润
(X 1 000,NIDEK CS系列)
图4-18 共聚焦显微镜观察PKP术后角膜基质排斥
3.角膜内皮 内皮型排斥反应主要表现为内皮排斥线。共聚焦显微镜下内皮排斥线有典型的形态改变,由小的反光明亮的炎症细胞和胞体增大、六边形结构消失、边界不清、核固缩的异常内皮细胞构成。内皮排斥线经过的区域,角膜内皮细胞数目明显减少,边界不清,六边形形态消失,胞体增大呈伪足状v在内皮细胞改变之后,相应区域的基质细胞也呈肿胀改变,上皮细胞之间的间距拉大(图4-19)。
目前,角膜移植排斥反应的机制仍未完全明了,针对角膜移植术后排斥的临床防治研究也面临着许多挑战。临床医师的早期诊断对于改善患者的预后有着重要作用。传统的早期诊断方法主要靠患者主诉如视矇、移植片透明度改变等和医师借助裂隙灯检查作出综合判断。这些诊断方法均为主观测验,缺乏足够的客观指标。目前针对该病的早期及亚临床型诊断均存在一定的困难,因而往往在明确诊断时,患者角膜移植片各层细胞特别是内皮细胞均已遭到不可逆性的损害。

A.内皮排斥线经过区域,内皮细胞边界不清,胞体增大,失去正常的六边形镶嵌结构

B.内皮排斥线未经过区域,内皮细胞形态基本正常
图4-19 共聚焦显微镜观察PKP术后角膜内皮排斥(X 800,HRT系列)
共聚焦显微镜对角膜移植排斥反应的早期诊断具有重要的临床意义,能为角膜移植排斥反应的鉴别诊断提供四维的活体细胞学证据。研究发现,角膜移植片排斥初期时患者的临床症状及体征尚不明显,移植片边缘新生血管扩张,并且血管壁上可见蠕动、胞体较小及反光度强的细胞。与此同时,角膜移植片的各层细胞也有相应的特征改变:上皮排斥线经过区域上皮表层及基质细胞均出现胞体肿胀、胞核模糊,表皮细胞可出现由于坏死脱落的空泡状等改变;基质细胞受累时,胞核拉长,细胞间隙加宽,炎症细胞浸润于基质细胞之间,上皮下神经纤维呈串珠状改变;内皮排斥则在典型的内皮排斥线出现前已有内皮细胞形态改变和白细胞浸润等。这些活体细胞的三维形态改变,可极大地提高角膜移植排斥反应早期诊断的敏感性与准确性,为临床早期治疗提供准确的科学依据。
共聚焦显微镜可在活体上为角膜移植排斥反应的发生与发展、治疗反应及预后随访提供连续的动态观察。角膜移植排斥反应是一个由细胞和体液参与的复杂过程,以往的研究只能依据动物实验和离体组织病理切片或铺片进行研究,缺少活体细胞学依据。共聚焦显微镜可提供高清晰度的活体细胞图像,为角膜移植排斥反应的研究提供有力的活体细胞病理学证据。即使在角膜混浊时,仍能清楚显示细胞的形态改变以及各层细胞与浸润免疫细胞的量化指标。由于该项检查无创伤性,因而可对发生排斥反应的角膜进行连续监测。共聚焦显微镜提供的这些详细资料为角膜移植术后排斥反应的发病机制及细胞病理学研究提供了前所未有的科学依据,可使该病的诊治从定性向定量过渡,有效提高角膜移植排斥反应的诊治水平,具有广阔的研究前景。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















